Взаимодействие клеток крови и соединительной ткани при воспалении
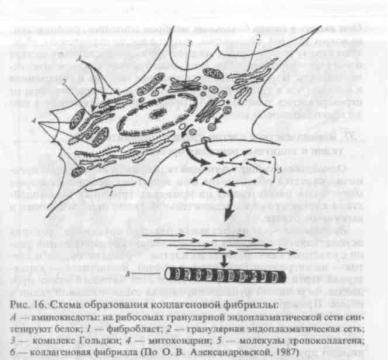
Воспаление в соединительной ткани. Процессы воспаления в соединительной ткани.
Рыхлая соединительная ткань — это система многих клеточных дифферонов, или гистогенетических рядов — дивергентных линий клеточной дифференцировки. Несмотря на большое разнообразие клеточных форм, все они составляют единую систему, выполняющую защитную и трофическую функции. Между кровью и соединительной тканью существуют тесные взаимосвязи и постоянный обмен клеточными элементами.
Структурно-функциональной единицей соединительной ткани считается гистион. Он включает участок микроциркуляторного русла с окружающими его клетками и межклеточными структурами. Рыхлая соединительная ткань находится в динамических взаимодействиях с другими тканями, в частности, с эпителиальными, ретикулярной, эндотелиальной, жировой, пигментной, плотными волокнистыми соединительными тканями.
Воспаление и регенерация. При действии повреждающих агентов (механических, химических, бактериальных и других) в рыхлой соединительной ткани развивается сложная сосудисто-тканевая защитно-приспособительная реакция — воспаление. При воспалении наблюдаются как общие, так и местные изменения. Местные проявления реакции организма в очаге воспаления включают несколько взаимосвязанных фаз: 1) альтерация (повреждение) тканей; 2) высвобождение физиологически активных веществ — так называемых медиаторов воспаления; 3) сосудистая реакция с экссудацией, включающая изменение кровотока в микроциркуляторном русле, повышение проницаемости сосудов; 4) резорбция продуктов распада тканей; 5) пролиферация клеток с образованием «грануляционной ткани» и последующей регенерацией тканей. Завершается воспаление образованием зрелой волокнистой соединительной ткани.
При описании воспаления обычно выделяют три фазы: лейкоцитарную, с преобладанием в очаге воспаления нейтрофильных гранулоцитов; макрофагическую, когда продукты распада активно резорбируются макрофагами; фибробластическую, на протяжении которой на месте повреждения разрастается соединительная ткань.
Лейкоцитарная фаза воспаления характеризуется передвижением нейтрофильных гранулоцитов в очаг распада ткани на месте ее повреждения. Пусковым механизмом воспаления является выброс медиаторов и цитокинов (гистамина, серотонина, лизосомных гидролаз и других биологически активных веществ). Источником выделения медиаторов являются тканевые базофилы (тучные клетки), лейкоциты, кровяные пластинки, макрофаги и лимфоциты. При этом развивается комплекс сосудистых изменений, включающий повышение проницаемости микроциркуляторного русла, экссудацию жидких составных частей плазмы, эмиграцию клеток крови. Уже через 6 ч от начала воспаления образуется лейкоцитарный инфильтрат. Нейтрофильные гранулоциты проявляют высокую фагоцитарную активность, поглощая главным образом микроорганизмы (отсюда их название — микрофаги). Часть нейтрофилов при этом распадается, выделяя большое количество лизосомных гидролаз. Это способствует очищению очага воспаления от поврежденных тканей.
Макрофагическая фаза воспаления протекает при явлениях активизации макрофагов как гематогенных (возникающих из моноцитов крови), так и гистиогенных (оседлых макрофагов — гистиоцитов). Макрофаги энергично фагоцитируют продукты тканевого распада. Вместе с тем они вырабатывают вещества — стимуляторы восстановительных процессов в очаге воспаления.
Фибробластическая фаза является завершающей фазой воспаления. Она характеризуется пролиферацией (размножением) клеток фибробластического ряда и их передвижением к воспалительному очагу. Поскольку к этому времени заканчивается в основном очищение места повреждения от продуктов тканевого распада, фибробласты заполняют бывший дефект ткани. Они интенсивно вырабатывают межклеточное вещество. При этом образуются вначале тонкие аргирофильные, а позднее и коллагеновые волокна. Вместе с клетками эти волокна отграничивают воспалительный очаг от неповрежденной ткани. Развитие фибробластов постепенно приводит к замещению воспалительного очага соединительной тканью. При значительном дефекте ткани на месте очага воспаления формируется рубец. При наличии инородного тела вокруг него образуется соединительнотканная капсула, отчетливо выраженная на 5-7-е сутки от начала воспаления. Относительно источников развития фибробластов в очаге повреждения существуют разные гипотезы. Так различают две субпопуляции фибробластов, имеющие разные источники и отличающиеся неодинаковой продолжительностью жизни (коротко- и долгоживущие фибробласты).
Фибробласты, которые развиваются из стволовых кроветворных клеток — это короткоживущая популяция фибробластов защитно-трофического типа, участвующая в процессах воспаления, заживления ран и т. д. Другие фибробласты происходят от стволовых стромальных клеток (механоцитов) костного мозга. Это популяция долгоживущих фибробластов опорного типа с преимущественно механическими функциями. Кроме того, существуют специализированные формы фибробластов — фиброкласты и миофибробласты, развивающиеся из адвентициальных клеток. Фиб-рокласты обеспечивают перестройку соединительной ткани путем разрушения межклеточного вещества. В цитоплазме клеток обнаруживается хорошо развитый аппарат лизиса коллагеновых фибрилл. Клетки выявляются преимущественно в области формирования рубцовой ткани после повреждения органов. Миофибробласты отличаются от фибробластов большим содержанием сократительных филаментов (актина гладкомышечного типа). Они также участвуют в регенерации путем контракции краев раны.
— Также рекомендуем «Ткани с опорно-механической функцией. Плотные волокнистые соединительные ткани.»
Оглавление темы «Костные ткани. Мышечные ткани.»:
1. Воспаление в соединительной ткани. Процессы воспаления в соединительной ткани.
2. Ткани с опорно-механической функцией. Плотные волокнистые соединительные ткани.
3. Костные ткани. Остеогистогенез.
4. Развитие костной ткани на месте хряща. Остеокласты. Пластинчатая костная ткань.
5. Ткани с двигательной функцией. Скелетная мышечная ткань. Гистогенез скелетной мышечной ткани.
6. Строение скелетной мышечной ткани. Регенерация скелетной мышечной ткани.
7. Сердечная мышечная ткань. Строение сердечной мышечной ткани.
8. Гладкая мышечная ткань. Строение гладкой мышечной ткани.
9. Мионевральная ткань. Миоидные клетки.
10. Ткани нервной системы. Гистогенез нервной системы.
Источник
Защитная функция соединительной ткани проявляется в реакции воспаления, репаративной регенерации, иммунных реакциях. В их реализации участвуют как клетки, межклеточное вещество соединительной ткани, так и клетки крови.
Воспаление — стереотипная защитно-приспособительная реакции на местное повреждение (инфекция, травма, гипоксия и т.д.). Морфологически в развитии воспалительной реакции выделяют несколько частично перекрывающихся фаз (рис. 14.4).
Фаза альтерации характеризуется появлением очага поражения в ткани в результате воздействия неблагоприятного фактора. Компоненты поврежденных тканей выделяют медиаторы воспаления. В частности, тучные клетки выделяют гистамин, гепарин, се-

Рис. 14.4. Схема последовательных фаз асептического воспаления [ 571: а — стадия альтерации; 6 — стадия экссудации и лейкоцитарная; в — стадия экссудации и макрофагическая; г — стадия пролиферации (фибробластиче- ская); 1 — капилляр; 2 — базальная мембрана; 3 — разрушенная тучная клетка; 4 — кариорексис; 5 — инородное тело; 6 — набухшие эндотелиоциты; 7 — диапедез нейтрофильпых гранулоцитов; 8 — эритроцит; 9 — гибнущий ней- трофильпый гранулоцит; 10 — фибробласт; 11 — лимфоцит; 12 — моноцит;
13 — макрофаг; 14 — гибнущие лимфоциты; 15 — диапедез лимфоцитов
ротонин, которые увеличивают проницаемость капилляров. Вазоактивные вещества выделяются также макрофагами, базофилами крови, тромбоцитами.
Фаза экссудации проявляется:
- 1) изменением микроциркуляториого русла в результате активации клеток и выделения активных веществ в первой фазе. Проявляется покраснением и повышением температуры участка воспаления;
- 2) появлением бесклеточного экссудата в результате выхода жидкой части крови в ткань. Возникает отек ткани, который клинически проявляется припухлостью. В этой фазе отмечается замедление кровотока, гидратация межклеточного вещества соединительной ткани, что обеспечивает выход лейкоцитов из кровотока.
Лейкоцитарная фаза характеризуется появлением клеток в экссудате, в первую очередь нейтрофильных лейкоцитов. Они формируют лейкоцитарный вал, который отделяет очаг поражения от здоровой ткани. В очаге воспаления нейтрофильные лейкоциты фагоцитируют микроорганизмы, при этом сами могут погибнуть, образуя гной. Эти клетки выделяют вещества, которые привлекают в очаг воспаления моноциты крови.
Макрофагическая фаза реализуется макрофагами. Под влиянием цитокинов экзогенных пирогенов (эндотоксины, белок микроорганизмов) макрофаги активируются и фагоцитируют погибшие нейтрофилы, клеточный дендрит, микроорганизмы, формируя второй антимикробный барьер. Сами макрофаги вырабатывают интеролейкин-1 (повышает температуру тела), ряд ферментов, которые разрушают компонентны межклеточного вещества. Макрофаги также выступают в роли антигенпредставляющих клеток и инициируют иммунные реакции.
Фибробластическая фаза связана с привлечением в очаг воспаления фибробластов. Клетки, инфильтрирущие очаг воспаления (макрофаги, лимфоциты и др.), выделяют фибронектин, фактор роста фибробластов, макрофагические факторы стимуляции роста кровеносных сосудов и др., стимулируют синтетическую активность фибробластов, способствуют росту сосудов. В результате восстанавливается поврежденная рыхлая волокнистая соединительная ткань. Вначале она характеризуется высоким содержанием клеточных элементов и кровеносных сосудов — это грануляционная ткань. Впоследствии эта ткань преобразуется в плотную соединительную ткань — рубец.
Источник
Организм и отдельные органы часто подвергаются повреждениям — при травмах, оперативных вмешательствах, действии радиации, химических веществ, вирусов, бактерий и др. В процессе регенерации поврежденных органов обязательно участвует соединительная ткань и клетки крови. При этом на действие любого фактора развивается так называемая воспалительная реакция, включающая определенную последовательность клеточных реакций.
Воспаление — это проявление пластических свойств соединительной ткани, это универсальная реакция, имеющая выраженный защитный эффект. Вместе с тем, воспаление часто имеет и обратную сторону, т. к. при нем происходит разрушение и патологическая перестройка воспаленных тканей.
Воспаление осуществляется с участием, как собственных клеток рыхлой соединительной ткани, так и клеток крови (лейкоцитов). Воспаление — характерная черта не только практически всех патологических процессов, но и способ функционирования соединительной ткани в норме. Примером последнего может служить пищеварительное воспаление, постоянно протекающее в соединительнотканной строме слизистых оболочек пищеварительного тракта.
В воспалении выделяют следующие фазы:
1) Фаза альтерации — повреждение ткани и выделение медиаторов воспаления. Гуморальные медиаторы поступают из плазмы крови, клеточные медиаторы выделяются клетками крови и РВСТ.
Повреждающий фактор активирует дегрануляцию тканевых базофилов. Выделяется гистамин, гепарин, серотонин др. Вазоактивные вещества выделяют также макрофаги, базофилы крови, тромбоциты и другие клетки.
2) Фаза экссудации — вазоактивные вещества приводят к стазу крови в капиллярах «очага поражения», увеличивают просвет и проницаемость капилляров. Выход жидких частей плазмы из капилляров приводит к образованию отеков, начинается миграция из сосудов лейкоцитов. Гидратация межклеточного вещества соединительной ткани усиливает подвижность содержащихся в ней клеток.
3) Лейкоцитарная фаза — начинается в первые часы после действия повреждающего фактора и достигает максимума через 12–24 ч. Сначала мигрируют нейтрофильные лейкоциты, а через 6 ч начинается миграция агранулоцитов. Нейтрофилы фагоцитируют и разрушают поврежденные клетки, их обломки, микроорганизмы. При этом они сами могут погибать, образуя гной, но выделяемые ими хемотаксические вещества привлекают новых нейтрофилов. Лейкоциты на границе с неповрежденным участком образуют лейкоцитарных вал, отделяя здоровую ткань от поврежденной. Одновременно лейкоциты выделяют вещества, вызывающие выход из крови в ткань моноцитов.
4) Макрофагическая фаза — выселившиеся моноциты превращаются в зрелые макрофаги. Они с помощью фагоцитоза обеспечивают очищение очага повреждения от погибших клеток и инородных тел. Макрофаги вырабатывают эндогенные пирогены, приводящие к повышению температуры.
Одновременно с моноцитами или несколько позже в очаг воспаления мигрируют Т- и В-лимфоциты, обеспечивающие развитие иммунных реакций.
Макрофаги выделяют вещества — стимуляторы восстановительных процессов, которые активируют фибробласты (миграцию, пролиферацию, коллагеногенез) и новообразование сосудов, обеспечивая процесс заживления.
5) Фибробластическая фаза — на 2–5-е сутки в очаге повреждения происходит накопление фибробластов и врастание сосудов. Фибробласты, разрушая старый коллаген, интенсивно продуцируют новый, перестраивая межклеточное вещество. На месте воспаления образуется богато васкуляризованная молодая рыхлая соединительная ткань (грануляционная ткань), в которой сравнительно мало волокон. Активная работа фибробластов постепенно увеличивает количество коллагена, обеспечивая нарастание массы соединительной ткани, или формирование капсулы вокруг инородных тел. Закрытие дефекта происходит на 7–14-е сутки. Грануляционная ткань преобразуется в плотную, формируя рубец на месте повреждения. При этом относительно увеличивается число коллагеновых волокон, вследствие гибели уменьшается число клеток, фибробласты превращаются в фиброциты, новообразованные сосуды подвергаются обратному развитию.
В процессе иммунного ответа происходит взаимодействие клеток крови и соединительной ткани, в известной степени сходное с описанной схемой воспаления. К основным процессам добавляются процессы распознавания поступивших в организм или образующихся вновь антигенов Т- и В-лимфоцитами. Важнейшую при этом роль играют макрофаги, осуществляющие специфический фагоцитоз благодаря рецепторам к опсонинам (связям клеточной мембраны с антителом или комплексом антитела и коплемента). Перерабатывая появившийся в организме корпускулярный или растворимый антиген, замаскированный собственными белками организма, макрофаг презентирует очищенный антиген иммунокомпетентному лимфоциту и вступает с ним в кооперацию, запуская клеточный или гуморальный иммунный ответ.
При повреждении тканей РВСТ быстро заполняет поврежденные участки, способствуя восстановлению сосудов и целостности органа. Если ее рост обгоняет регенерацию функциональной ткани (например, гепатоцитов печени, гладкомышечной ткани в стенке кишки и т.д.), то соединительная ткань ухудшает функцию всего органа, а рубцы могут нарушать кровоснабжение и иннервацию, приводить к спайкам или сужать просвет полых органах.
При повреждении тканей не способных к клеточной регенерации, соединительнотканный рубец – единственная возможность восстановить дефект органа. Это происходит, например, после инфаркта миокарда. Целостность сердечной мышцы восстанавливается, но сократительная функция становится неполноценной. Если рубец обширный, то он может растягиваться и формировать аневризму сердца, способную неожиданно разорваться и вызвать мгновенную смерть.
ТЕМА 8
Источник
иммунитете проявляется в их способности к фагоцитозу бактерий, погибших клеток тканей, антигенов и к синтезу ряда активных веществ — пищеварительных ферментов, компонентов системы комплемента, лизоцима, интерферона, эндогенного пиро-гена и др., являющихся основными факторами (медиаторами) естественного иммунитета. Роль макрофагов в приобретенном иммунитете заключается в переработке и передаче антигена Т-и В-лимфоцитам, в индукции специфического ответа на антигены; макрофаги обеспечивают иммунный гомеостаз, контролируя размножение опухолевых и мутировавших клеток. На мембране макрофага имеются рецепторы, которые связывают часть молекулы антигена или часть комплемента.
Совокупность клеток моноцитарного дифферона, способных к фагоцитозу, образует макрофагическую систему (И. И. Мечников). Она включает три звена:
1)клетки-предшественники (монобласты и промоноциты красного костного мозга);
2)транспортные формы (моноциты крови);
3)клетки эффекторы — макрофаги различной локализации: гистиоциты рыхлой волокнистой соединительной ткани, клетки Купфера печени, макрофаги легкого, кроветворных органов, остеокласты, глиальные макрофаги и др.
36. Межклеточное вещество соединительных
тканей. Составные компоненты, строение и функциональное значение. Типы коллагеновых волокон
Межклеточное вещество соединительной ткани представлено основным (аморфным) веществом и волокнами (коллагено-выми и эластическими).
Основное вещество соединительной ткани представляет собой гомогенную коллоидную систему, состоящую из сложных углеводов, связанных с белками. Оно заполняет все промежутки между клетками, волокнами и находящимися в соединительной ткани сосудами микроциркуляторного русла. Эта гелеобразная масса способна в широких пределах менять свою консистенцию, что существенно отражается на ее физических свойствах и функции. Важнейшими веществами этого комплекса являются гли-козаминогликаны: нейтральные (гликоген) и кислые (гиалуро-новая кислота, хондроитинсульфат, дерматансульфат, кератан-сульфат, гепарансульфат); протеогликаны, гликопротеиды (фибронектин, фибриллин, ламинин, энтактин, тенасцин) и белки (альбумины, глобулины, фибриноген, коллаген, эластин).
81
Источником образования основного вещества являются клетки; часть компонентов поступает из крови.
Молекулы гликозаминогликанов рыхлой соединительной ткани, переплетаясь, образуют сеть, в ячейках которой удерживается большое количество тканевой жидкости. Между пространствами, занятыми молекулами гликозаминогликанов, имеются каналы, но которым распространяется тканевая жидкость с растворенными в ней веществами. Поступающие в межклеточные пространства вещества подвергаются полимеризации. Полимеризованное или де-полимеризованное состояние основного вещества является фактором, влияющим не только на связывание воды и транспорт ионов, глюкозы, аминокислот, но и на миграцию
внем клеток.
Вмежклеточном веществе осуществляются различные ферментативные обменные процессы, происходит перемещение различных веществ и клеток, самосборка и перестройка коллагено-вых и эластических волокон и их ориентация в соответствии с действием механических факторов.
Коллагеновые волокна — основные элементы,
обеспечивающие механическую прочность соединительной ткани. Они имеют вид лентовидных тяжей, ориентированных в различных направлениях, не ветвящихся,
споперечной исчерченностью. Фибриллярный белок коллаген образован аминокислотами пролином, оксипролином, глицином.
Типы коллагена. Выделено не менее 13-ти типов коллагена, из которых наиболее распространены первые пять, остальные встречаются редко. Коллаген I типа — кожа, сухожилия, кости, роговица, дентин; II типа — хрящи, стекловидное тело; III типа — ретикулиновые волокна; IV типа — базальные мембраны; V типа — кровеносные сосуды.
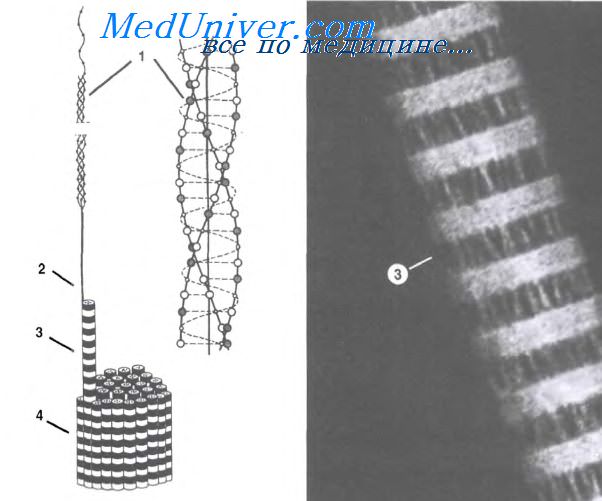
Образование коллагеновых волокон (рис. 16) проходит в два этапа: внутриклеточный (образование полипептидных цепей и триплетов проколлагена) и внеклеточный (отщепление от про-коллагена концевых участков, образование тропоколлагена и сборка фибрилл, во взаимодействии с гликозаминогликанами и фибронектином). Коллагеновые волокна обладают малой растяжимостью и большой прочностью на разрыв, но при определенных условиях легко набухают и деполимеризуются. Коллагеновые волокна выполняют опорную функцию, участвуют в миграции фибробластов и их дифференцировке, обеспечивают прочность тканей, участвуют в морфогенезе; коллаген участвует в адгезии тромбоцитов и образовании тромба.
Эластические волокна представляют собой гомогенные нити, формирующие сеть. Они могут объединяться в эластические
82

мембраны. По аминокислотному составу эластин отличается от коллагена содержанием, кроме глицина и пролина, уникальных аминокислот — десмозина и изодесмозина.
Внеклеточное формирование эластических волокон происходит в два этапа:
1)молекулы эластина, имеющие вид глобул без определенной ориентации соединяются в цепочки
иобразуют протофибриллы толщиной 3 нм и располагаются в виде пучка;
2)пропитывание этого пучка аморфным веществом приводит к образованию микрофибрилл, анастомозирующих друг с другом
иориентированных спирально.
Эластические волокна менее прочны, чем коллагеновые, они не набухают, отличаются упругостью (модуль упругости 4-6 кг/см2).
Ретикулярные волокна (аргирофильные)
отличаются сродством к солям серебра и образуют сетчатые структуры типа решетки.
83
Они входят в состав базальных мембран эпителиев, располагаются вокруг сосудов, капилляров, входят в состав сарколеммы, образуют строму кроветворных органов. По аминокислотному составу относятся к коллагену 3-го типа, обнаруживают поперечную ис-черченность. В них повышено содержание цистина и гексозамина и меньше, чем в тропоколлагене, пролина и оксипролина, они не перевариваются трипсином. Аргирофилией характеризуются также преколлагеновыс волокна.
37. Взаимодействие клеток крови и соединительной ткани в защитных реакциях
организма
Одной из важнейших функций тканей внутренней среды организма является обеспечение ими защитных реакций, которые могут быть рассмотрены на примерах типичных взаимодействий клеток крови и соединительной ткани при воспалении и иммунном ответе.
Воспаление — универсальная реакция организма, которая осуществляется в рыхлой неоформленной соединительной ткани с участием как собственных клеток — резидентов, так и клеток— иммигрантов (лейкоцитов крови). Воспаление характерная черта не только практически всех патологических процессов, но и способ функционирования соединительной ткани в норме. Примером последнего может служить пищеварительное воспаление, постоянно протекающее в соединительнотканной строме слизистых оболочек пищеварительного тракта. Последовательность процесса воспаления может быть описана в виде сменяющих друг друга фаз, в течение которых реализуются специфические функции клеток, участвующих в этом процессе (рис. 17):
•фаза альтерации — заключается в воздействии на организм или его определенную часть повреждающего агента (механического, термического, химического, физического, биологического), приводящего к повреждению или разрушению некоторого числа клеток и изменению химизма межклеточного вещества в «очаге поражения». Последнее обстоятельство приводит к активации тканевых базофилов, отвечающих на воздействие дегра-нуляцией с выбросом биологически активных веществ: гистами-на, гепарина, протеаз, кислых гидролаз, хемоаттрактантов и др.
•фаза экссудации — выделение гистамина, гепарина и
других вазоактивных веществ (простагландина РGD2 лейкотриена LТС4, медленно реагирующего фактора анафилаксии SRS-А). При дегрануляции тучных клеток приводит к стазу крови в кровеносных капиллярах «очага поражения», повышению проницаемости базальных мембран капилляров и выходу жидких компонентов
84
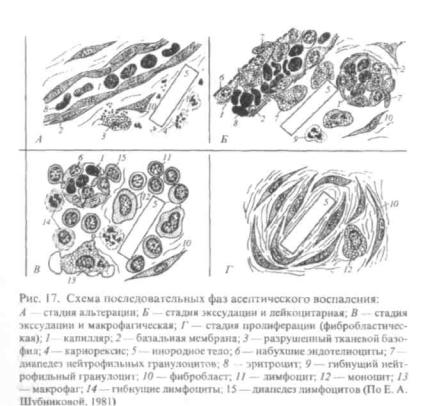
крови в «очаг поражения», что приводит к образованию отека. Гидратация межклеточного вещества соединительной ткани обеспечиваетусилениеподвижностисодержащихсявнейклеток.
• лейкоцитарная фаза — приобретающие подвижность вследствие остановки кровотока в микроциркуляторном русле и прикрепления к эндотелию лейкоциты и, прежде всего нейтрофильные гранулоциты, мигрируют в гидратированное межклеточное вещество соединительной ткани по направлению к источнику хемоаттрактанта, инфильтрируя очаг поражения и образуя вокруг него (на границе с неповрежденными участками) лейкоцитарный вал. Активированные нейтрофильные гранулоциты проявляют выраженную фагоцитарную активность, захватывая и разрушая поврежденные клетки, их обломки и микроорганизмы, образуя фагосомы и фаголизосомы.
85
• макрофагическая фаза осуществляется с помощью макрофагов — дифференцированной формы моноцитов, мигрирующих в очаг воспаления по градиенту концентрации факторов, вырабатываемых другими клетками, в том числе и нейтрофильными гранулоцитами, лимфоцитами, фрагментами фибронектина. Под влиянием находящихся в очаге экзогенных пирогенов (эндотоксины, белок микроорганизмов) макрофаги вырабатывают эндогенные пирогены (интеролейкин-1), запускающие метаболические изменения в центре терморегуляции и приводящие к повышению температуры. В результате специфического и неспецифического фагоцитоза макрофаги фагоцитируют мертвые клетки и тканевые обломки, секретируют ферменты (эластазу, коллагеназу. гиалу-ронидазу), которые разрушают компоненты межклеточного матрикса. Они же секретируют факторы роста эпителия и фибробластов, стимулирующие деятельность последних.
• фибробластическая фаза связана со стимуляцией фибробластов факторами роста (фактор роста фибробластов, макро-фагические факторы стимуляции роста кровеносных сосудов). Фибробласты активно пролиферируют и мигрируют к месту повреждения, связываясь с фибриллярными структурами с помощью фибронектина. Разрушая коллаген и синтезируя новый, фибробласты способствуют перестройке межклеточного вещества и образованию рубцов в месте повреждения.
В процессе иммунного ответа происходит взаимодействие клеток крови и соединительной ткани, в известной степени сходное с описанной схемой воспаления. К основным процессам добавляются процессы распознавания поступающих в организм или образующихся вновь антигенов Т- и В-лимфоцитами. Важнейшую роль в этом выполняют макрофаги, осуществляющие специфический фагоцитоз благодаря рецепторам к опсонинам (связям клеточной мембраны с антителом или комплексом антитела и комплемента). Перерабатывая появившийся в организме корпускулярный или растворимый антиген, замаскированный собственными белками организма, макрофаг презентирует очищенный антиген иммунокомпетен-тному лимфоциту и вступает с ними в кооперацию.
При клеточном иммунном ответе восприятие антигена Т-
.тимфоцитом приводит к его стимуляции и бласттрансформации в лим-фобласт, пролиферации и образованию клона Т-лимфоцитов с дифференцировкой этого клона на Т-клетки памяти и цитотоксические лимфоциты (Т-киллеры), а также Т-хелперы, Т-супрессоры. Т-лимфоциты с помощью лимфокинов повреждают мембраны антигенных клеток-мишеней и разрушают их, обеспечивая
86
генетический гомеостаз всех соматических клеток организма. При гуморальном иммунном ответе в результате кооперации В-лимфоцитов, макрофагов и Т-лимфоцитов происходит отделение комплекса антигена с иммуноглобулиновым рецептором от Т-лимфоцита, присоединение их к макрофагу, переработка и передача соответствующему по иммунокомпетенции В-лимфоциту. Последний претерпевает антигензависимую бласттрансформацию и пролиферацию, образуется клон В-лимфоцитов и происходит его дифференцировка на клетки памяти и эффекторы. В-лимфоциты эффекторы с участием Т- хелперов, вырабатывающих индукторы иммунопоэза, дифференцируются в плазмоциты, которые вырабатывают специфические антитела на данный вид антигена. Способность В-лимфоцитов участвовать в выработке антител может быть подавлена Т-супрессо-рами, с чем может быть связана нечувствительность к определенным антигенам (иммунологическая толерантность).
Медиаторы иммунных реакций: лимфопоэтины образуются в органах иммунной системы. Они необходимы для антигеннеза-висимого созревания иммунокомпетентных клеток. Лимфокины образуются самими эффекторными клетками и регулируют скорость протекания различных процессов в ходе осуществления реакций иммунитета. В активизации макрофагов принимают участие эозинофилы и тканевые базофилы.
Регуляторы иммунных реакций: генетические, нервные (в
развитии иммунного ответа имеет значение состояние нервной системы), гуморальные (гормоны, например, глюкокортикоиды, белки плазмы крови и др.), некоторые лекарственные препараты (иммуномодуляторы).
38. Плотная волокнистая соединительная
ткань. Классификация, морфофункциональная характеристика, возрастные изменения и регенерация
Плотная волокнистая соединительная ткань. Этот вид соединительных тканей отличается количественным преобладанием волокон над основным веществом и клетками. В зависимости от взаимного расположения волокон и образования ими пучков и сетей различают две основные разновидности этой ткани.
В плотной неоформленной волокнистой соединительной ткани волокна образуют сложную систему перекрещивающихся пучков и сетей, что отражает разносторонность механических воздействий на данный участок организма. Число клеток значительно меньше; основной клеточной формой является фибробласт.
87
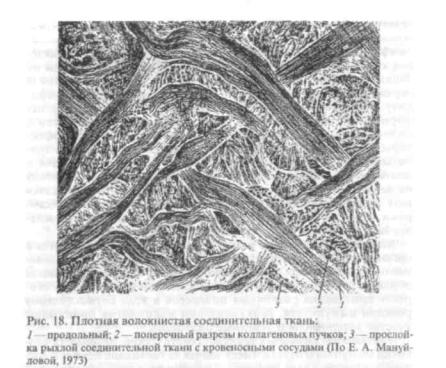
Такая ткань составляет основу кожи (дерма), обеспечивая ей высокую прочность, входит в состав надхрящницы и надкостницы (рис. 18).
Плотная оформленная волокнистая соединительная ткань характеризуется упорядоченно расположенными волокнами, что соответствует действию механического натяжения в определенном направлении. Плотная оформленная коллагеновая ткань в наиболее типичном виде представлена в сухожилиях, связках и фиброзных мембранах: капсулах внутренних органов, апоневрозах, фасциях, связках, сухожильных центрах диафрагмы, твердой мозговой оболочке, склере, состоящих из ориентированных коллагеновых волокон и сформированных из них пучков, разделенных прослойками рыхлой волокнистой соединительной ткани, гденаходятся кровеносные сосуды инервы.
Так, сухожилие образуется толстыми параллельными коллагеновыми волокнами, отделенными друг от друга фиброци-
88
тами — пучки первого порядка. Эти пучки объединяются в более крупные пучки второго порядка. Отграничивающая их рыхлая волокнистая соединительная ткань образует эндотеноний, выполняющий трофическую (содержит сосуды) и регенераторную (содержит камбиальные клетки) функции. Пучки второго порядка — перитенонием — объединяются в пучки третьего порядка; более крупные пучки 4-го и 5-го порядков образуют собственно сухожилия, которые ограничены эпитенонием.
Плотная оформленная эластическая соединительная ткань встречается в некоторых связках (истинные голосовые связки, выйная связка, желтые связки позвоночника). Она образована сетью параллельно расположенных толстых тяжей эластических волокон. В ряде случаев эластические волокна сливаются в эластические окончатые мембраны в крупных кровеносных сосудах.
Регенерация плотной соединительной ткани происходит плохо, поскольку камбиальных элементов, находящихся в прослойках рыхлой волокнистой соединительной ткани, очень мало.
39. Соединительные ткани со специальными свойствами. Классификация. Общая морфофункциональная характеристика. Возрастные изменения жировой ткани
Соединительные ткани со специальными свойствами. В
группу собственно соединительных тканей, помимо волокнистых, входят ткани со специальными свойствами, находящиеся в динамическом взаимодействии с рыхлой волокнистой соединительной тканью. К таким тканям относятся ретикулярная, пигментная, студенистая (эмбриональная, слизистая), жировая.
Эмбриональная соединительная ткань (слизистая,
студенистая) развивается из мезенхимы и обнаруживается в строме пупочного канатика, в дерме плодов. Клетки — слизистые (мукоциты) по структуре близки к фибробластам, имеют овальное ядро с диспергированным хроматином и ядрышками. Форма клеток неправильная, звездчатая; клетки имеют отростки. В межклеточном веществе преобладают компоненты основного вещества (гиалуроновая кислота) и минимально количество рассеянных, преимущественно ретикулиновых волокон. Ткань обладает упругостью и выполняет защитную функцию, предохраняя сосуды пупочного канатика от сдавливания.
Ретикулярная ткань образует строму кроветворных органов, окружает синусоиды печени, входит в состав базальных мембран. Имеет характерную сетевидную структуру и состоит из
89
звездчатых ретикулярных клеток (фибробластов) с длинными отростками, макрофагов и ретикулиновых волокон диаметром 0,5-2,0 мкм (коллаген III типа, связанный с гликоиротеинами и протеогликанами). В кроветворных органах создает микроокружение для развивающихся клеток крови. Вырабатывает ряд гемопоэтических факторов роста. Способна к постоянным перестройкам.
Пигментная ткань встречается у человека в сосудистой и радужной оболочках глаза, в соединительнотканных слоях резко пигментированных участков кожи, а также в родимых пятнах. Состоит из большого количества пигментных клеток
— меланоцитов.
Жировая ткань состоит из значительных скоплений жировых клеток (липоцитов) в рыхлой волокнистой соединительной ткани. Белая жировая ткань состоит из липоцитов, содержащих обычно одну крупную липидную каплю. Перстневидные жировые клетки, имеют уплощенное ядро, смещенное на периферию. Группы липоцитов образуют жировые дольки, которые окружены сетью ретикулиновых и эластических волокон с фибробластами и тканевыми базофилами. Встречается в подкожной жировой клетчатке, сальнике, строме внутренних органов. Выполняет ряд функций: терморегулирую-щую и термоизолирующую, защитно-механическую, трофическую (депо питательных веществ, воды, образующейся при распаде жира). Бурая жировая ткань характерна для новорожденных и детей раннего детского возраста, содержится у животных, впадающих в зимнюю спячку. У взрослых обнаруживается вокруг крупных сосудов в средостении. Состоит из липоцитов, содержащих множество мелких капелек жира; много митохондрий и включений желтых пигментов — цитохромов, связанных с железосодержащими пигментами митохондрий. Обильно снабжена кровеносными капиллярами, имеет симпатическую иннервацию. Функция — терморегуляция, связанная с выделением большого количества тепла.
Возрастные изменения. У новорожденных жировая ткань содержит много нейтральных жиров и эфиров холестерина. Присутствует бурая жировая ткань. У детей жир содержит меньше триолина и больше трипальмитина, поэтому имеет более высокую температуру плавления. В последующем снижается количество эфиров холесте

