Воспаление в патогенезе заболеваний

Традиционно считается, что в основе патогенеза угревой болезни лежит колонизация бактериями Propionibacterium acnes каналов сальных фолликулов. В результате этого развивается иммунный ответ, и происходит формирование папул, пустул и узелков. Тем не менее эта точка зрения подвергается все более пристальному анализу, поскольку появились доказательства наличия воспалительного компонента на всех этапах развития угревой болезни, в том числе, и до формирования комедонов. Читайте подробнее о роли воспаления в патогенезе акне на estet-portal.com в этой статье.
Основные повреждающие факторы в патогенезе угревой болезни
Патогенетические пути воспалительного повреждения при акне на данный момент до конца не изучены. Предполагается воздействие нескольких факторов, которые инициируют воспалительное поражение кожи. К ним относится инфицирование Propionibacterium acnes, воздействие воспалительных медиаторов, включающих цитокины и пептидазы, а также изменение секреции сальных желез.
Исследования показали, что воспалительные изменения кожи при акне развиваются до появления комедонов.
Было обнаружено, что в биоптате не затронутой патологическим процессом кожи пациентов с акне повышен уровень CD3 +, CD4 + и Т-клеток в дерме, а также увеличено число макрофагов. Данные изменения подобны тем, которые развиваются в папулах.
Угревая болезнь:
• роль Propionibacterium acnes в развитии воспаления при угревой болезни;
• влияние медиаторов воспаления на остроту течения угревой болезни;
• как на течение угревой болезни влияет активность сальных желез.
Роль Propionibacterium acnes в развитии воспаления при угревой болезни
Роль Propionibacterium acnes в этиологии угревой болезни признана уже более века. Исследования биопсии кожи у пациентов с акне показали, что Propionibacteria идентифицируется в 68% однодневных очагов акне, и в 79% трехдневных поражений. С клинической точки зрения роль P. acnes в развитии воспаления при угревой болезни была подтверждена рядом исследований. В них было показано, что противомикробные препараты, такие как тетрациклин и миноциклин, подавляют P. acnes у пациентов с умеренно тяжелой формой угревой болезни. Это приводило к существенному снижению числа воспалительных поражений.
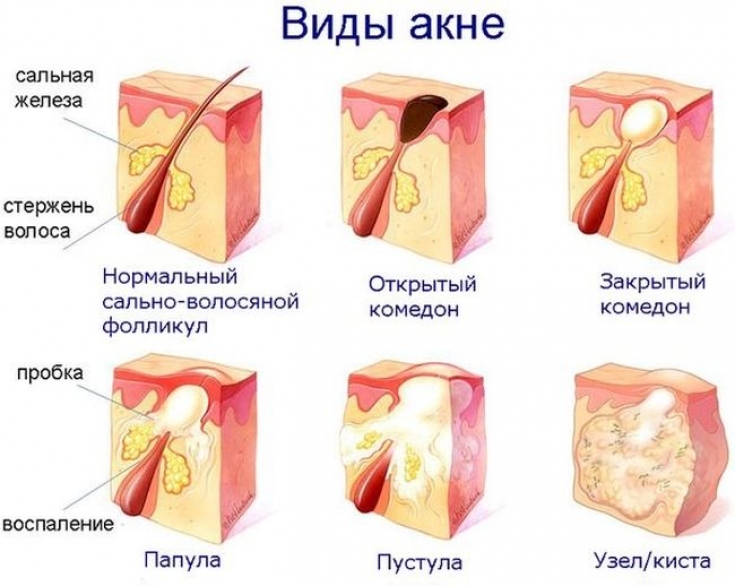
Влияние медиаторов воспаления на остроту течения угревой болезни
Было показано, что P. acnes вызывает высвобождение провоспалительных цитокинов и экспрессию антимикробных пептидов. Колонизация P. acnes вызывает активацию моноцитов с последующим синтезом IL-12, который является основным провоспалительным цитокином. Благодаря его активации, P. acnes также могут индуцировать экспрессию белка β-дефензина. Β-дефензины (defensin-1, defensin-2 и defensin-3) представляют собой семейство антимикробных пептидов, продуцируемых в коже как ответ на микробную инфекцию. Они обладают такими основными свойствами, как:
• модификация миграции и созревания клеток;
• индукция цитокинов;
• хемоаттракция иммунокомпетентных клеток.
Таким образом, P. acnes может выступать в роли триггера, индуцирующего воспаление. Вследствие воздействия этого микроорганизма — запускается целый каскад воспалительных процессов.
Как на течение угревой болезни влияет активность сальных желез
Несмотря на то, что изменения в себогенезе не оказывают непосредственного влияния на развитие угревой болезни, активность сальных желез может воздействовать на выраженность воспалительного процесса. Липиды сальных желез могут иметь провоспалительные эффекты, но некоторые липиды, такие как олеиновая или пальмитиновая кислота, обладают антибактериальной активностью.
Учитывая антимикробную активность липидов, можно сделать вывод, что сальные железы играют важную роль во врожденной иммунной защите кожи.
Таким образом, повышенная секреция кожного сала не вызывает угревой сыпи, однако нарушение липидного состава секрета сальных желез может инициировать активацию воспалительного каскада в начале развития угревой болезни.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 августа 2017;
проверки требуют 22 правки.
Воспале́ние (лат. inflammatio) — это комплексный, местный и общий патологический процесс, возникающий в ответ на повреждение (alteratio) или действие патогенного раздражителя и проявляющийся в реакциях, направленных на устранение продуктов, а если возможно, то и агентов повреждения (exudatio и др.) и приводящий к максимальному восстановлению в зоне повреждения (proliferatio).
Воспаление — защитно-приспособительный процесс.
Воспаление свойственно человеку и животным, в том числе низшим животным и одноклеточным организмам в упрощённом виде[1]. Механизм воспаления является общим для всех организмов, независимо от локализации, вида раздражителя и индивидуальных особенностей организма.
История[править | править код]
Уже в древние времена внешние признаки воспаления описал римский философ и врач Авл Корнелий Цельс (ок. 25 до н. э. — ок. 50 н. э.):
- лат. rubor — краснота (местное покраснение кожных покровов или слизистой).
- tumor — опухоль (отёк).
- calor — жар (повышение местной температуры).
- dolor — боль.
Дополнил Гален (129 — ок. 200 гг. н. э.), добавив - functio laesa — нарушение функции.
В конце XIX столетия И. И. Мечников считал, что воспаление — это приспособительная и выработанная в ходе эволюции реакция организма и одним из важнейших её проявлений служит фагоцитоз микрофагами и макрофагами патогенных агентов и обеспечение таким образом выздоровления организма. Но репаративная функция воспаления была для И. И. Мечникова сокрыта. Подчеркивая защитный характер воспаления, он в то же время полагал, что целительная сила природы, которую и представляет собой воспалительная реакция, не есть еще приспособление, достигшее совершенства. По мнению И. И. Мечникова, доказательством этого являются частые болезни, сопровождающиеся воспалением, и случаи смерти от них[2].
Большой вклад в изучение воспаления внесли Джон Хантер (1728—1794), Франсуа Бруссе (1772—1838), Фридрих Густав Якоб Генле (1809—1885), Симон Самуэль (1833—1899), Юлиус Фридрих Конхайм (1839—1884), Алексей Сергеевич Шкляревский, (1839—1906), Рудольф Вирхов (1821—1902), Пауль Эрлих (1854—1915), Илья Ильич Мечников (1845—1916).
Этиология[править | править код]
Патогенные раздражители (повреждающие факторы) по своей природе могут быть:
- Физическим — травма (механическое повреждение целостности ткани), отморожение, термический ожог.
- Химическими — щелочи, кислоты (соляная кислота желудка), эфирные масла, раздражающие и токсические вещества (алкоголь (спирты) и некоторые лекарственные препараты[3], см. Токсические гепатиты).
- Биологическими — возбудители инфекционных заболеваний: животные паразиты, бактерии, вирусы, продукты их жизнедеятельности (экзо- и эндотоксины). Многие возбудители вызывают специфические воспаления, характерные только для определённого вида инфекции (туберкулёз, лепра, сифилис). К биологическим повреждающим факторам также относят иммунные комплексы, состоящие из антигена, антитела и комплемента, вызывающие иммунное воспаление (аллергия, аутоимунный тиреодит, ревматоидный артрит, системный васкулит).
Клиника и патогенез[править | править код]
Клинические симптомы воспаления:
- Покраснение (гиперемия).
- Местное повышение температуры (гипертермия).
- Отёк (ацидоз способствует диссоциации солей и распаду белков, что приводит к повышению осмотического и онкотического давления в повреждённых тканях, приводящему к отёкам).
- Боль.
- Нарушение функции.
Процесс воспаления делят на три основных стадии:
- Альтерация — повреждение клеток и тканей.
- Экссудация — выход жидкости и клеток крови из сосудов в ткани и органы.
- Пролиферация (или продуктивная стадия) — размножение клеток и разрастание ткани, в результате чего и происходит восстановление целостности ткани (репарация).
Альтерация[править | править код]
Альтерация (позднелат. alteratio, изменение[4]) — стадия начала воспаления. Патогенный раздражитель, воздействуя на ткани организма, вызывает первичную альтерацию — повреждение и последующий некроз клеток. Из лизосом погибших клеток (в том числе гранулоцитов) высвобождаются многочисленные ферменты (влияющие на белки и пептиды, липиды, углеводы, нуклеиновые кислоты), которые изменяют структуру и нарушают нормальный обмен веществ окружающей очаг воспаления соединительной ткани и сосудов (вторичная альтерация).
В зоне первичной альтерации интенсивность метаболизма снижена, так как функции клеток нарушены, а в зоне вторичной альтерации повышена, в основном за счёт обмена углеводов (в том числе гликолиза полисахаридов). Повышается потребление кислорода и выделение углекислоты, однако потребление кислорода превышает выделение углекислоты, так как окисление не всегда проходит до окончательного образования углекислого газа (нарушение цикла Кребса). Это приводит к накоплению в зоне воспаления недоокисленных продуктов обмена, имеющих кислую реакцию: молочной, пировиноградной, L-кетоглутаровой и др. кислот. Нормальный уровень кислотности ткани с pH 7,32—7,45 может повышаться до уровня 6,5—5,39 (при остром гнойном воспалении), возникает ацидоз[5].
На месте повреждения расширяются сосуды, вследствие чего увеличивается кровоснабжение, происходит замедление кровотока и как следствие — покраснение, местное повышение температуры, затем увеличение проницаемости стенки капилляров ведёт к выходу лейкоцитов, макрофагов и жидкой части крови (плазмы) в место повреждения — отёк, который в свою очередь сдавливая нервные окончания вызывает боль и всё вместе — нарушение функции. Воспаление регулируют медиаторы воспаления — гистамин, серотонин, непосредственное участие принимают цитокины — брадикинин, калликреин (см. Кинин-калликреиновая система), IL-1 и TNF, система свёртывания крови — фибрин, фактор Хагемана, система комплемента, клетки крови — лейкоциты, лимфоциты (Т и В) и макрофаги. В повреждённой ткани усиливаются процессы образования свободных радикалов.
Механизмы возникновения воспаления[править | править код]
Митохондриально-зависимый механизм[править | править код]
Из-за повреждения клеток при травме, митохондриальные белки и мтДНК попадают в кровоток. Далее эти митохондриальные молекулярные фрагменты (DAMPs) распознаются Толл-подобными (TLRs) и NLR рецепторами. Основным NLR-рецептором участвующим в процессе является рецептор NLRP3. В нормальном состоянии белки NLRP3 и ASC (цитозольный адаптерный белок) связаны с ЭПР, при этом белок NLRP3 находится комплексе с белком TXNIP. Активация рецепторов приводит к их перемещению в перинуклеарное пространство, где под действием активных форм кислорода, вырабатываемых поврежденными митохондриями, белок NLRP3 высвобождается из комплекса.[6] Он вызывает олигомеризацию белка NLRP3 и связывание ASC и прокаспазы-1, образуя формирование белкового комплекса называемого NLRP3 инфламмасомой. Инфламмасома вызывает созревание провоспалительных цитокинов, таких как IL-18 и IL-1beta и активирует каспазу-1. (3) Провоспалительные цитокины также могут запускать NF-kB пути воспаления, повышая длительность и уровень воспаления. Также для активации NLRP3 инфламмасомы необходима пониженная внутриклеточная концентрация K+, что обеспечивание калиевыми каналами митохондрий.
Механизм возникновения воспаления через NF-κB сигнальный путь[править | править код]
Классификация[править | править код]
По продолжительности:
- Острое воспаление — длится несколько минут или часов.
- Подострое — несколько дней или недель.
- Хроническое — длится от нескольких месяцев до пожизненного с моментами ремиссии и обострения.
По выраженности реакции организма:
- Нормоэргическое воспаление — адекватная реакция организма, соответствующая характеру и силе воздействия патогенного раздражителя.
- Гиперэргическое — значительно повышенная реакция.
- Гипоэргическое (от гипоэргия[4]) и аноэргическое — слабая или отсутствующая реакция (у пожилых людей (старше 60-ти), при недостаточном питании и авитаминозе[7], у ослабленных и истощённых людей).
По локализации:
- Местное воспаление — распространяется на ограниченный участок ткани или какой-либо орган.
- Системное — распространяется на какую-либо систему организма (систему соединительной ткани (ревматизм), сосудистую систему (системный васкулит)[7]).
Формы воспаления[править | править код]
- Альтеративное воспаление (в настоящее время отвергается)
- Экссудативное воспаление
- Серозное
- Фибринозное
- Дифтеритическое
- Крупозное
- Гнойное
- Гнилостное
- Геморрагическое
- Катаральное — с обильным выделением слизи или мокроты.
- Смешанное
- Пролиферативное воспаление
- Гранулематозное воспаление
- Межуточное (интерстициальное) воспаление
- Воспаление с образованием полипов и остроконечных кондилом
- Воспаление вокруг животных-паразитов и инородных тел (холангит, урертрит, киста)
- Специфическое воспаление — развивается при таких заболеваниях как туберкулёз, сифилис, лепра, сап, склерома[8].
Диагностика[править | править код]
Клинический анализ крови: увеличивается скорость оседания эритроцитов (СОЭ), лейкоцитоз, изменяется лейкоцитарная формула.
Биохимический анализ крови: при остром воспалении повышается количество C-реактивного белка (белок острой фазы), α- и β-глобулинов, при хроническом воспалении — γ-глобулинов; снижается содержание альбуминов[9].
Терминология[править | править код]
Термины воспалений чаще всего являются латинскими существительными третьего склонения греческого происхождения, состоящие из корневого терминоэлемента, обозначающего название органа, и суффикса -ītis (-ит). Примеры: gaster (греч. желудок) + -ītis = gastrītis (гастрит — воспаление слизистой желудка); nephros (греч. почка) + -ītis = nephrītis (нефрит)[10].
Исключения составляют устоявшиеся старые названия воспалительных заболеваний: пневмония (греч. pneumon, лёгкое), ангина — воспаление миндалин, панариций — воспаление ногтевого ложа пальца и др[1].
См. также[править | править код]
- Гомеостаз
- Инфламмасома
Примечания[править | править код]
- ↑ 1 2 Пауков, Хитров, 1989, с. 98.
- ↑ А.И. Струков, В.В. Серов. Патологическая Анатомия. — 5-е издание. — 2010. — С. 169. — 848 с. — ISBN 978-5-904090-63-0.
- ↑ Серов, Пауков, 1995, с. 506.
- ↑ 1 2 Советский энциклопедический словарь / Гл. ред. А.М. Прохоров. — 4-е изд. — М.: Советская энциклопедия, 1988. — 1600 с.
- ↑ Тель, Лысенков, 2007.
- ↑ Mitochondria: Sovereign of inflammation?.
- ↑ 1 2 Барышников, 2002, с. 58.
- ↑ Пауков, Хитров, 1989, с. 106—112.
- ↑ Пауков, Хитров, 1989, с. 105.
- ↑ Городкова Ю.И. Латинский язык. — М.: Кнорус, 2015. — С. 124—125. — 256 с.
Литература[править | править код]
- Пальцев М. А., Аничков Н. М. Патологическая анатомия. Учебник для медицинских вузов (В 2 т.). — М.: Медицина, 2001 (1-е изд.), 2005 (2-е изд.), 2007 (3-е изд.).
- Пауков В.С., Хитров Н.К. Патология. — Учебник для мед. училищ. — М.: Медицина, 1989. — С. 98—112. — 352 с.
- Тель Л.З., Лысенков С.П., Шарипова Н.Г., Шастун С.А. Патофизиология и физиология в вопросах и ответах. — 2 том. — М.: Медицинское информационное агентство, 2007. — С. 66—75. — 512 с.
- Воспаление. Руководство для врачей / Под ред. В.В. Серова, В.С. Паукова. — М.: Медицина, 1995. — 640 с.
- Барышников С.Д. Лекции по анатомии и физиологии человека с основами патологии. — М.: ГОУ ВУНМЦ, 2002. — С. 57—64. — 416 с.
- Атаман А.В. Патологическая физиология в вопросах и ответах. — Учеб. пособие. — К.: Вища школа, 2000. — С. 133—147. — 608 с.
Видео[править | править код]
- «Воспаление» — Центрнаучфильм (Объединение учебных фильмов), 1980 г.
Ссылки[править | править код]
- Воспаление и иммунитет // ImmunInfo.ru
Источник
Любое
воспаление включает 3 основных компонента:
• альтерацию
— повреждение клеток и тканей;
• расстройство
микроциркуляции с экссудацией и
эмиграцией;
• пролиферацию
— размножение клеток и восстановление
целостности ткани.
Соответственно
различают: альтеративное
воспаление, экссудативное воспаление,
пролиферативное (продуктивное) воспаление
и
— как его отдельный вариант — гранулематозное
воспаление.
Патогенез
воспаления представляет собой сложное
сочетание нервных, гуморальных и
эффекторных механизмов, лежащих в основе
большого числа воспалительных феноменов,
составляющих вышеперечисленные явления
(рис. 10-3).
 Рис.
Рис.
10-3. Общая
схема патогенеза воспаления
10.4.1. Роль повреждения ткани в развитии воспаления
Альтерация
(alteratio,
от
лат. alterare
—
изменять), или
дистрофия, повреждение ткани, нарушение
в ней питания (трофики) и обмена веществ,
ее структуры и функции. Различают
первичную и вторичную альтерацию.
Первичная
альтерация является
результатом повреждающего воздействия
самого воспалительного агента, поэтому
ее выраженность при прочих равных
условиях (реактивность организма,
локализация) зависит от свойств флогогена.
Строго говоря, первичная альтерация не
является компонентом воспаления, так
как воспаление есть реакция на повреждение,
вызванное флогогеном, т.е. на первичную
альтерацию. В то же время практически
первичные и вторичные альтеративные
явления трудно отделимы друг от друга.
Вторичная
альтерация является
следствием воздействия на соединительную
ткань, микрососуды и кровь высвободившихся
внеклеточно лизосомальных ферментов
и активных метаболитов кислорода. Их
источником служат активированные
иммигрировавшие и циркулирующие
фагоциты, отчасти — резидентные клетки.
При воспалении у животных с предварительно
вызванной лейкопенией альтерация
выражена слабо. Определенную роль в
альтерации может играть также литический
комплекс С5b-С9, образующийся при активации
комплемента плазмы и тканевой жидкости.
Вторичная
альтерация не зависит от воспалительного
агента, для ее развития необязательно
дальнейшее присутствие флогогена в
очаге. Она является реакцией организма
на уже вызванное вредным началом
повреждение. Это целесообразный и
необходимый компонент воспаления как
защитно-приспособительной реакции,
направленный на скорейшее отграничение
(локализацию) флогогена и (или) поврежденной
под его воздействием ткани от остального
организма. Ценой повреждения достигаются
и другие важные защитные явления: более
выраженный микробицидный и литический
эффект лизосомальных ферментов и
активных метаболитов кислорода, поскольку
он осуществляется не только в фагоцитах,
но и внеклеточно; вовлечение других
медиаторов воспаления и клеток, усиленная
экссудация, эмиграция и фагоцитоз. В
результате воспалительный процесс
завершается быстрее. Однако альтерация
целесообразна лишь в известных пределах.
Так, например, при дисбалансе в системе
лизосомальные протеиназы —
их
ингибиторы возникают избыточные
проявления альтерации с преобладанием
некроза.
Альтеративные
явления при воспалении включают тканевой
распад и
усиленный
обмен веществ
(«пожар обмена»), приводящие к ряду
физико-химических изменений в воспаленной
ткани: накоплению кислых продуктов
(ацидоз,
или
Н+-гипериония),
увеличению
осмотического давления (осмотическая
гипертензия, или
гиперосмия),
повышению
коллоидно-осмотического, или онкотического,
давления (гиперонкия).
В
зависимости от силы повреждающего
агента, интенсивности и локализации
воспаления морфологические проявления
альтерации широко варьируют: от едва
заметных структурно-функциональных
изменений до полной деструкции (некробиоз)
и
гибели (некроз)
тканей
и клеток. Обнаруживаются мутное набухание
цитоплазмы клеток, явления белковой,
жировой и других видов их дистрофии.
Резко повышается проницаемость мембран
клеток и клеточных органелл. Изменяются
и субклеточные структуры — митохондрии,
лизосомы, рибосомы, эндоплазматическая
сеть. Митохондрии набухают или
сморщиваются, кристы их разрушаются.
Повышение проницаемости и повреждение
мембран лизосом сопровождаются выходом
разнообразных ферментов, играющих роль
в разрушении субклеточных структур.
Изменяются форма и величина цистерн
эндоплазматического ретикулума, в
цитоплазме появляются везикулы,
концентрические структуры и др. Отмечаются
краевое расположение хроматина,
повреждение мембраны ядра. В строме
наблюдаются мукоидное и фибриноидное
набухание вплоть до некроза, растворение
коллагеновых и эластических волокон.
Повышение
обмена веществ при воспалении происходит
преимущественно за счет углеводов.
Первоначально усиливается как их
окисление, так и гликолиз. В основе этого
явления лежит активация соответствующих
тканевых ферментов. Заметно увеличивается
потребление кислорода воспаленной
тканью. По мере накопления в очаге
лейкоцитов, лизосомальные ферменты
которых расщепляют углеводы анаэробным
путем, а также повреждения и снижения
количества митохондрий в ходе альтерации,
реакции окисления заметно ослабевают,
а гликолиза — нарастают. Соответственно
расщепление углеводов не всегда доходит
до конечных продуктов — углекислого
газа и воды. Дыхательный коэффициент
снижается. В ткани накапливаются
недоокисленные продукты углеводного
обмена — молочная и трикарбоновые
кислоты.
Кроме
того, вследствие нарушения обмена жиров,
белков и распада нуклеиновых кислот в
очаге нарастает содержание жирных
кислот, кетоновых тел, полипептидов,
аминокислот, нуклеотидов (АТФ, адениловая
кислота), нуклеозидов (аденозин). В
результате развивается ацидоз.
Первоначально он компенсируется
тканевыми буферными системами и
ускоренным крово- и лимфотоком. По мере
истощения буферных систем и замедления
крово- и лимфотока ацидоз нарастает и
становится некомпенсированным. Если в
норме концентрация водородных ионов в
ткани составляет 0,5?10-7,
т.е. рН равен 7,34, то при воспалении может
быть, соответственно, 25?10-7
и 5,6 и ниже. Чем острее протекает
воспалительный процесс, тем более
выражен ацидоз. Так, при остром гнойном
воспалении рН составляет 6,5-5,39, а при
хроническом — 7,1-6,6. Ацидоз принимает
участие в повышении проницаемости
сосудов. Он создает благоприятные
условия для реализации разрушительных
эффектов лизосомальных ферментов, в
частности гликозидаз, расщепляющих
углеводные компоненты матрикса
соединительной ткани.
Наряду
с Н+-гиперионией в очаге нарастает
содержание и других ионов — ионов калия,
натрия, кальция. Это обусловлено
разрушением клеток и усиленной
диссоциацией в кислой среде солей.
Вследствие опережающего повышения
уровня внеклеточного калия нарушается
соотношение ионов калия и кальция
(дизиония).
Изменения
в гомеостазе ионов Са2+
могут лежать в основе гибели клеток в
очаге воспаления. Са2+
является одним из вторичных мессенджеров
между мембраной и клеточными ферментными
системами, а также генным аппаратом.
Повышение уровня внутриклеточного Са2+
приводит к абсорбции его митохондриальными
мембранами и последующим блокированием
дыхательной цепи электронов. Повышенное
внутриклеточное содержание Са2+
активирует нелизосомальные протеазы,
приводя к лизису цитоскелета, деградации
энзимов, мембрано-ассоциированных
белков (ионных каналов, переносчиков,
рецепторов, молекул адгезии). Отмечено,
что хотя снижение внеклеточного Са2+
важно для выживания клеток, это может
быть препятствием к их новому росту. В
очаге воспаления нарастает молекулярная
концентрация, поскольку в процессе
тканевого распада и усиленного обмена
веществ происходит расщепление крупных
молекул до множества мелких. Вследствие
повышения ионной и молекулярной
концентрации развивается гиперосмия.
Так, если в норме депрессия межклеточной
жидкости
 Рис.
Рис.
10-4. Схематическое
изображение разреза через воспалительный
отек кожи: I — изменения осмотического
давления (А°С) в разных зонах очага
воспаления: 1 — центр воспаления, 2 — зона
полнокровия, 3 — зона явного отека, 4 —
зона латентного отека; II — изменения
концентрации ионов водорода: 1 — центр
гнойного воспаления, 2 — зона воспалительного
инфильтрата, 3 — зона периферического
отека, 4 — зона перехода к нормальному
состоянию (по Шаде)
составляет
0,62°, т.е. осмотическое давление равно 8
атм, то при гнойном воспалении —
соответственно 0,80° и 19 атм (рис. 10-4).
В
результате физико-химических изменений
воспаленной ткани, расщепления белков
до полипептидов и аминокислот с
увеличением концентрации последних
происходит увеличение дисперсности
коллоидов, их способности притягивать
и задерживать воду. Развивается
гиперонкия. Изменения осмотического и
онкотического давления являются важным
фактором экссудации и, соответственно,
воспалительного отека.
Соседние файлы в предмете Патологическая физиология
- #
- #
- #
- #
- #
- #
- #
- #
Источник

