Воспаление механизм воспаления тучные клетки
Не следует путать с адипоцитами — «клетками жировой ткани».
Тучные клетки (также известные как мастоциты или лаброциты) — это один из типов белых клеток крови, а именно, один из типов гранулоцитов, которые в зрелом состоянии встраиваются в соединительные ткани, являются частью и нейроиммунной иммунной системы. Происходят из миелоидных стволовых клеток. Содержат большое количество гранул, содержащих медиаторы и модуляторы воспаления, пролиферации и миграции клеток (гистамин, нейтральные протеазы — химаза и триптаза, кислые гидролазы, катепсин G, карбоксипептидаза, гепарин- и хондроитин-сульфат протеогликаны), а также медиаторы воспаления, которые синтезируются при активации клетки PAR , простагландин D2, лейкотриен С4, цитокины IL-4 , IL-5, IL-6, IL-8, IL-13, TNF-aльфа, MIP-laльфа (воспалительный белок la макрофагов), bFGF, гепарин. Несмотря на то, что лучше всего изучена их роль в аллергических реакциях, в частности, при анафилаксии, известно также, что мастоциты играют важную защитную роль, будучи тесно связанными с залечиванием ран, ангиогенезом, аутотолерантностью, противостоянием патогенам и с функциями гемато-энцефалического барьера.
Мастоциты по внешнему виду и функциям сильно схожи с базофилами, другим типом белых клеток крови. Несмотря на то, что мастоциты изначально считали тканевой разновидностью базофилов, было доказано, что эти клетки развиваются не из базофилов (хотя и из общих с ними гемоцитобластов [1]), поэтому не являются одним типом клеток.
Происхождение и классификация[править | править код]
Мастоциты были впервые описаны в 1878 г. Паулем Эрлихом в его докторской диссертации. Наличие гранул привело Эрлиха к неправильному мнению, что эти клетки существуют для питания окружающих тканей, поэтому он назвал их Mastzellen (от немецкого глагола Mast, означающего «откармливать»). Сейчас мастоциты рассматриваются как клетки иммунной системы.
Иллюстрация активации мастоцитов и анафилаксии
Мастоциты сильно схожи с базофильными гранулоцитами (класс белых клеток крови). Оба типа являются гранулоцитами, содержащими антикоагулянты гистамин и гепарин. Fc-фрагмент иммуноглобулина Е (IgE) связывается с мастоцитами и базофилами, когда активный центр иммуноглобулина E связывается с антигеном. Это приводит к высвобождению путем дегрануляции гистамина и других медиаторов воспаления. Эти сходства позволили многим ученым считать, что мастоциты относятся к базофильной ткани, кроме того, мастоциты и базофилы имеют общего предка в красном костном мозге, выделяющего белок CD34. Базофилы покидают костный мозг в зрелом состоянии, тогда как мастоциты циркулируют в незрелой форме, созревая лишь после выхода в ткани. Место, на котором обосновывается незрелая клетка, вероятно, зависит от характеристик отдельных клеток. Первая выращенная и дифференцированная in vitro чистая популяция мышиных мастоцитов была получена благодаря использованию кондиционированной среды, полученной с применением конквалин А-стимулированных спленоцитов. Позже было показано, что интерлейкин-3 являлся необходимым компонентом для дифференциации и роста мастоцитов. Мастоциты грызунов принято подразделять на 2 подтипа: мастоциты соединительной ткани и мастоциты слизистой. Активность последних зависит от Т-клеток. Мастоциты представлены во многих тканях, в том числе вокруг кровеносными сосудов и нервов, а особенно многочисленны они рядом с границей между внешней и внутренней средой — в коже, слизистой легких, тканях пищеварительного тракта, в тканях ротовой полости, в конъюнктиве и др.
Физиология[править | править код]
Мастоциты играют ключевую роль в воспалительных процессах. При активации мастоциты могут постепенно выделять (частичная дегрануляция) или мгновенно выделять (анафилактическая дегрануляция) «медиаторы воспаления», или соединения, приводящие к воспалению, хранящиеся в гранулах, в микросреду. Дегрануляцию могут вызывать:
- аллергены через кросс-связывание с рецепторами иммуноглобулинов Е (к примеру FcεRI)
- физическая травма, через рецепторы молекулярных фрагментов, ассоциированных с повреждениями (DAMP)
- бактериальные патогены через толл-подобные рецепторы (рецепторы ПАМП)
- различные соединения через их связанные с G-белком рецепторы (к примеру, морфий, через опиоидный рецептор) или через лиганд-зависимые ионные каналы.
- некоторые мембранные белки на поверхности мастоцитов, влияя на их функционирование.
Мастоциты экспрессируют высокоаффинный рецептор (FcεRI) для Fc-фрагмента IgЕ. Этот рецептор имеет столь большое сродство с IgЕ, что их связывание по сути необратимо. В результате мастоциты оказываются облепленными IgЕ, которые производятся плазматическими клетками (антителообразующие клетки иммунной системы). Молекулы IgE, как и все антитела, специализируются на одном конкретном антигене.
При аллергических реакциях мастоциты остаются неактивными до связывания аллергена с IgE, которые уже облепили клетку. Как правило, аллергенами являются белки или полисахариды. Антигены связываются с антигенсвязывающими участками, расположенными на вариабельных участках молекул IgE, связанных с поверхностью мастоцита. Оказывается, что связь двух и более молекул IgE (путем кросс-сопряжения, то есть образования поперечных межмолекулярных связей) обязательна для активации мастоцита. Кластеризация внутриклеточных доменов Fc рецепторов, соединенных с кросс-связанными молекулами IgE, вызывает сложную последовательность реакций внутри мастоцитов, которая приводит к их активации (и последующей дегрануляции). Несмотря на то, что данные реакции обычно рассматриваются как причина аллергии, они появились и развивались как защитная реакция против бактерий и паразитов.
За активацией мембранных рецепторов мастоцита следует высвобождение путем дегрануляции уникального, стимул-специфического набора медиаторов мастоцита. Примеры медиаторов, выделяющихся в внеклеточное пространство во время дегрануляции мастоцитов:
- преформированные (образованные предварительно) медиаторы (из гранул)
- сериновые протеазы, к примеру, триптаза и химаза
- гистамин
- серотонин
- протеогликаны, в основном гепарин (действует как антикоагулянт)
- некоторые хондроитинсульфаты
- аденозинтрифосфат (АТФ)
- лизосомальные ферменты
- β-гексозаминидаза
- β-глюкуронидаза
- арилсульфаты
- синтезируемые при стимуляции липидные медиаторы (эйкозаноиды)
- тромбоксан
- простагландин D2
- лейкотриен С4
- тромбоцит-активирующий фактор
- цитокины
- фактор некроза опухоли-α (TNF-α)
- основной фактор роста фибробластов
- интерлейкин-4
- фактор стволовых клеток
- хемокины, к примеру хемотаксический фактор эозинофилов
- реактивные формы кислорода
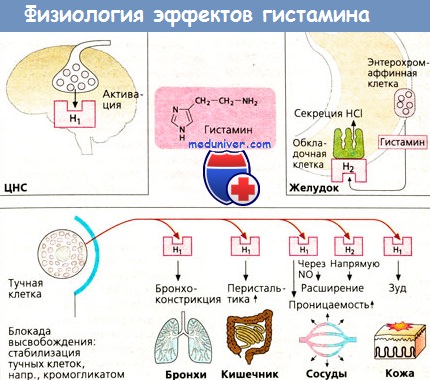
Гистамин расширяет посткапиллярные венулы, влияет на эндотелий, увеличивая проницаемость кровеносных сосудов. Это приводит к местному отеку, повышению температуры, покраснению и активации других близлежащих (местных) воспалительных клеток. Также приводит к деполяризации нервных окончаний, что приводит к появлению зуда или боли. Признаки выделения гистамина на коже проявляются в виде вздутостей и красных пятен, подобных тем, которые незамедлительно следуют за комариным укусом. Симптомы такой реакции появляются в считанные секунды после контакта аллергена с мастоцитом.
Некоторые данные указывают на то, что мастоциты играют важную роль в врожденном иммунитете. Они способны вырабатывать в огромных количествах важные цитокины и другие воспалительные медиаторы, такие как TNF-α; также они в больших количествах экспрессируют толл-подобные рецепторы (рецепторы ПАМП), которые вовлечены в распознавание широких классов патогенов; мыши, не имеющие мастоцитов, гораздо более восприимчивы к большинству инфекций, нежели мыши с мастоцитами. Гранулы мастоцитов содержат множество биологически активных веществ. Эти гранулы через псевдоподии мастоцитов могут передаваться в соседние клетки иммунной системы и нейроны.
Ссылки[править | править код]
- Тучные клетки: общие сведения. База знаний по боплогии человека. Дата обращения 12 июня 2019.
- Тучные клетки. Гипермаркет-здоровья.рф. Дата обращения 12 июня 2019.
Примечания[править | править код]
Источник
Тучные клетки и гистамин. Роль гистамина в воспалении бронхов.Тучные клетки бывают разных видов и от этого зависят морфологические изменения, сопровождающие их дегрануляцию: если в коже тучные клетки выделяют интактные гранулы, которые могут быть фагоцитированы фибробластами, то в легких гранулы тучных клеток растворяются внутриклеточно, и часть мембран гранул вместе с клеточной мембраной формируют каналы, через которые содержимое гранул выделяется наружу. Специфические морфологические, биохимические и функциональные черты тучных клеток диктуются специфическим микроокружением: так, тучные клетки кожи после стимуляции морфином in vitro выделяют медиаторы воспаления, а тучные клетки легких, сердца и желудочно-кишечного тракта — нет. Конечно, гетерогенность тучных клеток выходит далеко за рамки ответа на опиаты. Кроме антигензависимой дегрануляции тучных клеток, связанной с реакцией ГНТ, существует большое количество либераторов гистамина (токсины, ферменты, лекарства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунологическим путем. Гистамин считается своеобразным маркером тучной клетки, но последняя выделяет большое количество медиаторов, среди которых лейкотриены С4, Д4, Е4, простагландин Д гепарин, триптаза, причем не исключается, что гистамин и другие цитокины играют роль в генезе хронического воспаления при БА, выделяясь в небольшом количестве даже в фазе ремиссии. Имеются данные об активации тучноклеточной триптазой латентной коллагеназы, что, в итоге, приводит к повреждению соединительной ткани легких. Не исключено, что различные стимуляторы выделения БАВ, воздействуя на тучные клетки, могут избирательно потенцировать выделение или синтез de novo тех или иных медиаторов: так, местное воздействие на слизистую бронхов аденозинмонофосфата достоверно повышает выделение тучными клетками вторичного медиатора-простагландина Д2, но не первичных медиаторов (гистамина и триптазы).
Выделены разные группы больных атопической БА с одинаково повышенным уровнем гистамина и достоверно отличавшихся по уровню гистаминазы; причем эти группы больных отличались также по клинической картине болезни; больные с более высокой активностью гистаминазы были старше, имели более длительный анамнез заболевания и более тяжелое его течение. Участие гистамина в патологических процессах в легких, как органе-мишени, не всегда сопровождается повышением уровня гистамина в крови. Показано, что в ряде случаев уровень гистамина крови после провокации аллергеном был тем меньше, чем большей была гиперреактивность бронхов. Найдено повышение содержания гистамина в конденсате влаги выдыхаемого воздуха и в мокроте больных БА и хроническим бронхитом. В.А. Гончарова и соавт. считают, что из целого ряда БАВ, выявленных в конденсате влаги выдыхаемого воздуха (серотонин, гистамин, ацетилхолин, катехоламины), у больных БА наиболее информативно повышение уровня гистамина. У больных БА с хроническим бронхитом в ряде случаев продуцентами гистамина могут быть содержащиеся в бронхиальном дереве различные бактерии, а не тучные клетки. Вместе с тем, выделяющийся в легких свободный гистамин ответственен за начало ранней стадии воспаления. У больных БА гистамин не является, возможно, главным медиатором, но все же принимает участие в развитии отека слизистой и бронхоспазма. У некоторых больных гистамин реализует свое действие не только прямым влиянием на бронхи, но также путем усиления генерации фагоцитами активных форм кислорода. Активация тучных клеток может зависеть от тяжести течения БА. Rankin J. et al. не нашли повышения уровня гистамина в содержимом бронхоальвеолярного лаважа у больных легкой БА, в отличие от больных тяжелой БА. Гистамин повышает капиллярную проницаемость, повреждает капиллярную стенку и усиливает деполимеризацию основного вещества соединительной ткани. Получены данные о повышении гистамином посткапиллярного сопротивления на фоне относительно постоянного значения сопротивления артериальной части сосудистого русла, что приводит к росту капиллярного гидростатического давления и усилению процессов фильтрации в легочный интерстиций. Действуя на Н1-рецепторы бронхов гистамин вызывает бронхоконстрикцию, а действие гистамина на Н1-рецепторы сосудов малого круга вызывает их сужение. Повышение давления в системе легочной артерии под влиянием гистамина связано с увеличением проницаемости гладкомышечных клеток для внеклеточного кальция и мобилизации внутриклеточного кальция. Возможно, легочная гипертензия, возникающая при гипоксической гипоксии, опосредуется тучными клетками, выделяющими гистамин. Гистамин модулирует активность многих клеток, принимающих участие в иммунном воспалении, и оказывает влияние на клеточные иммунные реакции. Через Н1-рецепторы реализуется провоспалительный эффект гистамина, а все ингибирующие эффекты гистамина на функцию лимфоцитов и противовоспалительное действие реализуются через Н2-рецепторы, и не исключается, что одновременная стимуляция Н1 и Н2-рецепторов на иммунокомпетентных клетках приводит к развитию супрессорной активности, а дефект Н2-рецепторов при аллергических заболеваниях может иметь генерализованный характер и приводить к повышению функциональной активности Н1-рецепторов, усилению воспалительных реакций и увеличению выхода гистамина из тучных клеток. Высказывается предположение, что в ряде случаев для больных БА повышенный уровень гистамина может иметь положительное значение: благодаря существованию двух функционально противоположных типов гистаминовых рецепторов гистамин через отрицательную обратную связь играет роль ограничителя аллергического воспаления, а патологические изменения, вызванные гистамином, возникают лишь при нарушении гомеостатического механизма регуляции через систему Н1 и Н2-рецепторов, т.е. при сдвиге механизмов контроля. Считается, что у больных аллергическими болезнями, в том числе при БА, гистамининдуцированная супрессия иммунного ответа нарушается из-за уменьшения Н2-позитивных Т-лимфоцитов, вырабатывающих HSF (гистамин-индуцированный фактор супрессии). Несмотря на многообразие действия гистамина и его роль «маркера» тучных клеток, не всегда просто выяснить его значение в патогенезе легочных заболеваний, поскольку в организме гистамин высвобождается при любой травме и находится также вне тучных клеток, являясь постоянной составной частью почти всех органов, тканей, жидких сред и выделений. Помимо тучных клеток, существенную роль в выделении гистамина могут играть базофилы, различающиеся по своей плотности и наличию в них гистамина: несмотря на небольшое содержание в крови, базофилы могут становиться многочисленными в зоне воспаления и играть важную роль в поздней фазе аллергических реакций, а также получены данные о повышенном выходе гистамина из базофилов под действием ФАТ. Существенная роль в генезе различных видов воспаления взаимодействия «тучная клетка — эозинофил» дополняется не менее важной осью «тучная клетка — нейтрофил»: медиаторы тучных клеток влияют на выделение нейтрофилами свободных радикалов кислорода, а активированные нейтрофилы стимулируют выделение гистамина из тучных клеток. Сейчас считается, что тучные клетки играют центральную роль в возникновении бронхообструкции в течение ранней астматической реакции, выделяя гистамин, простагландин Д2, цистеиновые ЛТ, ферменты (триптаза, протеаза), не только вызывающие спазм гладкой мускулатуры бронхов, но также влияющие на сосудистую проницаемость, усиливающие деятельность железистого аппарата бронхов, и разрыхляющие соединительнотканный матрикс. Привлечение различными тучноклеточными медиаторами, такими как ИЛ-3, ИЛ-4, ИЛ-5, нейтрофильный хемотаксический фактор, ФАТ, гранулоцитарно-макрофагальный колониестимулирующий фактор других клеток воспаления, приводит к развитию персистирующей воспалительной реакции в бронхах больных БА, что типично для хронического течения этой болезни, а активация протеазами тучных клеток разных коллагеназ приводит к нарушениям соединительной ткани и способствует не только хронизации воспаления, но и формированию необратимых морфологических изменений. — Также рекомендуем «Эйкозаноиды. Воспаление бронхов и выделение эйкозаноидов.» Оглавление темы «Воспаление бронхов.»: |
Источник
Тучные клетки (мастоциты) и идентичные им базофилы периферической крови и костного мозга в ответ на ряд стимулов выделяют значительное количество медиаторов воспаления. Эти медиаторы имеют несомненное физиологическое значение, способствуя ограничению или устранению вредных факторов, воздействующих на организм.
Однако роль медиаторов тучных клеток в патологии человека представляется более яркой (возможно, потому, что их защитные функции недостаточно выяснены). При анализе данной системы при ревматических заболеваниях следует учитывать, что тучные клетки представлены в синовиальных тканях суставов в сравнительно большем количестве, составляя 3% от числа всех нормальных синовиальных клеток.
Наиболее известный медиатор воспаления тучных клеток гистамин, способный приводить к быстрому повышению капиллярной проницаемости. Как и большинство других медиаторов этих клеток, он содержится в базофильных гранулах в неактивной форме, но после адекватной стимуляции и дегрануляции клеток выделяется во внеклеточное пространство как активное вещество.
Эффекты гистамина, как указывалось выше, способствуют развитию первой (экссудативной) фазы воспаления. Весьма интересным оказалось открытие двух типов рецепторов гистамина в тканях, а тем самым и своеобразной двойственности действия этого вещества. Выяснилось, что воспалительная реакция является результатом воздействия гистамина на рецепторы первого типа (H1-рецепторы) .
В то же время его влияние на рецепторы второго типа (Н2-рецепторы) приводит к накоплению в клетках циклического аденозинмонофосфата (цАМФ) и тем самым к некоторому противовоспалительному эффекту с ограничением дальнейшего освобождения гистамина и других медиаторов; одновременно тормозится также иммунная активность Т-лимфоцитов. В суммарном действии гистамина, наблюдаемом в клинических условиях, преобладает его влияние на H1-рецепторы с развитием элементов воспаления типа крапивницы или отека Квинке. .
Стимулированные тучные клетки выделяют также несколько веществ, вызывающих хемотаксис как нейтрофилов, так и эозинофилов, что способствует привлечению этих клеток в очаг воспаления. Эти факторы хемотаксиса весьма разнообразны химически: среди них имеются белки, липиды, а один из эозинофильных хемотаксических факторов (так называемый фактор А) представляет собой простой полипептид, состоящий всего из 4 аминокислот.
К другим воспалительным медиаторам, содержащимся в тучных клетках, относятся простагландины, протеолитический фермент химаза и фактор, активирующий тромбоциты. Существенное значение придается фактору, называемому медленно действующим веществом анафилаксии — SRSA (от англ. slow reacting substance of anaphylacsys). Это вещество обладает патофизиологическими свойствами гистамина, но в отличие от последнего действует более длительно и не тормозится антигистаминными препаратами.
Важной особенностью SRSA является его возникновение только после иммунной стимуляции тучных клеток; в нестимулированных клетках это вещество не обнаруживается, что также отличает его от гистамина. За последние годы было установлено, что SRSA относится к лейкотриенам — мощным противовоспалительным агентам, синтезируемым из арахидоновой кислоты под влиянием фермента липоксигеназы. Действие SRSA (лейкотриена С) угнетается ферментом арилсульфатазой, содержащейся в эозинофилах. В последних имеется также фермент гистаминаза, инактивирующая гистамин.
Данные факты, по-видимому, отчасти объясняют местную и общую эозинофилию, наблюдаемую при активировании системы тучных клеток и трактуемую, таким образом, как компенсаторный феномен. Освобождение гистамина и других медиаторов воспаления из тучных клеток с соответствующими сосудистыми реакциями в определенной степени происходит даже при небольшой местной травматизации у здоровых людей. Однако основным механизмом, который приводит к активации (и соответственно дегрануляции) тучных клеток, является иммунный, связанный с образованием циркулирующих антител, относящихся к классу IgE.
Эти антитела фиксируются на поверхности тучных клеток, которые имеют к ним специальные рецепторы. При последующем поступлении в организм соответствующего антигена последний реагирует с IgE, изменяя микроконфигурацию поверхности тучных клеток, что служит стимулом к их дегрануляции и поступлению медиаторов воспаления во внеклеточное пространство. Этот процесс лежит в основе первого (анафилактического) типа иммунных повреждений тканей (см. ниже).
Очень важно иметь в виду, что дегрануляция тучных клеток в ряде случаев происходит под влиянием неиммунных стимулов. К ним относятся фрагменты 3 и 5 компонентов комплемента (С3а и С5а), брадикинин, лекарственные препараты (в частности, рентгеноконтрастные, опиаты, кураре), некоторые полипептиды из лейкоцитов крови, инфильтрирующих очаги воспаления. Поэтому по крайней мере у некоторых больных клинические признаки, неотличимые от классических проявлений аллергии анафилактического типа (крапивница, астмоидный синдром), могут быть не связаны с образованием IgE.
До последнего времени полагали, что воспаление, связанное с активацией системы тучных клеток, является весьма кратковременным, поскольку его главным медиатором считается гистамин, которому действительно свойственны относительно быстро преходящие эффекты. Однако после открытия SRSA и содержащихся в тучных клетках хемотаксических факторов стала ясной возможность хронизации воспаления, связанного с активированием мастоцитов. Это подтверждается клиническими наблюдениями.
В частности, при таком типичном заболевании, связанном с IgE, как аллергический ринит, хорошо известно хроническое течение с выраженным пролиферативным компонентом, проявляющимся в полипозе слизистой оболочки носа. Поэтому нельзя исключить, что персистирующая дегрануляция тучных клеток может играть определенную роль и в поддержании хронического течения артритов (учитывая обилие мастоцитов в синовиальных тканях).
Для регуляции гомеостаза важно содержание в мастоцитах не только целого набора медиаторов воспаления, но и гликозаминогликана гепарина, обладающего слабым противовоспалительным и иммунодепрессивным свойством. Эти его свойства используются и в клинической практике.
Опубликовал Константин Моканов
Источник

