Воспаление и иммунитет книги
Как наш организм защищается от инфекции. Иммунитет – естественная защита от инфекций, виды иммунитета. Иммунная система
Еще в древнем Египте и Греции за больными чумой ухаживали люди, прежде переболевшие этой болезнью: опыт показывал, что они уже не подвержены заражению.
Люди интуитивно пытались обезопасить себя от инфекционных болезней. Несколько веков назад в Турции, на Ближнем Востоке, в Китае для профилактики оспы втирали в кожу и слизистые оболочки носа гной из подсохших оспенных гнойников. Люди надеялись, что, переболев каким-то инфекционным заболеванием в легкой форме, они приобретут устойчивость к действию возбудителей в последующем.
Так зарождалась иммунология – наука, изучающая реакции организма на нарушение постоянства его внутренней среды.
Нормальное состояние внутренней среды организма является залогом правильного функционирования клеток, не общающихся напрямую с внешним миром. А такие клетки образуют большинство наших внутренних органов. Внутреннюю среду составляют межклеточная (тканевая) жидкость, кровь и лимфа, а их состав и свойства во многом контролирует иммунная система.
Трудно найти человека, который не слышал бы слово “иммунитет”. Что же это такое?
Иммунитет (от латинского immunitas – освобождение, избавление) – защита организма от внешних и внутренних биологически активных агентов (антигенов), направленная на сохранение постоянства внутренней среды (гомеостаза) организма. | ||
Другими словами, это невосприимчивость организма к инфекционным агентам и веществам, обладающим антигенными свойствами.
Антигены – общее название чужеродных для организма агентов и веществ. Ими могут быть продукты жизнедеятельности микроорганизмов – возбудителей различных заболеваний, ядовитые соединения растительного и животного происхождения, погибшие или переродившиеся клетки самого организма и другие вещества.
В жизни нас окружает бесчисленное множество невидимых простым глазом микроорганизмов, многие из которых очень опасны для организма. Поражает их воспроизводство. Одна бактерия в течение 1 ч порождает 8 себе подобных особей, через 2 ч их образуется уже 64, через 24 ч – 4772 триллиона. При размножении в течение 1 года получилась бы масса бактерий, равная массе Солнца. Но в природе все находится в равновесии и беспрепятственного увеличения числа микробов не происходит. Научился сопротивляться этим агрессорам и наш организм.
В нашем организме есть особые механизмы, препятствующие проникновению в него микробов и развитию инфекций. Так, слизистые оболочки выполняют роль барьера, через который проходят далеко не все микробы, а выделяемые кожным эпителием и слизистыми оболочками вещества понижают активность микробов или полностью их инактивируют. Одним из главных механизмов сопротивления является иммунная система.
Строение и состав иммунной системы. Иммунная система человека (рисунок 1.5.13) включает центральные органы – костный мозг и вилочковую железу (тимус) – и периферические – селезенку, лимфатические узлы, лимфоидную ткань. Эти органы вырабатывают несколько типов клеток, которые и осуществляют надзор за постоянством клеточного и антигенного состава внутренней среды.
Рисунок 1.5.13. Основные органы иммунной системы человека
Основные клетки иммунной системы – фагоциты и лимфоциты (В- и Т-лимфоциты). Они циркулируют по кровеносной и лимфатической системе, некоторые из них могут проникать в ткани. Все клетки иммунной системы имеют определенные функции и работают в сложном взаимодействии, которое обеспечивается выработкой специальных биологически активных веществ – цитокинов. Вы, наверное, слышали такие названия, как интерфероны, интерлейкины и тому подобные. Это так называемые цитокины, с помощью которых клетки иммунной системы могут обмениваться информацией и осуществлять координацию своих действий.
Фагоциты (в переводе на русский язык – “пожирающие”) бросаются на пришельцев, поглощая и разрушая микробы, ядовитые вещества и другие чужеродные для организма клетки и ткани. При этом погибают и сами фагоциты, высвобождая вещества (медиаторы), вызывающие местную воспалительную реакцию и привлекающие новые группы фагоцитов на борьбу с антигенами.
Впервые фагоциты – “подвижные клетки” открыл в 1882 году И.И. Мечников, когда проводил опыт, вводя в тело личинок морских звезд шип от розы. Он увидел, как занозу быстро окружают клетки и пытаются ее уничтожить.
Этот процесс был назван И.И. Мечниковым фагоцитозом, а клетки, осуществляющие эту функцию, – фагоцитами. Установлено, что один фагоцит может захватить 15-20 бактерий. Если он поглощает больше микробов, чем может их переварить, то клетка гибнет. Смесь погибших и живых фагоцитов и бактерий называется гноем.
Известно, что при многих заболеваниях повышается температура, возникает воспалительный процесс.
Воспаление – это защитная реакция организма против инфекций. | ||
Лимфоциты вырабатывают специфические белки (антитела) – иммуноглобулины, взаимодействующие с определенными антигенами и связывающие их. Антитела нейтрализуют активность ядов, микробов, делают их более доступными для фагоцитов.
Защитные реакции организма обеспечиваются клетками-фагоцитами, а также белками-антителами. | ||
Иммунная система “запоминает” те чужеродные вещества, с которыми она хоть раз встречалась и на которые реагировала. От этого зависит формирование невосприимчивости к “чужим” агентам, терпимости к собственным биологически активным веществам и повышенной чувствительности к аллергенам. Нормально функционирующая иммунная система не реагирует на внутренние факторы и, в то же время, отторгает чужеродные воздействия на организм. Она формирует иммунитет – противоинфекционный, трансплантационный, противоопухолевый. Иммунитет защищает организм от инфекционных болезней, освобождает его от погибших, переродившихся и ставших чужеродными клеток. Иммунные реакции являются причиной отторжения пересаженных органов и тканей. При врожденных или приобретенных дефектах иммунной системы возникают заболевания – иммунодефицитные, аутоиммунные или аллергические, вызванные повышенной чувствительностью организма к аллергенам.
Виды иммунитета. Различают естественный и искусственный иммунитет (смотри рисунок 1.5.14).
Рисунок 1.5.14. Виды иммунитета
Человек уже с рождения невосприимчив ко многим болезням. Такой иммунитет называют врожденным. Например, люди не болеют чумой животных, потому что у них в крови уже содержатся готовые антитела. Врожденный иммунитет передается по наследству от родителей. Организм получает антитела от матери через плаценту или с материнским молоком. Поэтому часто у детей, находящихся на искусственном вскармливании, ослаблен иммунитет. Они больше подвержены инфекционным заболеваниям и чаще страдают от диабета. Врожденный иммунитет сохраняется всю жизнь, но он может быть преодолен, если дозы заражающего агента увеличатся или ослабеют защитные функции организма.
В некоторых случаях иммунитет возникает после перенесенных заболеваний. Это приобретенный иммунитет. Переболев один раз, люди приобретают невосприимчивость к возбудителю. Такой иммунитет может сохраняться десятки лет. Например, после кори остается пожизненный иммунитет. Но при других инфекциях, например при гриппе, ангине, иммунитет сохраняется относительно недолго, и человек может перенести эти заболевания несколько раз в течение жизни. Врожденный и приобретенный иммунитет называют естественным.
Инфекционный иммунитет всегда конкретен или, другими словами, специфичен. Он направлен только против определенного возбудителя и не распространяется на прочих.
Существует также искусственный иммунитет, который возникает в результате введения в организм готовых антител. Это происходит, когда заболевшему человеку вводят сыворотку крови переболевших людей или животных, а также при введении ослабленных микробов – вакцины. В этом случае организм активно участвует в выработке собственных антител, и такой иммунитет остается на длительное время. Об этом подробнее будет сказано в главе 3.10.
Источник
Воспаление — это эволюционно выработанная защитная сосудисто-стромальная реакция организма, направленная на удаление из организма чужеродных антигенов и индифферентных в антигенном отношении чужеродных частиц путем их фагоцитоза. Выраженность воспаления зависит от состояния иммунитета.
Классификация.
Выделяют две формы воспаления:
- экссудативное,
- продуктивное (пролиферативное).
Принципиальным моментом, отличающим одно от другого, является то, что при экссудативном воспалении фагоцитоз чужеродных в антигенном отношении частиц осуществляется нейтрофилами, а при продуктивном — макрофагами.
Нецелесообразно в виде самостоятельной формы выделять так называемое альтеративное воспаление, поскольку изменения, на которые указывают в качестве примера, относятся к некротическим изменениям без выраженной воспалительной реакции.
В зависимости от характера агента, вызвавшего воспаление, различают воспаление:
- инфекционное,
- неинфекционное (асептическое).
Воспаление может быть:
- острым,
- хроническим.
Из форм экссудативного воспаления хроническое течение может иметь гнойное воспаление. Продуктивное воспаление в большинстве случаев характеризуется первично-хроническим течением.
Встречаемость.
Воспаление чрезвычайно широко распространено. Врачи встречаются с ним своей работе повседневно. Это особенно касается экссудативного воспаления, продуктивное же встречается реже.
Условия возникновения.
- Проникновение в организм извне чужеродных частиц или образование чужеродных антигенов в самом организме.
- Полноценный иммунитет, не нарушенный из-за врожденных аномалий или под воздействием болезненных факторов.
Агентами, способными вызывать воспаление, являются бактерии, вирусы, риккетсии, простейшие, патогенные грибы, животные-паразиты (глисты, чесоточный клещ и т.п.), растительные частицы. Асептическое воспаление может развиваться под действием химических и физических факторов, в результате которых происходит повреждение тканей, приобретающих при этом новые антигенные свойства. Нецелесообразно выделять в качестве отдельной формы аллергическое воспаление, а следует говорить об аллергической реакции, поскольку таковая не является защитной и не направлена на фагоцитоз.
Механизмы возникновения.
Первая фаза воспаления — фаза альтерации. При этом происходит:
- Проникновение чужеродных частиц (эндогенное их появление) в ткани.
- Фагоцитоз и распознавание их тканевыми макрофагами-гистиоцитами.
- Выработка гистиоцитами биологически активных веществ (интерлейкин-1 и др.), обеспечивающих мобилизацию защитных сил организма на борьбу с агентом и условия для осуществления этой борьбы.
Вторая фаза — фаза экссудации.
- Выделяемый макрофагами интерлейкин-1 воздействует на лаброциты (тучные клетки), в которых происходит дегрануляция.
- Выделение ими гистамина, а также выделение макрофагами других биологически активных веществ ведет к расширению артериол (а, следовательно, и капилляров), в которых замедляется ток крови.
- Замедление тока крови в капиллярах обеспечивает выход в пристеночный пул более тяжелых по своей массе лейкоцитов.
- Под действием биологически активных веществ усиливаются адгезивные свойства как лейкоцитов, так и эндотелиоцитов — происходит прилипание лейкоцитов к эндотелию.
- Под действием интерлейкина-1, фактора некроза опухолей, гистамина и некоторых других веществ повышается проницаемость капилляров — расширяются фенестры эндотелиоцитов и межэндотелиальные щели.
- Происходит выход воды и компонентов плазмы за пределы сосудов — возникает отек ткани, необходимый для ее разрыхления и обеспечения в дальнейшем перемещения в ней лейкоцитов к месту внедрения агента. Этому же способствует выделение тканевыми лаброцитами гепарина, переводящего межуточное вещество соединительной ткани в иное физколлоидное состояние.
- Лейкоциты, формируя ложноножки, проникают в межэндотелиальные щели и наталкиваются на базальную мембрану. Чтобы преодолеть ее они выделяют коллаген азу.
- Лейкоциты выходят за пределы капилляров и под действием хематтрактантов, роль которых играют фактор активации тромбоцитов и некоторые другие вещества, перемещаются в очаг проникновения болезнетворного агента.
- Лейкоциты распознают чужеродный агент за счет фиксировавшихся на его поверхности антител или комплемента и фагоцитируют его. Исходом такого фагоцитоза может быть полное разрушение агента (завершенный фагоцитоз) или распад самого лейкоцита (незавершенный фагоцитоз).
Третья фаза воспаления — фаза пролиферации.
В процессе фагоцитоза активированные фагоциты выделяют ряд веществ — факторов пролиферации, способствующих размножению различных клеток и регенерации поврежденной ткани. Происходит либо полная регенерация, либо размножение эндотелиоцитов, адвентициальных клеток и фибробластов. По мере созревания фибробласты превращаются в фиброциты и синтезируют межклеточное вещество, в котором происходит созревание волокон и в итоге формируется соединительнотканный рубец.
Макроскопическая картина.
Классическими клиническими признаками воспаления являются:
- покраснение (rubor),
- припухлость (tumor),
- боль (dolor), жар (calor),
- нарушение функции (functio laesa).
Первые два признака выявляются при осмотре ткани. Перечисленные признаки отчетливо выражены при экссудативном воспалении и гораздо в меньшей степени — при продуктивном (пролиферативном).
Микроскопическая картина.
Картина воспаления, обнаруживаемая при гистологическом исследовании, существенно отличается в зависимости от экссудативного или продуктивного характера воспаления, однако общим критерием наличия воспаления является обнаружение в ткани скопления клеток, способных осуществлять фагоцитоз.
Клиническое значение.
Как следует из определения, воспаление играет защитную роль, способствует элиминации болезнетворного агента или ставших чужеродными разрушенных тканей и восстановлению целостности пораженного органа. Однако при значительной его выраженности существуют два неблагоприятных момента:
- выраженный инфекционно-воспалительный эндотоксикоз под действием поступающих в кровоток в больших количествах биологически активных веществ,
- возможность разрушения гнойным экссудатом сосудов, органов и т.д.
Последствия перенесенного воспаления могут также быть негативными (например, спайки между петлями кишечника как исход перитонита). Выраженное хроническое воспаление в органе своим исходом всегда имеет нарушение его функции. Хроническое гнойное воспаление чревато опасностью развития в организме вторичного амилоидоза.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Базисная антиколонизационная активность секретов усиливается за счет антител, продуцируемых лимфоидной тканью слизистых оболочек. Они относятся к иммуноглобулинам класса A, которые транспортируются на поверхность слизистых оболочек при помощи секреторного компонента — особого белка, синтезируемого эпителиальными клетками (рис. 1). Некоторые бактерии (например, менингококки и гонококки) продуцируют специфические IgA-протеазы. Разрушая IgA-антитела, они лишают их главной функции — способности подавлять адгезию инфекционных агентов на эпителиальных клетках.
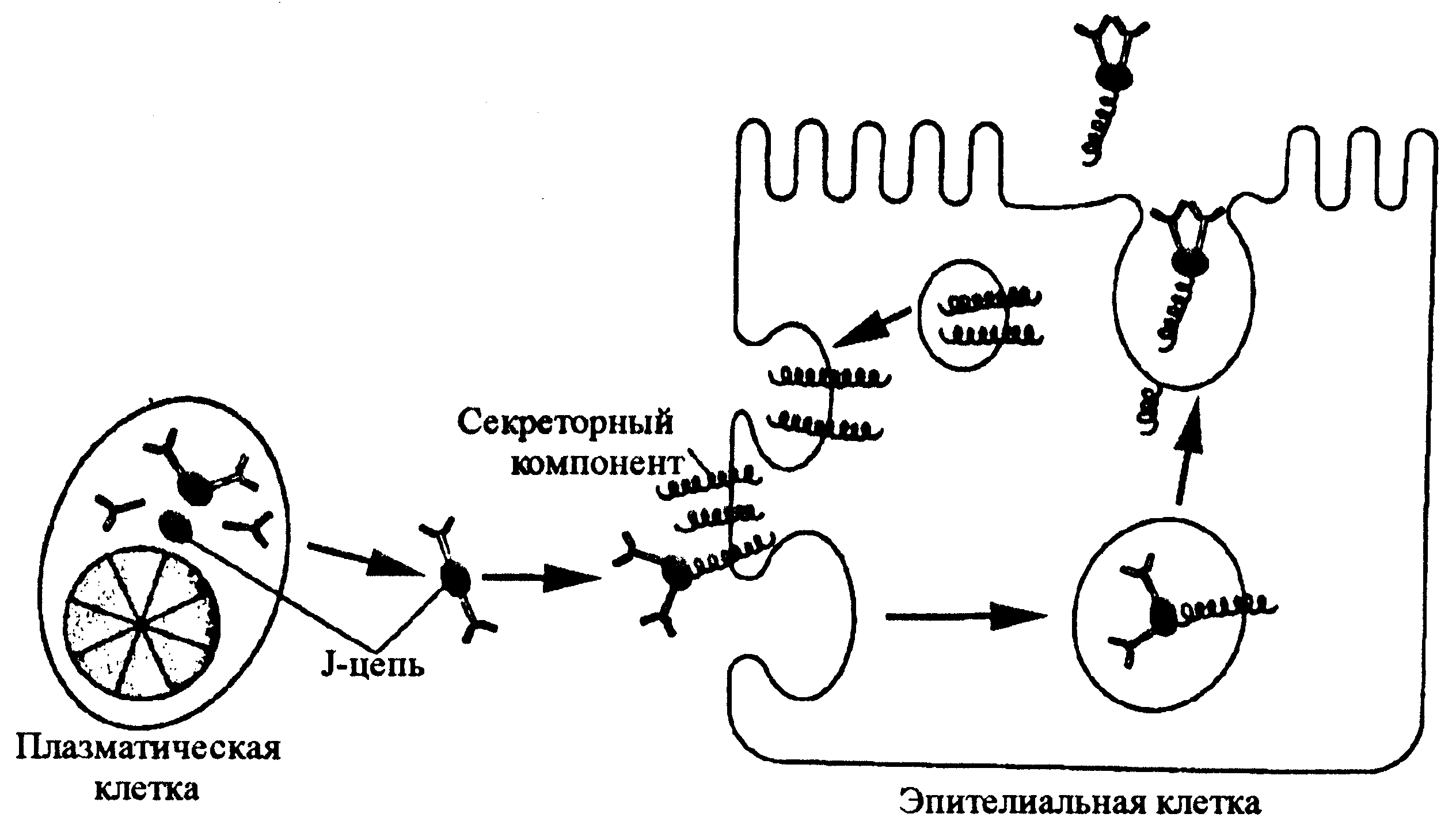 Рис. 1. Транспорт IgА через эпителиальную клетку. Синтез секреторного компонента (показан в виде спиралей) не зависит от IgA-транспорта, т.е. выделение его на поверхность слизистых оболочек происходит в свободной или связанной с IgA форме. J-цепь — белок, образующий димеры IgA
Рис. 1. Транспорт IgА через эпителиальную клетку. Синтез секреторного компонента (показан в виде спиралей) не зависит от IgA-транспорта, т.е. выделение его на поверхность слизистых оболочек происходит в свободной или связанной с IgA форме. J-цепь — белок, образующий димеры IgA
Лимфоидная ткань, ассоциированная со слизистыми оболочками, работает в собственном режиме и в известном смысле автономна от системного иммунитета. Ее лимфоциты, стимулированные антигенами и настроенные (по выражению иммунологов, коммитированные) на синтез IgA-антител, даже после выхода в циркуляцию обычно возвращаются «домой», в субэпителиальную ткань слизистых оболочек, предпочитая решать местные задачи. Это так называемый хоминг-эффект (англ. homing — стремление к дому, очагу), который объясняется сродством лимфоцитов к рецепторам (адрессинам) эндотелия посткапиллярных венул, дренирующих мукозальный тракт (рис. 2). На избирательности хоминг-эффекта основана энтеральная вакцинация, нацеленная на создание иммунитета в масштабе общей системы слизистых оболочек путем перорального введения микробных антигенов.
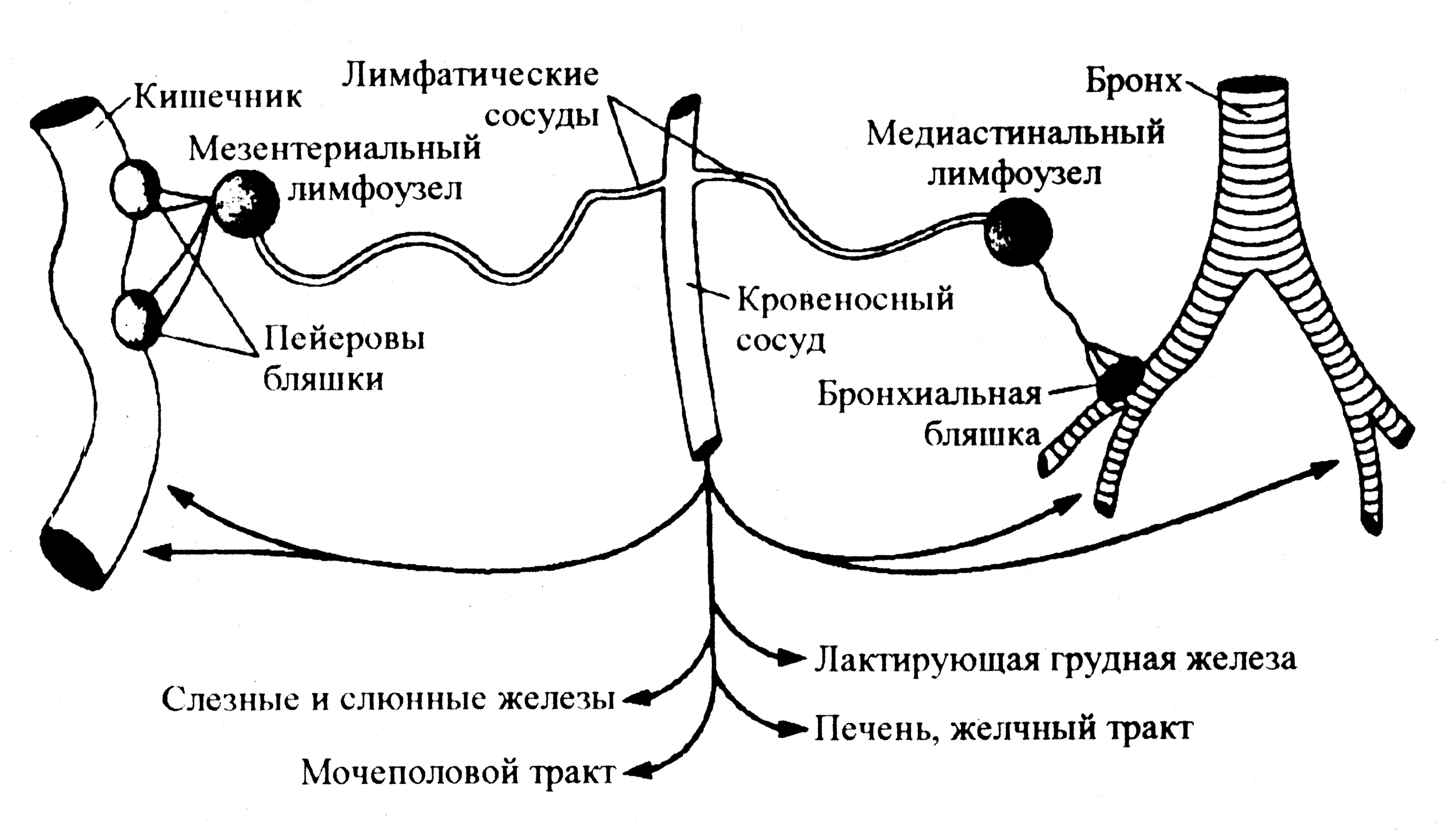 Рис. 2. Миграция лимфоцитов в системе иммунитета слизистых оболочек. После антигенной стимуляции в субэпителиальных скоплениях лимфоидной ткани лимфоциты, пройдя через регионарные лимфатические узлы, попадают в лимфатические сосуды, далее в кровь, откуда избирательно мигрируют в различные отделы слизистых оболочек, создавая потенциальные очаги антимикробной защиты. Схема демонстрирует относительную автономию иммунной системы мукозального тракта
Рис. 2. Миграция лимфоцитов в системе иммунитета слизистых оболочек. После антигенной стимуляции в субэпителиальных скоплениях лимфоидной ткани лимфоциты, пройдя через регионарные лимфатические узлы, попадают в лимфатические сосуды, далее в кровь, откуда избирательно мигрируют в различные отделы слизистых оболочек, создавая потенциальные очаги антимикробной защиты. Схема демонстрирует относительную автономию иммунной системы мукозального тракта
Следует отметить еще один важный момент. Гомеостаз мукозального тракта во многом зависит от непрерывной регенерации эпителиоцитов, которая обеспечивается пролиферацией и дифференцировкой стволовых клеток, встроенных в слизистую оболочку. В кишечнике эту функцию выполняют клетки крипт, откуда дифференцированные энтероциты мигрируют в ворсинки и, отработав, сбрасываются в полость кишечника.
В криптах непосредственно под стволовыми клетками располагается особый тип клеток (клетки Панета), которые секретируют антибактериальные факторы — лизоцим и катионные пептиды (криптидины), похожие на дифенсины фагоцитов. Они защищают стволовые клетки от микробной контаминации, поддерживая обновление энтероцитов и сохранение целостности эпителиального покрова. О тяжелых последствиях нарушения регенерации слизистой оболочки свидетельствует картина поражения кишечника при лучевой болезни и цитостатической терапии. Из-за гибели быстро делящихся стволовых клеток и вторичного повреждения эпителиального барьера (клинически это проявляется кровоизлияниями в полость кишечника) заметно возрастает опасность септических инфекций, исходящих из кишечного тракта.
Иммунитет и воспаление
Поверхность кожи и слизистых оболочек — первый рубеж, где оказывается сопротивление инфекционным агентам. Защита здесь носит бесконфликтный характер и в основном определяется факторами, которые имеются до заражения и не требуют дополнительных реакций для своего образования или активации (исключение — антигениндуцированный синтез секреторных антител и продукция эпителиальными клетками цитокинов и катионных пептидов).
Картина меняется после проникновения (инвазии) микробов в субэпителиальную ткань. Это всегда вызывает реакцию, так как инвазии сопутствует повреждение. Стандартным ответом является воспаление, которое либо обрывает конфликт без серьезных последствий, либо разрастается до крупных осложнений. Диалектика воспаления сурова — пожертвовать частью ради целого, т.е. организма. Не дифференцируя ткани по жизненной важности, воспалительный процесс развивается везде, где нарушен гомеостаз и налицо виновник повреждения. Так, в частности, возникают абсцессы легкого, печени, мозга и т.д. Воспаление травмирует ткани, сокращает полезный объем органа и служит источником токсических начал, отравляющих организм.
Мысль об иммунитетной функции воспаления утвердилась как одно из следствий фагоцитарной теории И.И. Мечникова. Логика проста: если фагоциты защищают от микробной инвазии, то и реакция, которая обеспечивает их мобилизацию в зону поражения, выполняет ту же функцию. Безусловно, учение о воспалении шире, чем учение об антимикробной защите, но именно здесь гомеостатический смысл этого механизма проявляется особенно ярко.
Реакцию начинают «клетки тревоги» (тучные клетки и макрофаги рыхлой соединительной ткани), которые первыми реагируют на повреждение, извещая об опасности и необходимости продолжения реакции. Они секретируют множество медиаторов, которые вместе с производными плазмы повышают проницаемость сосудов, вызывая эмиграцию лейкоцитов из сосудистого русла. Это означает, что воспалительная реакция развивается благодаря последовательному подключению гуморальных факторов и клеток — резидентных (постоянно присутствующих в соединительной ткани) и мобилизуемых из крови. Данный принцип базируется на сложном (сетевом) переплетении эффекторных и регуляторных молекул, которые обслуживают воспалительный процесс, обрывая или способствуя его развитию.
Известны различные варианты воспаления. Вместе с тем, опираясь на природу его главных эффекторов (фагоцитов), можно говорить о двух основных разновидностях — нейтрофил- и макрофагзависимом воспалении. Первое носит гнойный характер и вызывается гноеродными (пиогенными) бактериями. Нейтрофилы (их изобилие придает воспалительному экссудату гнойный характер) охотно принимают помощь гуморальных факторов — комплемента и антител, которые в очаге воспаления действуют как опсонины, усиливая фагоцитарные реакции. Нейтрофилзависимое воспаление отличается острым экссудативно-деструктивным течением, но иногда обретает вялотекущий, хронический характер, являясь основой хронической пиогенной патологии. Макрофаги служат эффекторами гранулематозного воспаления, которое исходно протекает хронически с преобладанием пролиферативно-склерозирующего компонента и усиливается Тh1-цитокинами. Такие реакции наблюдаются при заражении туберкулезной палочкой, листериями, возбудителями проказы, бруцеллеза, токсоплазмоза, лейшманиоза и др. Их объединяет способность к длительному выживанию (персистенции) внутри макрофагов (см. ниже).
Защита от внутрисосудистой инвазии
Чтобы попасть в кровь, инфекционный агент должен преодолеть барьер из лимфатических узлов, располагающихся по ходу лимфатических сосудов. Здесь много макрофагов, которые, занимая стратегически выгодную позицию в сосудистых синусах, извлекают из лимфы чужеродных агентов. Впрочем, и сама тканевая жидкость не безобидна для микробов: в лимфе содержатся комплемент, антитела и другие элементы плазменного транссудата, которые обладают прямой антимикробной активностью или усиливают реакции макрофагов, выступая в роли опсонинов.
Резидентные факторы лимфы и лимфатических узлов не всегда способны уничтожить возбудителя. В таких случаях здесь, как и в субэпителиальной ткани, возникает воспаление (лимфаденит), причем основной удар принимают близлежащие (регионарные) узлы. Воспалительный процесс (об этом говорит увеличение и болезненность лимфоузлов) задерживает распространение инфекции не только за счет уничтожения микробов, но и благодаря снижению скорости лимфотока, который при сильном разбухании и повреждении лимфоузла может вообще прекратиться. Но и это не всегда останавливает инфекцию. Возбудитель проникает в эфферентную лимфу и далее в кровоток. Иногда инвазия в лимфу и кровь происходит бессимптомно. К примеру, некоторые вирусы и другие внутриклеточные паразиты проникают в кровяное русло, инфицируя (но не повреждая) моноциты или лимфоциты, которые разносят их по организму еще в инкубационном, т.е. доклиническом периоде.
Уцелеть в кровеносном русле рядовым микробам тоже непросто. Прежде всего сама кровь — не очень подходящая среда для размножения бактерий. Лишь после прогревания или разведения она становится пригодной для этих целей. Кровь — продукт многих тканей, и поэтому в ней содержится множество биологически активных начал, включая антимикробные (биоцидные, биостатические, опсонические) факторы. В виде резидентных (лимфа) или мобилизуемых при воспалении факторов их действие продолжается в тканях, где оседают микробы.
Источник

