Системные изменения при воспалении

Синдром системного воспалительного ответа[1] (англ. «systemic inflammatory response syndrome» (SIRS)) — медицинский термин, введённый в 1992 году на конференции Американской коллегии торакальных хирургов (англ. American College of Chest Physicians) и Общества специалистов интенсивной терапии (англ. Society of Critical Care Medicine) в Чикаго[2] для обозначения общей воспалительной реакции организма в ответ на тяжелое поражение, вне зависимости от локализации очага. Процесс идет при участии медиаторов воспаления с вовлечением практически всех систем организма.
Воспалительная реакция организма в ответ на внедрение в организм инфекции, обширные травмы, развития некроза тканей, тяжелые ожоги развивается по одним и тем же общим закономерностям. Эта реакция является приспособительной функцией организма и направлена на уничтожение агента, вызвавшего процесс, и восстановление поврежденной ткани. При легких поражениях воспалительный процесс ограничивается локальными воспалительными изменениями и умеренной, малозаметной общей реакцией органов и систем.
Диагностика[править | править код]
Диагноз синдрома системной воспалительной реакции организма правомочен в случае наличия как минимум двух следующих критериев:
- Температура тела ≥ 38 °C (фебрильная температура) или ≤ 36 °C (гипотермия)
- Частота сердечных сокращений ≥ 90/мин (тахикардия)
- Тахипноэ: частота дыхания ≥ 20/мин или гипервентиляция с содержанием диоксида углерода в крови ≤ 32 mmHg
- Лейкоцитоз (≥ 12000/μl) или лейкопения (≤ 4000/μl) или смещение лейкоцитарной формулы влево.
Комбинация «фебрильная температура+лейкоцитоз» является самой частой для синдрома системной реакции организма на воспаление и соответствует нормальной реакции иммунной системы. В случае «гипотермия+лейкоцитоз», который встречается гораздо реже, говорят о «холодном» синдроме системной реакции организма на воспаление —— подобная реакция организма встречается при иммунодефиците.
Причины[править | править код]
Причинами синдрома системного воспалительного ответа могут быть: сепсис, гипоксия, шок, ожоги, острый панкреатит, обширные хирургические операции, тяжелые травмы и другие тяжелые заболевания. Чаще всего факторы повреждения классифицируют исходя из механизма патологического воздействия:[1]
- Механическое повреждение тканей (примеры: ожоги, синдром длительного сдавления).
- Глобальный недостаток перфузии тканей (примеры: шок, остановка кровообращения).
- Регионарный недостаток перфузии тканей (примеры: тромбоэмболия, травма крупных сосудов).
- Некроз тканей вследствие ишемии (примеры: инфаркт миокарда, острый панкреатит).
- Инфекционный процесс (примеры: иммунодефицит, хирургическая инфекция, инфицированная травма, внутрибольничная инфекция).
- Выброс эндотоксинов (пример: сепсис, вызванный грам-негативными бактериями).
- Невскрытые абсцессы (например, интраабдоминальные).
Примечания[править | править код]
Литература[править | править код]
- М. И. Кузин, О. С. Шкроб, Н. М. Кузин. Синдром системного ответа на воспаление // Хирургические болезни. — 3 издание. — М.: Медицина, 2002. — С. 13-22. — 784 с. — ISBN 5-225-00920-4.
- Определение SIRS (нем.) (недоступная ссылка). Дата обращения 11 февраля 2014. Архивировано 26 июня 2013 года.
- S-2 Рекомендации по профилактике, диагностике, лечению и реабилитации SIRS (нем.) (недоступная ссылка). Deutsche Sepsis Gesellschaft. Дата обращения 11 февраля 2014. Архивировано 1 октября 2010 года.
- R. C. Bone; R. A. Balk; F. B. Cerra; R. P. Dellinger; A. M. Fein; W. A. Knaus; R. M. Schein; W. J. Sibbald. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine (англ.) // Chest. — 1992. — Vol. 101, no. 6. — doi:10.1378/chest.101.6.1644.
Источник
Ответ
острой фазы — это комплекс последовательных
реакций, инициируемых физическими,
химическими, биологическими повреждающими
воздействиями или опухолевым процессом.
Принято
считать, что через 3-15
часов
после первичной альтерации на фоне
нейтрофилии повышается количество и
активность моноцитов, а затем и лимфоцитов
(возникает первичный иммунный ответ),
что и является началом ООФ, достигающего
максимума через 1-2
суток,
затем медленно ослабевающего и
заканчивающегося (в зависимости от
характера и выраженности как первичной,
так и вторичной альтерации) через 1-3
недели.
Субъективными
проявлениями ответа острой фазы являются:
сонливость, потеря аппетита (анорексия),
безразличие к окружающему (апатия), боли
в мышцах (миалгии), боли в суставах
(артралгии).
Объективные
проявления ответа острой фазы:
1.Изменения
со стороны крови:
1.1.нейтрофильный
лейкоцитоз с регенеративным сдвигом
влево
1.2.
увеличение СОЭ за счет снижения
поверхностного заряда эритроцитов,
который снижается из-за оседания
глобулинов и фибриногена на поверхности
эритроцитов, а также Н+
нейтрализуют отрицательный заряд
эритроцитов, происходит их агрегация,
снижение СОЭ.
1.3.Диспротеинемия:
гипоальбуминемия, гипергаммаглобулинемия,
появление в крови белков ответа острой
фазы (БОФ),
1.4.
снижение содержания железа (гипосидеремия),
цинка и увеличение концентрации меди
в сыворотке крови
1.5.
активация системы комплемента, активация
системы свертывания крови
2.лихорадка,
3.Развитие
общего адаптационного синдрома
4.активация
клеток иммунной системы
С биологических позиций ООФ следует
рассматривать как естественную
эволюционно сформированную реакцию
организма, цель которой заключается в
предотвращении тканевого повреждения,
изоляции и разрушении повреждающего
агента, а также в активации репаративных
процессов, необходимых для восстановления
нормальных жизненных функций. В ответ
на первичную альтерацию в развитии
воспалительного процесса наиболее
быстро (уже в течение 1-2 ч) активизируются
и эмигрируют из крови в очаг воспаления
нейтрофилы. Они осуществляют выраженное
местное защитное действие, проявляющееся
в пиноцитозе веществ, фагоцитозе
микроорганизмов, продуктов распада
тканей, токсинов, а также в высвобождении
и активации гидролаз, свободных радикалов
кислорода, перекисей, катионных белков
и других антимикробных и антитоксических
веществ. Через 3-15 ч после первичной
альтерации в очаге воспаления на фоне
нейтрофилии сначала повышается количество
и активность моноцитов, а затем и
лимфоцитов (раньше Т-, позже В-лимфоцитов),
т.е. возникает так называемый первичный
иммунный ответ. Фактически это и есть
начало ответа ООФ, достигающего максимума
через 1-2 сут, затем медленно ослабевающего
и заканчивающегося (в зависимости от
характера и выраженности как первичной,
так и вторичной альтерации) через 1-3
нед. Через выделение различных цитокинов
сначала нейтрофилы, а позже эндотелиоциты,
моноциты, гистиоциты, лимфоциты и
фибробласты начинают участвовать не
только в местных, но и в системных
реакциях, в том числе в активизации
различных звеньев и всей системы
иммунитета, а также гипофиза, надпочечников
и других различных как регуляторных,
так и исполнительных систем.
При
воспалении в крови изменяется содержание
белков ответа острой фазы (БОФ). Выделяют
две группы БОФ:
1) негативная
группа — концентрация БОФ снижается
(альбумин,трансферрин);
2) позитивная
группа — концентрация БОФ нарастает в
2-10 раз (альфа-1-антитрипсин, альфа-1-
антихимотрипсин, фибриноген, гаптаглобин);
менее чем в 2 раза (церулоплазмин, Сз
компонент комплемента, инактиватор
С1компонента
комплемента) и более, чем в 1000 раз (С —
реактивный белок (СРБ),сывороточный
амилоидный протеин А(САП-А)).
Белки
ООФ при остром экссудативно-деструктивном
воспалении (Д.Н.
Маянский, 2008)
Тип | Функции |
С1, | Опсонизация, |
Калликреин | Повышение |
Плазминоген | Активация |
С-реактивный | Регуляция |
Церулоплазмин | Нейтрализация |
а1-кислый | Регуляция |
а1- | Тормозит |
а | Тормозит |
а | Тормозит |
Гаптоглобин | |
Сывороточный |
СРБ
— наиболее популярен из всех БОФ, однако
интерпретация титров этого белка сложна,
так как его количество может не отражать
интенсивности воспалительного процесса.
В норме концентрация его составляет от
0,1 до 8,0 мг/л. Уровень СРБ достигает
максимума на 2-3-й день воспалительного
процесса и постепенно возвращается к
исходному значению на 12-15-е сутки.
При
затяжном и хроническом воспалении
содержание СРБ сохраняется на высоком
уровне.
К
наиболее чувствительным БОФ относятся
САП-А. Затем, по убыванию располагаются
СРБ, а-1-химотрипсин, церулоплазмин,
а-1-кислый гликопротеид. Определение
гаптаглобина или фибриногена
малоинформативно. При тяжелых формах
воспаления, особенно гепатитах, синтез
БОФ снижается. В этом случае их титр не
будет соответствовать активности
воспалительного процесса.
В
учебниках и руководствах по патологии
подробно рассматривается структурные,
метаболические и функциональные
изменения в очаге воспаления и мало
уделяется внимания на причины и патогенез
системных изменений.
Патогенез
системной реакции организма при
воспалении (по
Ю.С. Свердлову, 2000)
Повреждение
тканей (инфекция,
травма, распад опухоли, некроз, комплекс
антиген-антитело и др.)

 Воспаление
Воспаление
(освобождение
ИЛ —
1, ИЛ
—
6, ИЛ
—
8, ФНО
-а, ИНФ-у)
Системные
реакции
Нервная
Эндокринная Печень
Костный
Активация
система система мозг лимфоцитов
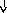
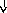
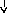
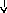
(активация
Гипоталамус
Гипофиз БОФ Лейкоцитоз,
иммунитета)
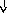

ретикулоцитоз
Лихорадка
АКТГ
В
настоящее время принято считать, что
реализацию системных изменений в
организме при воспалении осуществляют:
интерлейкин-1, интерлейкин-6, интерлейкин-8,
фактор некроза опухолей, интерфероны,
фактор ингибирования лейкемии, онкостатин
М, цилиарный нейтрофический фактор,
трансформирующий фактор роста в, а так
же глюкокортикоиды.
В
настоящее время показано, что инсулин
действует как ингибитор цитокиновой
индукции некоторых БОФ.
Интерлейкин-1
представлен двумя полипептидами ИЛ-1-а
и ИЛ-1-в, последний у человека преобладает.
Стимуляторами выделения ИЛ-1 являются
компоненты клеточных стенок бактерий
(липополисахарид) и медиаторы воспаления,
выделяемые активированными клетками.
Больше всего ИЛ-1 вырабатывают макрофаги.
На всех клетках организма имеются
рецепторы к ИЛ-1, и это обуславливает
его разнообразные эффекты на организм.
Обладая снотворным действием, этот
цитокин вызывает снижение работоспособности,
гиподинамию; стимулирует продукцию
кортикотропина и кортикостероидов,
подавляет гипоталамическую секрецию
соматолиберина и стимулирует выработку
соматостатина, что вызывает ослабление
анаболизма, протеолиз и освобождение
аминокислот из скелетных мышц, усиление
секреции синовиальной жидкости и
резорбтивные изменения в костях и
хрящах, что проявляется костно-мышечно-суставными
болями, а также снижение продукции
инсулина.
Фактор
некроза опухолей, образуется в виде
двух фракций. ФНО-а (кахектин) вырабатывается
макрофагами, лимфоцитами, тучными
клетками и микроглией. ФНО-в (лимфокин)
образуется лимфоцитами. Кахектин
является мощным пирогеном, тормозит
активность центра голода и стимулирует
центр насыщения в гипоталамусе, что
ведет к потере веса, обладает сильным
контринсулярным эффектом, стимулирует
синтез белков острой фазы печени,
индуцирует апоптоз гепатоцитов и клеток
желудочно-кишечного тракта.
ФНО
и ИЛ-1 особенно токсичны при совместном
действии, они способны блокировать
мембранное пищеварение и перистальтику
кишечника, провоцировать рвоту, понос,
вызывать дисфункцию гепатоцитов,
гиперкалиемию и ацидоз, а при массированном
освобождении приводить к летальности,
способствуя развитию ДВС-синдрома. Они
стимулируют эндотелий к продукции
прокоагулянтов, окиси азота и
миокардиального депрессорного фактора,
который вызывает снижение сократимости
миокарда.
ИЛ-6
— важнейший индуктор синтеза белков
острой фазы. Мишенью его действия служат
гепатоциты, тимоциты и лимфоциты. Он
также стимулирует гемопоэз, вызывая
продукцию гранулоцитов, моноцитов,
тромбоцитов, эритроцитов.
ИЛ-8
— это семейство пептидов, которые
вырабатываются макрофагами и клетками
кожи по сигналу ИЛ-6. Он усиливает
хемотаксис и краевое стояние лейкоцитов,
стимулирует освобождение дефензинов
из нейтрофилов.
В
ряде случаев системных проявлений
острого воспалительного процесса может
не быть, хотя различные органы организма
реагируют на повреждение. Это наблюдается
при достаточно быстрой активизации
антимедиаторной системы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
02.05.201534.57 Mб302008Руководство по кардиологии.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
· Лейкоцитоз. Лейкоцитоз — увеличение количества лейкоцитов в определённом объёме крови и, как правило, в организме в целом.Причины: Действие флогогенного агента, особенно если он относится к микроорганизмам; Продукты, образующиеся и высвобождающиеся при повреждении собственных клеток активируют синтез непосредственных стимуляторов лейкопоэза — лейкопоэтинов и/или блокируют активность ингибиторов пролиферации лейкоцитов.
· Лихорадка. Основная причина лихорадки— образование избытка ИЛ-1 и ИЛ-6, оказывающих, помимо прочего, также и пирогенное действие.
· Диспротеинемия. Причины диспротеинемии: Увеличение в крови фракции глобулинов. Это связано с активацией гуморального звена иммунитета; При воспалении, сочетающемся с интоксикацией или расстройством функций ССС, дыхательной, эндокринной и других систем, может нарушаться синтез альбуминов в печени с развитием дисбаланса альбуминов и глобулинов.
· Ускорение СОЭ. Причины ускорения СОЭ: Диспротеинемия; Изменение физико-химических параметров крови (развитие ацидоза, гиперкалиемии, увеличение уровня проагрегантов); Активация процессов адгезии, агрегации и оседания эритроцитов.
· Изменение гормонального статуса организма. Причины: Активация симпатико-адреналовой системы; Стимуляция комплекса гипоталамус-гипофиз-кора надпочечников; Изменение функции желёз внутренней секреции.
Другие общие изменения в организме: отклонения содержания в биологических жидкостях активности ферментов; изменение содержания или активности компонентов свёртывающей, противосвёртывающей и фибринолитической систем; аллергизация организма
2) Особенности первичной вторичной альтерации при воспалении
Альтерация – повреждение ткани, нарушение в ней питания и обмена веществ, ее структуры и функции. Различают 2 зоны альтерации:зона первичной и вторичной альтерации. Первичная альтерация — результат повреждающего действия самого воспалительного агента. Локализация: место прямого контакта причины воспаления с тканью.
Основные механизмы: 1-повреждение мембранных структур и внутриклеточных ферментов, а также структур межклеточного вещества
2- расстройство энергообеспечения и пластических процессов в поврежденной ткани
3- нарушение трасмембранного переноса и соотношения ионов
Проявления: (физико-химические изменения)
Альтеративные явления при воспалении включают тканевой распад и усиленный обмен веществ, что приводит к физико-химическим изменениям в воспалительной ткани — накоплению кислых продуктов (ацидоз), увеличению осмотического давления (осмотическая гипертензия или гиперосмия) и повышению коллоидно-осмотического давления или онкотического давления (гиперонкия). Морфологические проявления: некробиоз (полная деструкция) и некроз (гибель) тканей и клеток; явления белковой, жировой дистрофии, разрушение митохондрий, ЭПС, в строме фибриноидное набухание. Повышение обмена веществ происходит преимущественно за счет углеводов- окисление, гликолиз. Расщепление не всегда доходит до конца (СО2 и Н2О), дыхательный коэффициент снижается, в тканях накапливается недоокисленные продукты- молочная и трикарбоновые кислоты. Нарушение обмена белков, жиров приводит к накоплению ЖК, кетоновых тел, АК, нуклеотидов (АТФ) ->ацидоз
Гиперосмия. Причины:
1)Повышенное разрушение макромолекул (гликогена, гликозамингликанов и др)
2)Усиленный гидролиз солей
3)Поступление осмотически активных соединений из поврежденных клеток
Гиперонкия . Причины:
1- Увеличение концентрации белкав с связи с усилением гидролиза пептидов
2- Повышение гидрофильности белковых мицелл
3- Выход белков из крови в очаг воспаления
Вторичная альтерация— следствие воздействия на СТ, микрососуды и кровь высвободившихся внеклеточно лизосомальных ферментов и активных метаболитов кислорода, то есть влияние факторов вторично формирующихся в зоне первичной альтерации. Локализация: периферия места действия флогогенного агента или вокруг зоны первичной альтерации. Дополнительное (вторичное) повреждение направлено на скорейшее отграничение флогогена и быстрое завершение воспалительного процесса.
Механизмы развития:
— расстройство местных механизмов нервной регуляции из-за повреждения тел нейронов, нервных стволов и окончаний
— нарушение выделения нейромедиаторов (НА, ацетилхолина)
— стадийнве изменения тонуса сосудов – расстройство кровообращения
Проявления:
1) Изменение структуры клеток и межкл-го в-ва, обычно обратимые
2) Расстройство метаболизма
3) Умеренные отклонения физико-химических параметров
4) Обратимые изменения функции тканей и органов
3) Модуляторы воспаления, их отличия от медиаторов
4) Механизм красного стояния лейкоцитов при воспалении
5) Альтеративное воспаление. Примеры
Альтеративное воспаление характеризуется преобладанием повреждения (дистрофия, некроз, атрофия) органа, преимущественно его паренхимы (паренхиматозное воспаление), при менее выраженной реакции сосудисто-мезенхимальной ткани. Чаще всего поражаются паренхиматозные органы (печень, почки, сердце, скелетная мускулатура и др.) с высокодифференцированными клеточными элементами. По течению различают острое и хроническое альтеративное воспаление.
Причины. Обычно это сильно или длительно действующие химические вещества, токсикоинфекции и гиперэргические реакции, вызывающие тяжелые нарушения обмена веществ, вплоть до некроза ткани (некротизирующее воспаление).
Механизм развития. Он связан с преимущественным воздействием патогенных факторов на паренхиматозные элементы органа, что сопровождается глубокими метаболическими нарушениями и менее выраженными экссудативными и пролиферативными явлениями.
Макроскопические изменения. При остром течении паренхиматозные органы (печень, почки и др.) увеличены, дрябные, тусклые, гиперемированы или с неравномерно выраженной сосудистой реакцией и наличием пестрого рисунка (темно-красных и серовато-желтых участков), иногда с отдельными кровоизлиянием. Мышца сердца на поверхности разреза может иметь рисунок шкуры тигра («тигровое сердце» при остром ящурном миокардите). Легкие в состоянии казеозной пневмонии. Лимфоузлы —лучистого казеозного лимфаденита.Прихроническом течении органы уменьшены в объеме, плотные, со сморщенной, или шагреневой, капсулой. На поверхности разреза серо-красные и серо-белые участки с разросшейся соединительной тканью.
Микроскопические изменения. При остром течении проявляются главным образом дистрофические (углеводная, зернистая и гидротическая дистрофии, жировая декомпозиция, слизистая дистрофия эпителия слизистых оболочек) и некротические процессы, слущивание покровного эпителия. Сосудистая реакция выражена слабо в виде воспалительной гиперемии и отека, иногда кровоизлияний диапедезного типа. Отмечается пролиферация молодых соеди нительнотканныхклеток.Прихроническом течении отмечают атрофические процессы в паренхиматозных клетках, замещение паренхимы соединительной тканью.
Значение и исход. Значение определяется степенью повреждения воспаленного органа и его функциональной значимостью. При аль-теративном воспалении в нервной ткани и миокарде прогноз обычно бывает неблагоприятным. Исход воспаления зависит от степени поражения и вида поврежденного органа. Если не наступает гибель, то мертвая ткань замещается соединительной с исходом в склероз.-
6) Теория Шаде ( воспаление)
В первой половине нынешнего столетия учение о воспалении стало развиваться в связи с возникновением биофизических и биохимических методов. Результаты разносторонних физико-химических исследований воспалительного очага позволили Г. Шаде (1923) выдвинуть физико-химическую, или молекулярно – патологическую, гипотезу воспаления, согласно которой ведущим в патогенезе этого процесса является местное нарушение обмена веществ, приводящее к развитию ацидоза и повышению осмотического давления в ткани, лежащих в основе расстройств кровообращения и клеточных явлений при воспалении. Однако вскоре было показано, что физико-химические изменения, характерные для очага воспаления, обнаруживаются в ходе уже развившейся воспалительной реакции и не могут быть пусковым механизмом сосудистых и клеточных явлений.
7) Хроническое воспаление. Отличие от острого
8) Механизм эмиграции макрофагов при воспалении
Эмиграция– выход лейкоцитов из сосудов в ткань путем диапедеза через стенку венул. Механизм эмиграции состоит в явлении хемотаксиса. Важным моментом фагоцитоза является взаимодействие рецепторов клеточной мембраны с хемотаксическими агентами (фрагменты комплемента, калликреин, метаболиты арахидоновой кислоты, цитокины, лимфокины и т.д.). Нарушение реологических свойств крови, замедление кровотока, вследствие возрастания адгезивных свойств не только лейкоцитов, но и эндотелиальных клеток приводит к приклеиванию лейкоцитов к эндотелию- ФЕНОМЕН КРАЕВОГО СТОЯНИЯ ЛЕЙКОЦИТОВ. Лейкоциты псевдоподиями проникают в межэндотелиальные щели и выходят через эндотелиальный слой -> центр очага воспаления ( сначала нейтрофилы-моноциты-макрофаги)
9) Механизм воспалительного отека
В механизме воспалительного отека важную роль играет увеличение проницаемости кровеносных капилляров под влиянием гистамина, брадикинина и других биологически активных веществ.строение капилляров как в норме, так и при воспалении неоднородно. Различают по крайней мере три типа структуры капилляров и мелких вен:
Сплошной тип—эндотелий выстилает сосуд без перерывов, клетки плотно без щелей прилегают друг к другу, под эндотелием находится сплошная базальная мембрана. С наружной стороны мембраны располагаются перициты.
«Висцеральный тип» — между эндотелиальными клетками имеются «поры», проникающие и через базальную мембрану, или «фенестры» — поры, затянутые базальной мембраной, которая остается целой.
Синусоидный тип — капилляры имеют широкие щели между собой, базальная мембрана во многих местах отсутствует (Чернух А. М., 1976).
В ходе развития воспаления гистамин и другие медиаторы вызывают сокращение актомиозиновых нитей эндотелиальных клеток, сокращение этих клеток раздвигает межэндотелиальные щели, вызывает образование фенестров и пор. Другие медиаторы (кинины, брадикинин) вызывают образование в эндотелиальных клетках пузырьков (везикул) различной величины, а также отека под эндотелием, способствующего образованию щелей и пор. Все эти процессы участвуют также в активации процессов экссудации при воспалении. Важно подчеркнуть, что процесс образования везикул, вероятно, энергозависимый процесс, в механизме которого важную роль играют системы аденилциклазы, гуанилциклазы, холинэстеразы и других ферментов клеточных мембран.
Большую роль в механизме воспалительного отека играет затруднение оттока крови и лимфы из очага воспаленной ткани. Задержка оттока крови и лимфы вызывает выход плазмы крови и лимфы в ткань и развитие отека.
10) Эндогенные причины воспаления
Воспаление— типовой патологический процесс, возникающий в ответ на действие флогогенного (патогенного) фактора, характеризующихся развитием в организме как патогенных, так и адаптивных реакций. Процесс воспаления направлен на уничтожение и удаление из организма флогогенного фактора, а также на восстановление поврежденной ткани.
Причины воспаления экзогенные и эндогенные.
К экзогенным фактором относят: биологические факторы(микроорганизмы-бактерии, простейшие, вирусы; животные организмы-черви, паразиты; чужеродные белки, яды насекомых, змей);химические(кислоты, щелочи);физические факторы; механические(травма, инородное тело, давление, разрыв);термические(холод, тепло);электрические и лучевые воздействия.
К эндогенным факторам, возникающим в самом организме в результате другого заболевания, относятся продукты тканевого распада, тромбы, инфаркты, кровоизлияния, желчные или мочевые камни, отложения солей.
11) Образование брадикинина при воспалении
12) Механизм образования экссудата
Экссудация – выпотевание белковосодержащей жидкой части крови через сосудистую стенку в воспаленную ткань. (экссудат-жидкость воспалительного характера, в отличие от транссудата содержит большее количество белков – более 2%, также форменные элементы крови)
Механизм экссудации:
1) повышение проницаемости сосудов (венул и капилляров) в результате воздействия медиаторов воспаления и иногда самого воспал-го агента
Источник

