Системные изменения организма при воспалении

Синдром системного воспалительного ответа[1] (англ. «systemic inflammatory response syndrome» (SIRS)) — медицинский термин, введённый в 1992 году на конференции Американской коллегии торакальных хирургов (англ. American College of Chest Physicians) и Общества специалистов интенсивной терапии (англ. Society of Critical Care Medicine) в Чикаго[2] для обозначения общей воспалительной реакции организма в ответ на тяжелое поражение, вне зависимости от локализации очага. Процесс идет при участии медиаторов воспаления с вовлечением практически всех систем организма.
Воспалительная реакция организма в ответ на внедрение в организм инфекции, обширные травмы, развития некроза тканей, тяжелые ожоги развивается по одним и тем же общим закономерностям. Эта реакция является приспособительной функцией организма и направлена на уничтожение агента, вызвавшего процесс, и восстановление поврежденной ткани. При легких поражениях воспалительный процесс ограничивается локальными воспалительными изменениями и умеренной, малозаметной общей реакцией органов и систем.
Диагностика[править | править код]
Диагноз синдрома системной воспалительной реакции организма правомочен в случае наличия как минимум двух следующих критериев:
- Температура тела ≥ 38 °C (фебрильная температура) или ≤ 36 °C (гипотермия)
- Частота сердечных сокращений ≥ 90/мин (тахикардия)
- Тахипноэ: частота дыхания ≥ 20/мин или гипервентиляция с содержанием диоксида углерода в крови ≤ 32 mmHg
- Лейкоцитоз (≥ 12000/μl) или лейкопения (≤ 4000/μl) или смещение лейкоцитарной формулы влево.
Комбинация «фебрильная температура+лейкоцитоз» является самой частой для синдрома системной реакции организма на воспаление и соответствует нормальной реакции иммунной системы. В случае «гипотермия+лейкоцитоз», который встречается гораздо реже, говорят о «холодном» синдроме системной реакции организма на воспаление —— подобная реакция организма встречается при иммунодефиците.
Причины[править | править код]
Причинами синдрома системного воспалительного ответа могут быть: сепсис, гипоксия, шок, ожоги, острый панкреатит, обширные хирургические операции, тяжелые травмы и другие тяжелые заболевания. Чаще всего факторы повреждения классифицируют исходя из механизма патологического воздействия:[1]
- Механическое повреждение тканей (примеры: ожоги, синдром длительного сдавления).
- Глобальный недостаток перфузии тканей (примеры: шок, остановка кровообращения).
- Регионарный недостаток перфузии тканей (примеры: тромбоэмболия, травма крупных сосудов).
- Некроз тканей вследствие ишемии (примеры: инфаркт миокарда, острый панкреатит).
- Инфекционный процесс (примеры: иммунодефицит, хирургическая инфекция, инфицированная травма, внутрибольничная инфекция).
- Выброс эндотоксинов (пример: сепсис, вызванный грам-негативными бактериями).
- Невскрытые абсцессы (например, интраабдоминальные).
Примечания[править | править код]
Литература[править | править код]
- М. И. Кузин, О. С. Шкроб, Н. М. Кузин. Синдром системного ответа на воспаление // Хирургические болезни. — 3 издание. — М.: Медицина, 2002. — С. 13-22. — 784 с. — ISBN 5-225-00920-4.
- Определение SIRS (нем.) (недоступная ссылка). Дата обращения 11 февраля 2014. Архивировано 26 июня 2013 года.
- S-2 Рекомендации по профилактике, диагностике, лечению и реабилитации SIRS (нем.) (недоступная ссылка). Deutsche Sepsis Gesellschaft. Дата обращения 11 февраля 2014. Архивировано 1 октября 2010 года.
- R. C. Bone; R. A. Balk; F. B. Cerra; R. P. Dellinger; A. M. Fein; W. A. Knaus; R. M. Schein; W. J. Sibbald. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine (англ.) // Chest. — 1992. — Vol. 101, no. 6. — doi:10.1378/chest.101.6.1644.
Источник
Ответ
острой фазы — это комплекс последовательных
реакций, инициируемых физическими,
химическими, биологическими повреждающими
воздействиями или опухолевым процессом.
Принято
считать, что через 3-15
часов
после первичной альтерации на фоне
нейтрофилии повышается количество и
активность моноцитов, а затем и лимфоцитов
(возникает первичный иммунный ответ),
что и является началом ООФ, достигающего
максимума через 1-2
суток,
затем медленно ослабевающего и
заканчивающегося (в зависимости от
характера и выраженности как первичной,
так и вторичной альтерации) через 1-3
недели.
Субъективными
проявлениями ответа острой фазы являются:
сонливость, потеря аппетита (анорексия),
безразличие к окружающему (апатия), боли
в мышцах (миалгии), боли в суставах
(артралгии).
Объективные
проявления ответа острой фазы:
1.Изменения
со стороны крови:
1.1.нейтрофильный
лейкоцитоз с регенеративным сдвигом
влево
1.2.
увеличение СОЭ за счет снижения
поверхностного заряда эритроцитов,
который снижается из-за оседания
глобулинов и фибриногена на поверхности
эритроцитов, а также Н+
нейтрализуют отрицательный заряд
эритроцитов, происходит их агрегация,
снижение СОЭ.
1.3.Диспротеинемия:
гипоальбуминемия, гипергаммаглобулинемия,
появление в крови белков ответа острой
фазы (БОФ),
1.4.
снижение содержания железа (гипосидеремия),
цинка и увеличение концентрации меди
в сыворотке крови
1.5.
активация системы комплемента, активация
системы свертывания крови
2.лихорадка,
3.Развитие
общего адаптационного синдрома
4.активация
клеток иммунной системы
С биологических позиций ООФ следует
рассматривать как естественную
эволюционно сформированную реакцию
организма, цель которой заключается в
предотвращении тканевого повреждения,
изоляции и разрушении повреждающего
агента, а также в активации репаративных
процессов, необходимых для восстановления
нормальных жизненных функций. В ответ
на первичную альтерацию в развитии
воспалительного процесса наиболее
быстро (уже в течение 1-2 ч) активизируются
и эмигрируют из крови в очаг воспаления
нейтрофилы. Они осуществляют выраженное
местное защитное действие, проявляющееся
в пиноцитозе веществ, фагоцитозе
микроорганизмов, продуктов распада
тканей, токсинов, а также в высвобождении
и активации гидролаз, свободных радикалов
кислорода, перекисей, катионных белков
и других антимикробных и антитоксических
веществ. Через 3-15 ч после первичной
альтерации в очаге воспаления на фоне
нейтрофилии сначала повышается количество
и активность моноцитов, а затем и
лимфоцитов (раньше Т-, позже В-лимфоцитов),
т.е. возникает так называемый первичный
иммунный ответ. Фактически это и есть
начало ответа ООФ, достигающего максимума
через 1-2 сут, затем медленно ослабевающего
и заканчивающегося (в зависимости от
характера и выраженности как первичной,
так и вторичной альтерации) через 1-3
нед. Через выделение различных цитокинов
сначала нейтрофилы, а позже эндотелиоциты,
моноциты, гистиоциты, лимфоциты и
фибробласты начинают участвовать не
только в местных, но и в системных
реакциях, в том числе в активизации
различных звеньев и всей системы
иммунитета, а также гипофиза, надпочечников
и других различных как регуляторных,
так и исполнительных систем.
При
воспалении в крови изменяется содержание
белков ответа острой фазы (БОФ). Выделяют
две группы БОФ:
1) негативная
группа — концентрация БОФ снижается
(альбумин,трансферрин);
2) позитивная
группа — концентрация БОФ нарастает в
2-10 раз (альфа-1-антитрипсин, альфа-1-
антихимотрипсин, фибриноген, гаптаглобин);
менее чем в 2 раза (церулоплазмин, Сз
компонент комплемента, инактиватор
С1компонента
комплемента) и более, чем в 1000 раз (С —
реактивный белок (СРБ),сывороточный
амилоидный протеин А(САП-А)).
Белки
ООФ при остром экссудативно-деструктивном
воспалении (Д.Н.
Маянский, 2008)
Тип | Функции |
С1, | Опсонизация, |
Калликреин | Повышение |
Плазминоген | Активация |
С-реактивный | Регуляция |
Церулоплазмин | Нейтрализация |
а1-кислый | Регуляция |
а1- | Тормозит |
а | Тормозит |
а | Тормозит |
Гаптоглобин | |
Сывороточный |
СРБ
— наиболее популярен из всех БОФ, однако
интерпретация титров этого белка сложна,
так как его количество может не отражать
интенсивности воспалительного процесса.
В норме концентрация его составляет от
0,1 до 8,0 мг/л. Уровень СРБ достигает
максимума на 2-3-й день воспалительного
процесса и постепенно возвращается к
исходному значению на 12-15-е сутки.
При
затяжном и хроническом воспалении
содержание СРБ сохраняется на высоком
уровне.
К
наиболее чувствительным БОФ относятся
САП-А. Затем, по убыванию располагаются
СРБ, а-1-химотрипсин, церулоплазмин,
а-1-кислый гликопротеид. Определение
гаптаглобина или фибриногена
малоинформативно. При тяжелых формах
воспаления, особенно гепатитах, синтез
БОФ снижается. В этом случае их титр не
будет соответствовать активности
воспалительного процесса.
В
учебниках и руководствах по патологии
подробно рассматривается структурные,
метаболические и функциональные
изменения в очаге воспаления и мало
уделяется внимания на причины и патогенез
системных изменений.
Патогенез
системной реакции организма при
воспалении (по
Ю.С. Свердлову, 2000)
Повреждение
тканей (инфекция,
травма, распад опухоли, некроз, комплекс
антиген-антитело и др.)

 Воспаление
Воспаление
(освобождение
ИЛ —
1, ИЛ
—
6, ИЛ
—
8, ФНО
-а, ИНФ-у)
Системные
реакции
Нервная
Эндокринная Печень
Костный
Активация
система система мозг лимфоцитов
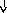
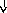
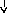
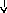
(активация
Гипоталамус
Гипофиз БОФ Лейкоцитоз,
иммунитета)
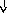

ретикулоцитоз
Лихорадка
АКТГ
В
настоящее время принято считать, что
реализацию системных изменений в
организме при воспалении осуществляют:
интерлейкин-1, интерлейкин-6, интерлейкин-8,
фактор некроза опухолей, интерфероны,
фактор ингибирования лейкемии, онкостатин
М, цилиарный нейтрофический фактор,
трансформирующий фактор роста в, а так
же глюкокортикоиды.
В
настоящее время показано, что инсулин
действует как ингибитор цитокиновой
индукции некоторых БОФ.
Интерлейкин-1
представлен двумя полипептидами ИЛ-1-а
и ИЛ-1-в, последний у человека преобладает.
Стимуляторами выделения ИЛ-1 являются
компоненты клеточных стенок бактерий
(липополисахарид) и медиаторы воспаления,
выделяемые активированными клетками.
Больше всего ИЛ-1 вырабатывают макрофаги.
На всех клетках организма имеются
рецепторы к ИЛ-1, и это обуславливает
его разнообразные эффекты на организм.
Обладая снотворным действием, этот
цитокин вызывает снижение работоспособности,
гиподинамию; стимулирует продукцию
кортикотропина и кортикостероидов,
подавляет гипоталамическую секрецию
соматолиберина и стимулирует выработку
соматостатина, что вызывает ослабление
анаболизма, протеолиз и освобождение
аминокислот из скелетных мышц, усиление
секреции синовиальной жидкости и
резорбтивные изменения в костях и
хрящах, что проявляется костно-мышечно-суставными
болями, а также снижение продукции
инсулина.
Фактор
некроза опухолей, образуется в виде
двух фракций. ФНО-а (кахектин) вырабатывается
макрофагами, лимфоцитами, тучными
клетками и микроглией. ФНО-в (лимфокин)
образуется лимфоцитами. Кахектин
является мощным пирогеном, тормозит
активность центра голода и стимулирует
центр насыщения в гипоталамусе, что
ведет к потере веса, обладает сильным
контринсулярным эффектом, стимулирует
синтез белков острой фазы печени,
индуцирует апоптоз гепатоцитов и клеток
желудочно-кишечного тракта.
ФНО
и ИЛ-1 особенно токсичны при совместном
действии, они способны блокировать
мембранное пищеварение и перистальтику
кишечника, провоцировать рвоту, понос,
вызывать дисфункцию гепатоцитов,
гиперкалиемию и ацидоз, а при массированном
освобождении приводить к летальности,
способствуя развитию ДВС-синдрома. Они
стимулируют эндотелий к продукции
прокоагулянтов, окиси азота и
миокардиального депрессорного фактора,
который вызывает снижение сократимости
миокарда.
ИЛ-6
— важнейший индуктор синтеза белков
острой фазы. Мишенью его действия служат
гепатоциты, тимоциты и лимфоциты. Он
также стимулирует гемопоэз, вызывая
продукцию гранулоцитов, моноцитов,
тромбоцитов, эритроцитов.
ИЛ-8
— это семейство пептидов, которые
вырабатываются макрофагами и клетками
кожи по сигналу ИЛ-6. Он усиливает
хемотаксис и краевое стояние лейкоцитов,
стимулирует освобождение дефензинов
из нейтрофилов.
В
ряде случаев системных проявлений
острого воспалительного процесса может
не быть, хотя различные органы организма
реагируют на повреждение. Это наблюдается
при достаточно быстрой активизации
антимедиаторной системы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
02.05.201534.57 Mб302008Руководство по кардиологии.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Каждый, кто болел тяжелой ангиной или респираторной инфекцией, имеет представление о системных симптомах острого воспаления.
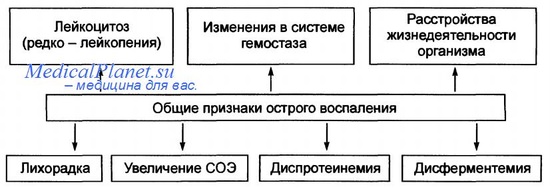
Комплекс системных изменений, сопровождающих острое воспаление, называют ответом острой фазы или синдромом системного воспалительного ответа.
Эти изменения связаны с реакциями цитокинов, продукция которых стимулируется бактериальными продуктами, такими как липополисахарид, и другими раздражителями воспаления.
Ответ острой фазы включает несколько клинических и патологических изменений:
— лихорадка (повышение температуры тела на 1-4°С, одно из наиболее частых проявлений ответа острой фазы, особенно когда воспаление вызвано инфекцией) является ответом организма на действие особых веществ — пирогенов, которые путем стимулирования синтеза простагландинов действуют на клетки сосудов и периваскулярных пространств гипоталамуса.
Такие бактериальные продукты, как липополисахарид (экзогенный пироген), стимулируют высвобождение лейкоцитами цитокинов, например IL-1 и TNF (эндогенных пирогенов), что повышает уровни СОХ, конвертирующих арахидоновую кислоту в простагландины. В гипоталамусе простагландины, особенно PGE2, стимулируют образование нейротрансмиттеров, например циклического аденозинмонофосфата, функция которых заключается в регуляции температуры тела.
Нестероидные противовоспалительные средства, включая аспирин, снижают явления лихорадки путем ингибирования синтеза простагландинов. Было показано, что повышенная температура тела помогает амфибиям бороться с микробными инфекциями, и предполагают, что лихорадка имеет то же значение для млекопитающих, хотя ее механизм неясен. Одна из гипотез заключается в том, что повышение температуры тела может индуцировать белки теплового шока, усиливающие реакцию лимфоцитов на микробные агенты;
— белки острой фазы — это белки, синтезированные преимущественно в печени, концентрации которых в плазме крови могут повышаться в несколько сот раз при реакции на воспалительный стимул. Самые известные белки острой фазы: С-реактивный белок, фибриноген и сывороточный амилоид А. Синтез этих молекул гепатоцитами регулируют цитокины, особенно IL-6 (для С-реактивного белка и фибриногена) и IL-1 или TNF (для сывороточного амилоида А).
Многие белки острой фазы, например С-реактивный белок и сывороточный амилоид А, связываются со стенками микробных клеток, где могут выполнять функцию опсонинов и связывать компоненты системы комплемента. Они также связывают хроматин, возможно помогая в удалении ядер некротических клеток. Во время ответа острой фазы сывороточный амилоид А заменяет аполипопротеин А, компонент частиц липопротеинов высокой плотности (ЛПВП), что может нарушить передачу ЛПВП клетками печени макрофагам, которые могут использовать эти частицы как ресурс для продуцирующих энергию липидов. Фибриноген связывается с эритроцитами, и формируются «монетные столбики», которые быстрее выпадают в осадок, чем отдельные эритроциты.
Именно скорость оседания эритроцитов является основным показателем наличия системного воспалительного ответа, вызванного любым стимулом. Белки острой фазы оказывают благоприятные эффекты при остром воспалении, но длительная продукция этих белков (особенно сывороточного амилоида А) при хроническом воспалении приводит к развитию вторичного амилоидоза. Повышенные уровни С-реактивного белка в сыворотке крови предлагается использовать в качестве маркера повышенного риска развития инфаркта миокарда у пациентов с болезнью коронарных артерий, поскольку С-реактивный белок продуцируется при воспалении, а гипотетически воспаление в атеросклеротической бляшке коронарной артерии предрасполагает к тромбозу и последующему инфаркту. Другой пептид, продукция которого повышается во время ответа острой фазы, — железорегулирующий пептид гепсидин.
Постоянно повышенные концентрации гепсидина в плазме при хроническом воспалении снижают биодоступность железа и приводят к развитию анемии;
— лейкоцитоз — характерный признак воспалительных реакций, особенно индуцированных бактериальными инфекциями. Количество лейкоцитов обычно повышается до 15-20 тыс. клеток/мкл, но иногда может достигать необычайно высоких уровней — до 40-100 тыс. клеток/мкл. Такие экстремальные повышения называют лейкемоидной реакцией, поскольку подобный уровень лейкоцитов наблюдается при лейкемии. В таких случаях необходима дифференциальная диагностика.
Лейкоцитоз первично появляется в результате усиленного высвобождения клеток, вызванного цитокинами, включая TNF и IL-1, из постмитотического пула костного мозга. Таким образом, лейкоцитоз ассоциирован с увеличением количества преимущественно незрелых нейтрофилов в крови (сдвиг влево). Длительные инфекции тоже индуцируют пролиферацию кле-ток-предшественников в костном мозге, вызывая повышение продукции колониестимулирующего фактора. Следовательно, в костном мозге повышается продукция лейкоцитов для компенсации их потерь при воспалительной реакции. Большинство бактериальных инфекций приводят к абсолютному повышению в крови числа нейтрофилов (нейтрофилии).
Вирусные инфекции, например мононуклеоз, инфекционный паротит и краснуха, вызывают абсолютное повышение количества лимфоцитов (лимфоцитоз). При бронхиальной астме, аллергии и паразитарных инфекциях обнаруживается абсолютное повышение количества эозинофилов (эозинофилия). Ряд инфекций (брюшной тиф и инфекции, вызываемые определенными вирусами, риккетсиями и некоторыми простейшими) сопровождаются уменьшением количества лейкоцитов в крови (лейкопенией). Лейкопения также появляется при инфекциях, поражающих пациентов, ослабленных диссеминированной злокачественной опухолью, активным туберкулезом или тяжелым алкоголизмом;
— увеличение частоты сердечных сокращений, повышение артериального давления, снижение потоотделения (главным образом из-за перераспределения кровотока с поверхностных на глубокие кровеносные русла для минимизации теплопотерь через кожу), озноб, зябкость, анорексия, сонливость и недомогание, вероятно из-за воздействий цитокинов на клетки мозга;
— септический шок. При тяжелых бактериальных инфекциях (сепсисе) высокие концентрации микроорганизмов и липополисахаридов в крови или во внесосудистых тканях стимулируют продукцию некоторых цитокинов, особенно TNF, а также IL-12 и IL-1 в огромных количествах. В результате изменяется характер реакции организма и появляется триада клинических признаков септического шока: диссеминированная внутрисосудистая коагуляция, гипогликемия и гипотензивный шок.
— Рекомендуем ознакомиться со следующей статьей «Варианты воспалительной реакции и ее последствия»
Оглавление темы «Патофизиология»:
- Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей — репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Источник

