Роль окислительного стресса в патогенезе воспаления

Вступление
- Окислительный стресс — это избыточное образование в клетках и тканях активных форм кислорода (АФК), которые не могу быть нейтрализованы антиоксидантами.
- Дисбаланс в работе защитных механизмов может приводить к повреждению молекул ДНК, белков, жиров и увеличить вероятность мутагенеза.
- Активные формы кислорода в норме образуются в ограниченном количестве и являются необходимой частью процессов поддержания клеточного гомеостаза и функций.
- В процессе клеточного дыхания митохондрии продуцируют АФК и органические перекиси.
- При гипоксии в реакциях дыхательной цепи может синтезироваться активная форма азота (АФА), которая в дальнейшем может влиять на синтез других активных соединений.
- Избыточная продукция АФК/АФА, особенно в течение длительного периода, может стать причиной повреждения клеточной структуры и нарушения функции и приводить к соматическим мутациям и предраковым и раковым изменениям; в дальнейшем она может вызывать необратимые изменения в клетках, некроз и апоптотические процессы.
Полифенолы — это натуральные соединения, встречающиеся в растениях, со множеством биологических эффектов. Фенольные соединения и флавоноиды могут взаимодействовать с АФК/АФА и прерывать цепную реакцию до того, как она сильно повредит клетку.
- Различные воспалительные стимулы, такие как избыточная продукция АФК/АФА в окислительном фосфорилировании и некоторые натуральные или искусственные соединения, инициируют противовоспалительный процесс с синтезом и секрецией противовоспалительных цитокинов.
- Критическую роль в воспалительном процессе играют активация ядерного фактора «каппа би»/ активирующего белка-1 (NF-κB/AP-1) и синтез фактора некроза опухолей альфа (TNF-α), они приводят к развитию некоторых хронических заболеваний.
- Фитохимические вещества, такие как полифенолы, могут модулировать воспалительные процессы.
Это исследование описывает биологические эффекты полифенолов и их возможное противовоспалительное действие.
Отношения между окислительным стрессом и воспалением
- Воспаление — это естественный защитный механизм, направленный против патогенов. Оно ассоциировано со множеством патогенетических состояний, таких как микробные и вирусные инфекции, воздействия аллергенов, радиации и токсических химикатов, аутоиммунные и хронические заболевания, алкоголизм, курение и выскокалорийная диета.
- Многие из хронических заболеваний, при которых синтезируются АФК, приводят к окислительному стрессу и окислению белков.
- Более того, окисление белков переходит в выброс молекулярных воспалительных сигналов, например, пероксиредоксина.
- Данные свидетельствуют о том, что окислительный стресс играет патогенную роль в заболеваниях, обусловленных хроническим воспалением.
- Повреждения, вызванные им, такие как окисленные белки, продукты гликозилирования и липидное перокисление приводят к дегенеративным изменениям нейронов при заболеваниях мозга.
- АФК, продуцируемые в мозге, могут модулировать синаптическое и несинаптическое взаимодействие между нейронами, что приводит к воспалению и смерти клеток, а потом и к нейродегенеративным процессам и потере памяти.
- Повреждения, вызванные им, такие как окисленные белки, продукты гликозилирования и липидное перокисление приводят к дегенеративным изменениям нейронов при заболеваниях мозга.
- Трипептидный гютатион (GSH) — это внутриклеточный тиольный антиоксидант; его низкий уровень вызывает повышенный синтез АФК и приводит к дисбалансированному иммунному ответу, воспалению и инфекции.
- Были проведены исследования роли GSH и его окисленной формы, их регуляторых функций и генной экспрессии отдельно от поглощения радикалов.
- GSH участвует в окисительно-восстановительной регуляции иммунитета через смешанные дисульфиды между цистеинами и глутатионами.
- Это явление известно как глутатионилирование, осуществляющее свои функции через сигнальные белки и транскрипционные факторы.
Воспалительные стимулы индуцируют выброс PRDX2 — убиквитинового редокс-активного внутриклеточного фермента.
- После выброса он работает как редокс-зависимый медиатор воспаления и стимулирует синтез и выброс ФНО-α макрофагами.
- Глутатионилирование GSH происходит до или во время выброса PRDX2, что регулирует иммунитет.
- Salzano и др. при использовании протеомных методов масс-спектрометрии выявили PRDX2 среди глютатинированных белков, синтезированных in vitro LPS-стимулированными макрофагами.
- PRDX2 также является частью воспалительного каскада и может индуцировать выброс ФНО-α.
- В классической воспалительной реакции цитокины синтезируются, но PRDX2 не влияет на мРНК или на синтез белка, опосредованный липосазаридом (LPS), хотя впоследствии он и обнаруживается в макрофагах, но в более низком уровне, чем при стимуляции LPS и выработке в окисленной форме.
- В исследовании приходят к заключению, что PRDX2 и тиоредоксин макрофагов могут изменять редокс-статус поверхностных рецепторов клетки и позволять индуцировать воспалительный процесс, что делает их новой терапевтической мишенью.
- Избыточный окислительный стресс вызывает сильное повреждение клеток мозга при диабете.
- Высокая липидная пероксидация, уровень нитритов, малондиальдегида и общий окислительный статус были ниже в полностью антиоксидантных маркерных ферментах мозга крыс с диабетом.
- Также окислительный стресс увеличивает уровень воспалительных цитокинов (напр. ФНО-α) и активирует воспалительные молекулы, например, VCAM-1 и NF-κB, что приводит к дегенерации нейронов и диабетической энцефалопатии.
В Схеме 1 показаны факторы хронического воспаления, связанного с ожирением; воспаление не может рассматриваться как болезнь, а должно рассматриваться как биологический процесс, участвующий в патогенезе многих заболеваний. Совместное лечение значительно снижает концентрацию TBARS и фрагментацию ДНК в легких.
Исследование эффекта экстракта лимонной вербены на аккумуляцию триглицеридов в инсулин-резистеных гипертрофированных 3T3-L1 адипоцитах показало, что полифенолы, входящие в ее состав уменьшают аккумуляцию триглицеридов и генерацию АФК в данных клетках.
Биодоступность полифенолов
- Полифенолы — натуральные вещества, однако существуют и синтетические и полусинтетические формы.
- Они содержатся в фруктах, овощах, хлопьях, а также в красном вине, чае, кофе, шоколаде и в сухих бобах. Наконец, они есть в травах, специях, стеблях и цветах.
- Суточное потребление полифенолов может достигать 1 г и, таким образом, это — наиболее потребляемые фитохимические антиоксиданты.
Полифенолы — это вторичные растительные метаболиты, участвующие в защите организма от ультрафиолетового излучения и патогенов.
- Они характеризуются горьким, вяжущим вкусом и специфическим запахом. В растениях обнаружено более 8000 фенольных веществ.
- Примерами их являются флавоноиды: флавонолы, флавоны, изофлавоны, антоцианиды и др.
- Они могут активировать транскрипционный фактор Nrf2, играющий ключевую роль в защите от окислительного стресса и воспаления.
Факторы окружающей среды также влияют на содержание полифенолов в диете.
- Это почва, количество света и влаги, хозяйственные методики и урожайность растения.
- При созревании плода также изменяется содержание фенольных кислот.
- Биодоступность зависит от пищеварения, абсорбции и метаболизма, а вот количество поступивших полифенолов на нее не влияет.
- Большая часть этих веществ представлена в эфирной форме.
- Они плохо абсорбируются в кишечнике и сначала гидролизуются ферментами или микрофлорой.
- В кровь они поступают в измененной форме.
- Некоторая часть может достигать толстого кишечника и метаболизироваться кишечной микробиотой, давая начало некоторым бактериальным метаболитам.
- Микромолярная часть флавоноидов и монофенолов обнаруживается в фекалиях.
Полифенолы в окислительном стрессе
Антиоксидантные возможности полифенолов
- Антиоксидантная активность полифенолов зависит от структуры их функциональных групп.
- Количество гидроксильных групп влияет на такие процессы, как поглощение радикалов и хелатирование ионов металлов.
- Антиоксидантная активность определяется возможностью полифенолов поглощать широкий диапазон АФК. Антиоксидантные свойства полифенолов заключаются в подавлении формирования АФК. Это осуществляется ингибированием ферментов, поглощением АФК или усилением антиоксидантной защиты.
- Полифенолы могут снижать каталитическую активность ферментов, участвующих в генерации АФК.
- При синтезе АФК увеличивается число свободных ионов металлов благодаря подавлению водородной пероксидазы и генерации активных гидроксильных радикалов.
- Низкие редокс-потенциалы полифенолов могут термодинамически редуцировать высокоокислительные свободные радикалы, так как они могут хелатировать ионы металлов и свободные радикалы.
- Например, у кверцетина есть возможности к хелатированию и стабилизации ионов железа.
Взаимодействие со свободными радикалами
- Полифенолы могут взаимодействовать с неполярными компонентами гидрофобной части плазматической мембраны; эти изменения в мембране влияют на скорость окисления липидов и белков.
- Некоторые флавоноиды гидрофобного слоя защищают структуру и функцию мембраны от окислителей.
- Взаимодействие полифенолов с синтазой оксида азота (NOS) может модулировать продукцию NO.
- Ксантиноксидаза (КО) рассматривается как основной источник свободных радикалов и некоторых флавоноидов, таких как кверцетин. Она подавляет этот процесс. Флавоноиды могут уменьшать активность пероксидазы и ингибировать генерацию свободных радикалов нейтрофилами и активацию этих клеток α1-антитрипсином.
Ингибирование ферментов при окислении
- Было показано, что разные полифенолы модулируют активность ферментов, метаболизирующих арахидоновую кислоту, таких как циклооксигеназа (COX), липоксигеназа (LOX) и NOS.
- Подавление их активности уменьшает продукцию арахидоновой кислоты, простогландинов, лейкотриенов и NO — одних из ключевых медиаторов воспаления. Развитие воспаления при метаболизме арахидоновой кислоты показано в Схеме 2.
Бактериальные эндотоксины и воспалительные цитокины стимулируют макрофаги с последующим увеличением экспрессии iNOS, синтезом NO и окислительным повреждением.
- Полифенолы подавляют LPS-индуцированную экспрессию генов iNOS и ассоциированную с ней активность в макрофагах, что уменьшает окислительное повреждение.
COX и LOX ответственны за продукцию метаболитов и могут усиливать окислительное повреждение тканей.
- Некоторые полифенолы могут подавлять их активность.
- Окислительное повреждение тканей может усиливаться метаболитами, продуцированными при метаболизме КO. При ишемии активность ксантиндегидрогеназы может преобразовываться в активность КO, что приводит к образованию АФК. Окислительное повреждение снижается при снижении активности КО.
Полифенолы в воспалении
Модулирующие функции полифенолов по отношению к клеткам в воспалительном процессе
- При остром хроническом воспалении в животной модели была обнаружена противовоспалительная активность полифенолов (кверцетина, рутина, гесперетина). Таблица 1.
- Рутин эффективен только при хроническом воспалении, особенно при артрите, а флаваноны – при неврогенном воспалении, индуцированном ксиленом.
- Кверцетин может уменьшать отек лапы, вызванный каррагинаном.
- Воспаление, индуцированное LPS может модулироваться даидзеином, глицитином и их гликозидами.
Полифенолы могут влиять на ферментативные и сигнальные системы воспалительного процесса, например,на тирозиновую и серин-теониновую киназы.
- Эти ферменты участвуют в пролиферации Т-клеток, активации В-лимфоцитов и синтезе цитокинов. Специфическим ингибитором тирозиновой киназы является генистеин.
- Он также вовлечен в пролиферацию Т-клеток, которая сопровождается фосфорилированием тирозина в белковых цепях.
- Было также отмечено воздействие полифенолов на секреторную активность клеток.
- Лютеолин, апигенин и кверцетин являются сильными ингибиторами б-глюкуронидазы и лизосом, выделенных нейтрофилами.
- Эти вещества также ингибируют выделение арахидоновой кислоты из мембраны.
Механизм противовоспалительных эффектов полифенолов
- Противовоспалительные эффекты заключаются в поглощении свободных радикалов, регуляции клеточной активности и модулировании активности ферментов, участвующих в метаболизме арахидоновой кислоты и аргинина, а также в модулировании синтеза других провоспалительных молекул.
- Молекулярные противовоспалительные механизмы включают в себя ингибирование провоспалительных ферментов (COX-2, LOX, iNOS), NK-кB, активирующего белка-1 (AP-1), активацию антиоксидантных детоксифирующих ферментов фазы 2 и активацию митоген актиированной белковой киназы, киназы-С и ядерного эритроид 2-связанного фактора.
- Эксперименты с фитохимическими веществами показали возможность модулирования других медиаторов воспаления, например, метаболитов арахидоновой кислоты, различных белков, возбуждающих аминокислот и цитокинов. Центральной в воспалительном процессе может быть также активность некоторых вторичных посредников (cGMP, cAMP, киназ и кальция) и некоторых белков и их компонентов (iNOS), цитокинов, нейропептидов и протеаз.
Роль полифенолов в хронических заболеваниях, обусловленных воспалением
Полифенолы и сердечно-сосудистые заболевания
- Антиоксидантные свойства полифенолов могут играть положительную роль в воспалении и канцерогенезе.
- Благоприятные эффекты наблюдались при включении в диету продуктов с высоким содержанием полифенолов: фруктов, овощей, кофе, красного вина и др. были показаны положительные результаты такой диеты и снижение вероятности ССЗ.
- Механизм действия заключается в работе синтазы оксида азота (eNOS) и ее биодоступности для эндотелия.
- В этом регуляторном механизме оксида азота участвуют полифенолы, сигнальные пути, такие как PI3-киназа/Akt и внитриклеточный Са2+, которые фосфорилируют eNOS, что приводит к продукции NO.
- Флаванолы и флавонолы тоже могут уменьшать возрастные сосудистые повреждения, взаимодействуя с МАРК и снижать количество транскрипционных факторов, что редуцирует НАДФ-оксидазу.
Полифенолы и неврологические заболевания
- Регуляция развития неврологических заболеваний может осуществляться диетой с большим количеством флавоноидов.
- Нейродегенеративные заболевания предупреждаются полифенолами путем модулирования нейрональных и глиальных сигнальных путей.
- Полифенолы снижают количество транскрипционных факторов NF-κB, реагирующих на р58 и индуцирующих iNOS.
- При исследовании нейровоспалительных процессов в ЦНС выявляется возможная связь между сигнальными путями и транскрипционными факторами и продукцией цитокинов.
- Также полифенолы оказывают защиту при нейротоксичности, вызванную конечными продуктами гликолиза (AGEs)
Полифенолы, как альтернативная цель раковой терапии
- При достаточном поступлении полифенолов в организм снижается частота возникновения некоторых форм рака.
- Так, эти соединения защищают от желудочно-кишечных раков, а полифенолы в овощах и фруктах предотвращают рак толстого кишечника.
- Зеленый чай может снижать риск возникновения раков желчных протоков, мочевого пузыря, груди и толстого кишечника.
- Механизмы противоракового действия включают в себя элиминацию карциногенов, модификацию сигналов раковых клеток, стимулирование клеточного цикла и апоптоза и модуляцию активности ферментов. Антиоксидантные свойства полифенолов подавляют формирование и развитие рака, например, взаимодействие с активными интермедиатами и стимулируют карциногенез и мутагенез. Флаванол, галлат эпигаллокатехина, содержащийся в зеленом чае, индуцирует апоптоз и предотвращает рост клеток путем взаимодействия с регуляторными и сигнальными белками клеточного цикла.
Заключение
- Полифенолы обладают многими свойствами, например, антиоксидантными, противовоспалительными, противоопухолевными, против старения, кардиопротекторными, противораковыми и противомикробными. Они широко представлены в различных патологических ситуациях.
- Окислительный стресс активирует медиаторы воспаления, задействованные в некоторых хронических заболеваниях. Окислительный стресс и воспаление, вызванные избыточной продукцией АФК, могут играть важную роль в развитии заболеваний, включая хронические, ассоциированные с воспалением. Употребление продуктов, содержащих полифенолы, может положительно влиять предотвращение и лечение подобных заболеваний. Однако исследований данной проблемы все еще мало.
- Более полное понимание механизмов действия полифенолов может помочь точнее определять клинические случаи, при которых потребление полифенолов может быть полезно. Эти исследования также помогут создать новые средства с противовоспалительным эффектом.
Источник:
- Tarique Hussain, Bie Tan, Yulong Yin, Francois Blachier, Myrlene C. B. Tossou, and Najma Rahu, “Oxidative Stress and Inflammation: What Polyphenols Can Do for Us?,” Oxidative Medicine and Cellular Longevity, vol. 2016, Article ID 7432797, 9 pages, 2016. doi:10.1155/2016/7432797
Источник
Введение
Мочекаменная болезнь (МКБ) является давно известным, описанным еще врачами древности заболеванием, но и спустя многие сотни лет неизвестны все звенья патогенеза [1]. Распространенность МКБ зависит от множества различных факторов: географических, климатических, генетических, этнических, от особенностей питания. Распространенность МКБ по всему миру составляет от 1 до 20%, однако в некоторых странах отмечается значительный прирост за последние годы [2]. Тенденция к росту заболеваемости МКБ наблюдается независимо от пола, возраста и расовой принадлежности [3]. При этом отмечается высокая частота рецидивирования заболевания, достигающая 50–75% в интервале 5–10 лет [4]. Сложность лечения данного заболевания заключается в предотвращении рецидива уролитиаза, потому что хирургическое лечение устраняет только симптомы заболевания, а не его причины [5]. Среди многих важных факторов патогенеза исследования последних лет установили роль активных форм кислорода в формировании камней оксалатно-кальциевой природы [6].
Оксалатные камни в почках образуются при избыточном накоплении солей в зоне петли Генле (бляшки Рэндалла) в виде субэпителиальных первичных центров кристаллизации с дальнейшей инвазией в чашечно-лоханочную систему на поверхности почечных сосочков. Основой оксалатных камней являются различные кальцийсодержащие кристаллы, образующиеся в моче [7]. С химической точки зрения кристаллы оксида кальция могут быть представлены тремя формами: моногидратом, дигидратом и тригидратом оксалата кальция. Наиболее литогенной из них является моногидрат. Процесс литогенеза имеет две фазы: первая — это зарождение новых кристаллов, вторая — их рост [8]. Производство активных форм кислорода (АФК) вызывает дифференцировку эпителиальных/эндотелиальных клеток в клетки, похожие на остеобласты, и отложение фосфата кальция в базальной мембране почечных канальцев или сосудов. Избыток кристаллов вреден для клеток почечных канальцев, т. к. приводит к их повреждению. Очаг воспаления является местом прикрепления и удержания кристаллов, которые затем увеличиваются в размерах путем дальнейшей кальцификации интерстициального коллагена и мембранных везикул. Агрегация и слияние кристаллов фосфата кальция приводят к образованию основы будущего конкремента. Как только вновь образовавшийся камень начинает контактировать с мочой, поверхностные слои фосфата кальция заменяются оксидом кальция [9]. Доказательства этой теории были продемонстрированы как в естественных, так и в экспериментальных условиях [10, 11].
Окислительный стресс (ОС) в современной научной литературе зачастую рассматривают как один из наиболее общих патологических процессов, сущностью которого является разбалансировка состояния про- и антиоксидантных систем клеток, тканей, органов. Всем аэробным организмам необходим кислород для их метаболизма, главным образом, чтобы генерировать аденозинтрифосфат через цепь переноса электронов [12]. Полное восстановление O2 до H2О требует поэтапного добавления 4 электронов, и, соответственно, поэтапно образуются 3 активные формы кислорода: супероксидный анион (•O2-), перекись водорода (H2O2) и гидроксильный радикал (•OH) [13]. Около 95% поступающего в организм кислорода в процессе окислительного фосфорилирования восстанавливается в митохондриях до воды. Оставшиеся 5% преобразуются в высокотоксичные для клеток продукты — АФК [14]. ОС — это состояние организма, когда образование свободных радикалов выходит из-под контроля антиоксидантных систем, что приводит к их неконтролируемому росту и повреждению биомолекул [12]. Патогенез ОС впервые был описан немецким врачом Helmut Sies в 1985 г. [15]. В организме существует 6 основных источников АФК: цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород); реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450; реакции окисления в лейкоцитах, макрофагах и пероксисомах; радиолиз воды; воздействие ксенобиотиков, пестицидов; реакции самопроизвольного (неферментативного) окисления ряда веществ [16]. В противовес прооксидантам в организме есть антиоксидантные системы, которые борются с АФК, тем самым предотвращая развитие заболеваний, ассоциированных с ОС [12]. Одна часть системы направлена на предотвращение влияния свободных радикалов на клетки, вторая борется с последствиями такого влияния [17]. Сигнальным путем, который регулирует цитопротективный ответ на АФК, является ядерный фактор, связанный с эритроидным фактором 2 (Nuclear factor erythroid 2-related factor 2, Nrf2). Следовательно, активацию пути Nrf2 и применение антиоксидантов можно рассматривать как попытку уменьшения ОС, задержки старения и снижения риска заболеваний, связанных с ОС [18]. Образование АФК является одним из стандартных метаболических процессов в организме. Однако если АФК образуются в избытке и антиоксидантные системы декомпенсированы, то свободные радикалы непосредственно воздействуют на клеточные биомолекулы, вызывая повреждение тканей. Это в конечном итоге приводит к патологическим процессам в органах и тканях [19].
Существует множество состояний, при которых происходит гиперпроизводство свободных радикалов. Например, потребление калорийной пищи напрямую увеличивает
аэробный метаболизм и, следовательно, окислительное фосфорилирование, приводящее к увеличению продукции АФК в митохондриях. Тяжелый труд, курение, сахарный диабет также увеличивают выработку АФК через метаболические реакции [8]. К таким же последствиям приводит воздействие ионизирующего (рентгеновские, гамма-лучи) и неионизирующего (ультрафиолет) излучения [20]. Чрезмерная активация фагоцитарных клеток в очаге воспаления приводит к локальному респираторному выбросу с образованием супероксид-аниона, перекиси водорода и хлорноватистой кислоты (HOCl) [21]. При хирургических вмешательствах, направленных на восстановление кровотока, развивается реперфузия с выбросом большого количества свободных радикалов, вызывающих ОС [22]. Снижение содержания антиоксидантов в организме связано с неадекватным их потреблением, мутациями и истощением клеточного глутатиона в результате детоксикации большого количества ксенобиотиков [18].
Избыточная кристаллизация в почечной паренхиме вызывает выработку АФК в клетках почечных канальцев, что приводит к ОС и их повреждению. Кристаллы также индуцируют выработку и высвобождение медиаторов воспаления, активируют воспалительный ответ, что еще больше усиливает повреждение. Как ОС, так и воспаление вызывают выделение различных биологически активных веществ, создавая порочный круг усиления литогенеза. Агрегация кристаллов является одним из важнейших этапов литогенного процесса. Если этого не произойдет, литогенез не завершится. Исследования показывают, что связывание кристаллов будущего камня требует биологического «клея» — каменной матрицы [23]. В исследовании C. Boonla (2018) было показано, что у пациентов с нефролитиазом постоянно наблюдается повышенное количество свободных радикалов на фоне паренхиматозного воспаления в почках, и эти патологические изменения способствуют развитию почечной недостаточности [18].
Экспериментально доказано, что применение антиоксидантов ингибирует отложение кристаллов оксида кальция и, соответственно, снижает риск развития рецидива нефролитиаза [24]. В связи с этим можно предположить, что некоторые лекарственные растения с антиоксидантными свойствами [25], которые традиционно используются для профилактики МКБ, могут компенсировать ОС и снизить риск рецидива нефролитиаза [26, 27].
Цель исследования — изучить влияние антиоксидантных свойств комплекса биологически активных веществ из натуральных растительных компонентов, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, и оценить возможности его использования в рамках профилактики рецидивов МКБ на основе изменений концентрации маркеров камнеобразования (бикунина, остеопонтина).
Материал и методы
В 2018 г. в МНОЦ МГУ им. М.В. Ломоносова было проведено исследование применения комплекса биологически активных веществ из натуральных растительных компонентов, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин (БАД НефраДоз®) в качестве средства профилактики рецидивов МКБ у пациентов с кальций-оксалатным уролитиазом. Согласно инструкции рекомендован прием этого комплекса по 1 капсуле (300 мг) 2 р./сут во время еды. В состав комплекса входят травы, обладающие уросептическим, спазмолитическим, диуретическим и антиоксидантным эффектами: экстракт корней марены красильной, экстракт листьев ортосифона, экстракт травы эпимедиума (горянка), экстракт корней родиолы розовой, экстракт корней солодки, ресвератрол, экстракт листьев гинкго билоба, а также лактоза.
В исследование были включены 90 пациентов (мужчины и женщины в возрасте от 18 лет), имеющие рецидивирующее течение МКБ (больше 1 рецидива в анамнезе), с кальций-оксалатным уролитиазом, подтвержденным спектроскопией конкремента. Критерием исключения были вторичные формы МКБ, когда основной причиной камнеобразования является системный патологический процесс (синдром мальабсорбции, первичный гиперпаратиреоз) ввиду заведомой неэффективности лечения подобных пациентов. Все пациенты были разделены поровну на 2 группы, сопоставимые по возрасту, режиму труда и отдыха, алиментарным привычкам, региону проживания. Разделение по группам осуществлялось с использованием рандомайзера. 1-я группа (основная) получала комплекс биологически активных веществ в качестве добавки к ежедневным приемам пищи, 2-я группа (контрольная) находилась под динамическим наблюдением. Период наблюдения составил 6 мес. Контрольное обследование проводилось каждые 3 мес. и включало литос-тест, определение концентрации маркеров МКБ (бикунин, остеопонтин) в моче и определение суточной концентрации ионов кальция и оксалатов.
Антиоксидантную активность препарата определяли методом активированной хемилюминесценции в системе генерации свободных радикалов 2,2’-азобис(2-амидинопропан) дигидрохлорида (АБАП, Sigma) в присутствии активатора хемилюминесценции люминола (Sigma). Методика основана на определении площади «провала» после добавления антиоксиданта к системе. В качестве контроля для определения антиоксидантной активности использовали тролокс — 2,5,7,8-тетраметил-2(2’-карбоксиэтил)-6-гидроксихроман, производное витамина Е (Sigma). Его активность условно принимали за единицу, а антиоксидантная активность исследуемого вещества выражалась в эквивалентных молях тролокса на массу образца — стандартизованных единицах — Trolox equivalent antioxidant capacity (мкмоль/мг, мкМ). Помимо тролокса антиоксидантную активность комплекса биологически активных веществ сравнивали с ресвератролом — природным фенольным стилбеноидным соединением с доказанной антиоксидантной активностью (Sigma) [28].
Достоверность различий полученных результатов определяли по критерию Стьюдента с уровнем значимости не более 0,05.
Результаты исследования
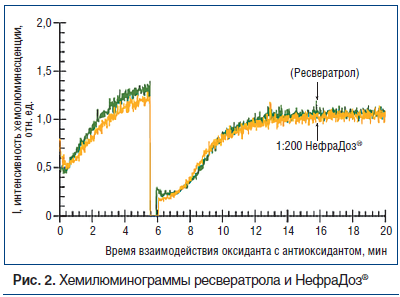
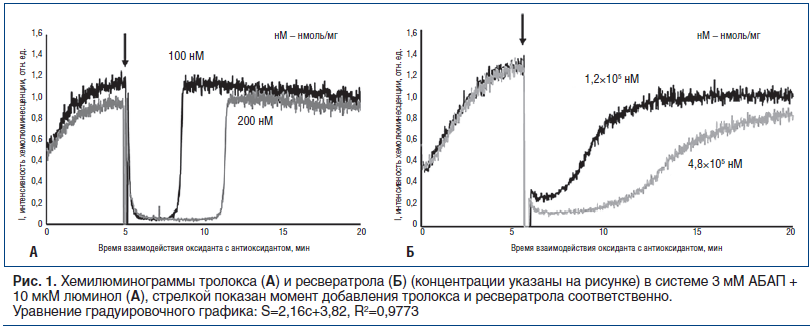
Градуировочную зависимость строили как по тролоксу, общепринятому стандартному антиоксидантному соединению [29], которое реагирует со свободными радикалами в соотношении 1:1, так и по ресвератролу, природному антиоксиданту, для которого характерны кривые другого вида (рис. 1 А, Б). На рисунке 1 видно время выхода фоновой антиоксидантной активности тролокса и ресвератрола на исходный уровень после подавления блокатором люминолом (стрелкой показано время начала ответа после принудительного подавления антиоксидантной активности).
Антиоксидантная активность комплекса биологически активных веществ из натуральных растительных компонентов (экстракт корней марены красильной, экстракт листьев ортосифона тычиночного, экстракт травы эпимедиума, экстракт корней родиолы розовой; экстракт корней солодки голой, экстракт листьев гинкго билоба), содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, определяется главным образом ресвератролом, содержащимся в нем, и компонентами, подобными ресвератролу по антиоксидантной активности.
Это убедительно подтверждается полученными в эксперименте хемилюминесцентными кривыми (рис. 2). Подобные кривые характерны для природных антиоксидантов средней силы [28], кинетические константы перехвата свободных радикалов таких антиоксидантов составляют порядка единицы.

Проведено сравнение активности 1 капсулы БАД НефраДоз® и концентрации ресвератрола из расчета 10 мг (столько ресвератрола содержится в 1 капсуле препарата): при растворении 10 мг ресвератрола в 1,0 мл ацетона получен раствор с концентрацией вещества 44 мМ. Антиоксидантная активность данной концентрации ресвератрола оценивается в 19 мкМ в единицах тролокса, активность 1 капсулы препарата (300 мг) несколько выше — 23,66±1,18 мкМ в единицах тролокса (добавочный антиоксидантный эффект других растительных компонентов препарата).
Тролоксовый эквивалент (ТЭ) можно применить для количественной оценки — определить активность антиоксиданта, выраженную в концентрационных единицах тролокса. Именно ТЭ лежит в основе теста ORAC (Oxygen radical absorb capacity), который используют для оценки и сравнения антиоксидантных свойств объектов сложного состава, таких как растительные препараты. Антиоксидантный эффект комплекса биологически активных веществ из натуральных растительных компонентов, содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, можно считать обоснованным и доказанным.
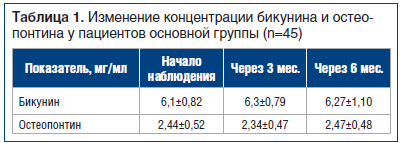
В процессе исследования измеряли концентрацию потенциальных маркеров МКБ (бикунин, остеопонтин) на разных этапах наблюдения. Активность камнеобразования измеряли с помощью литос-теста (от 0 до 3, где 3 — самая высокая степень активности камнеобразования), по результатам которого была подтверждена эффективность комплекса биологически активных веществ в отношении уменьшения активности МКБ. Концентрация вышеуказанных маркеров достоверно не изменилась на фоне приема комплекса в течение всего периода лечения (p>0,05) (табл. 1).
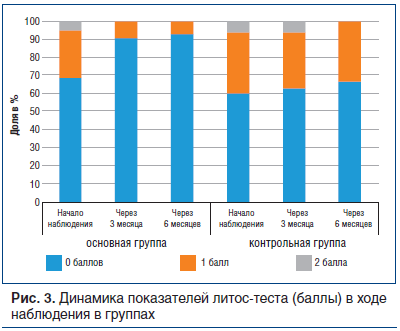
Количество пациентов с нулевой степенью активности камнеобразования в процессе лечения статистически значимо увеличилось от 31 до 42 (t-критерий Стьюдента = 4,31>1,992 при степени свободы 78, р<0,05). Исследование маркеров рецидивного камнеобразования и активности камнеобразования по данным литос-теста (рис. 3) выявило отсутствие маркерной манифестации в течение 6 мес. у 42 пациентов из 45 в этой группе (p>0,05).
Обсуждение результатов
Исходя из того, что активности свободных радикалов отводится отдельное место в патогенезе рецидивного камнеобразования [30], эффект ресвератрола как одного из компонентов БАД может компенсировать дисфункцию локальных антиоксидантных систем. Отсутствие маркеров камнеобразования в течение 6 мес. у 42 из 45 наблюдаемых (p>0,05) говорит об увеличении безрецидивного периода у пациентов после удаления конкрементов. Одна капсула БАД НефраДоз® имеет антиоксидантную активность, равную 23,7 мкМ тролоксового эквивалента, что обеспечивает компенсаторное и корригирующее действие при локальной дисфункции антиоксидантных систем. Вышеперечисленные эффекты увеличивают длительность ремиссии после удаления конкрементов.
ОС является важным отягчающим компонентом камнеобразования, прежде всего из-за наличия нескольких важных фармакологических мишеней в данном механизме [30]. Аналогичный эффект не исключен у некоторых лекарственных препаратов, таких как ингибиторы АПФ, витамин Е и др., однако эффективность их действия должна быть проверена в дальнейших исследованиях.
Заключение
Назначение комплекса биологически активных веществ из натуральных растительных компонентов (экстракт корней марены красильной, экстракт листьев ортосифона тычиночного, экстракт травы эпимедиума, экстракт корней родиолы розовой, экстракт корней солодки голой, ресвератрол, экстракт листьев гинкго билоба), содержащего биоантрахиноны, ресвератрол, глицирризиновую кислоту, салидрозиды, икариин, пациентам с кальций-оксалатным уролитиазом в качестве патогенетически обоснованного средства приводит к достоверному уменьшению активности МКБ, при этом максимальный эффект регистрируется через 3–6 мес. применения. Антиоксидантная активность определяется прежде всего ресвератролом и другими компонентами препарата, подобными ему по антиоксидантной активности. Компенсируя локальную активность свободных радикалов в точках кристаллизации, они усиливают вероятность длительной ремиссии МКБ. Таким образом, БАД НефраДоз® можно использовать с целью профилактики рецидива кальций-оксалатного уролитиаза.
Благодарность
Публикация осуществлена при поддержке компании «ШТАДА Арцнаймиттель АГ» в соответствии с внутренней политикой и действующим законодательством РФ. «ШТАДА Арцнаймиттель АГ», ее работники либо представители не принимали участия в написании настоящей статьи, не несут ответственности за содержание статьи, а также за любые возможные относящиеся к данной статье договоренности либо финансовые соглашения с любыми третьими лицами. Мнение «ШТАДА Арцнаймиттель АГ» может отличаться от мнения авторов и редакции.
