Роль лизосомальных ферментов в воспалении

Значение лизосом в патологии столь многогранно и существенно, что в настоящее время трудно представить патологический процесс, в который не был бы вовлечен лизосомальный аппарат клетки. Следует выделить два аспекта этой проблемы. Во-первых, вовлечение лизосом в развитие таких общих патологических процессов, как воспаление и некроз и в этом случае участие лизосом является одним из проявлений их нормальной защитной функции организма в ответ на возникновение очага инфекции. Однако развитие ряда патологий связано с нарушением структуры и функции самих лизосом. Нарушения в лизосомах являются первичным, пусковым звеном в развитии двух типов патологических процессов. Для первого из них характерно повреждение лизосомальных мембран. Каковы же обстоятельства, способствующие возникновению патологической дестабилизации лизосомальной мембраны, ведущей к выходу в клеточный матрикс кислых гидролаз? Установлено, что проницаемость лизосомальных мембран значительно увеличивается при гипоксии (недостаток кислорода), изменении кислотно-щелочного равновесия, после травм и хирургических вмешательств, голодании, при заболеваниях суставов и инфекционных заболеваниях, воздействии ионизирующей радиации и некоторых химических агентов. Последнее нашло практическое применение, в частности направленное повреждающее воздействие некоторых фармакологических агентов и ионизирующей радиации на мембраны лизосом опухолевых клеток используется при лекарственной и радиотерапии онкологических заболеваний. Из патологических состояний, связанных с повреждением лизосомальных мембран и высвобождением гидролаз, наиболее изучены болезни суставов — острый и ревматоидный артриты, подагра. При этих заболеваниях, в результате воздействия лизосомальных ферментов, наблюдается эрозия хрящей и деструкция суставов Показано, что аналогичные изменения могут быть получены у экспериментальных животных при введении в область сустава, веществ, обладающих дестабилизирующим действием на лизосомальные мембраны, например стрептолизина S. Наоборот, вещества, стабилизирующие лизосомальные мембраны (к ним относятся многие противовоспалительные препараты, например, глюкокортикостероид — кортизон), значительно уменьшают воспалительную реакцию.
К другой, сравнительно редкой группе заболеваний обусловленных нарушением функции лизосом, относят врожденные генетические нарушения в системе синтеза лизосомальных ферментов. Эти нарушения приводит к развитию так называемых лизосомальных болезней накопления. Такие болезни вызываются, главным образом, мутацией в гене, кодирующем ту или иную гидролазу, что выражается либо в полном подавлении синтеза ферментного белка, либо в синтезе белковых молекул обладающих резко сниженной биокаталитической активностью. Кроме этого генетически обусловленными могут быть нарушения при которых ферментный белок синтезируется без сигнальных участков и по этой причине не распознается транспортной системой. В результате блокируется его доставка из аппарата Гольджи в лизосомы. Нерасщепленный субстрат такой гидролазы накапливается в лизосомах, что приводит к переполнению клеток разбухшими лизосомами, клетки приобретают пенистый вид (пенистые клетки), утрачивают вследствие этого свои функциональные свойства и в конечном результате погибают, что ведет к развитию тяжелых заболеваний (напр. болезнь Тей-Сакса, Гоше, Нимана-Пика и др.), заканчивающихся во многих случаях смертельным исходом в детском возрасте.
Источник

Медиаторы воспаления. Медиаторами воспаления называются биологически активные вещества, которые синтезируются в клетках или в жидкостях организма и оказывают непосредственное влияние на воспалительный процесс. Клеточные медиаторы были рассмотрены выше (см. табл. 2). Гуморальные медиаторы воспаления синтезируются в плазме и в тканевой жидкости в результате действия соответствующих ферментов. Первоначальной причиной появления (или увеличения количества) этих веществ является альтерация. Именно в результате повреждения клеток освобождаются и активируются лизосомальные ферменты, которые активируют другие ферменты, в том числе содержащиеся в плазме, в результате чего возникает целый ряд биохимических реакций. Поначалу они носят хаотический характер («пожар обмена»), а продукты расщепления не имеют физиологического значения, нередко токсичны. Постепенно, однако, в этом процессе появляется определенный биологический смысл. Протеолитические ферменты расщепляют белки не до конца, а только до определенного этапа (ограниченный протеолиз), в результате чего образуются специфические вещества, действующие целенаправленно и ызывающие специфический патофизиологический эффект. Оказалось, что одни из них действуют преимущественно на сосуды, повышая их проницаемость, другие – на эмиграцию лейкоцитов, третьи – на размножение клеток. Первым обнаружил определенный «порядок» и закономерность в процессе воспаления В. Менкин. В воспалительном экссудате он выявил и индивидуализировал химические вещества и сопоставил с ними определенные слагаемые воспаления: гиперемию, лейкоцитоз, хемотаксис.
Одним из клеточных медиаторов воспаления является гистамин. Он содержится в гранулах тканевых базофилов (тучные клетки или лаброциты) в комплексе с гепарином и химазой в неактивной форме. В. свободном состоянии он оказывает расширяющее действие на мелкие сосуды (капилляры, венулы), увеличивая проницаемость их стенки. В малых дозах гистамин расширяет артериолы, в больших – суживает венулы. Выброс гистамина осуществляется вместе с выбросом в окружающую среду всех или части гранул тканевых базофилов при их дегрануляции. Этому может способствовать воздействие тепла, ионизирующего или ультрафиолетового излучения, растворов солей, кислот, белков, синтетических полимеров и мономеров, поверхностно-активных веществ. Дегрануляция всегда наблюдается при иммунных реакциях, т.е. при взаимодействии антигена с антителом на поверхности тканевых базофилов.
Другим клеточным медиатором воспаления является серотонин. У человека он содержится в тромбоцитах, хромаффинных клетках слизистой оболочки кишок, а также в некоторых нервных структурах. При разрушении клеток серотонин поступает в среду, вызывая повышение проницаемости сосудов.
Тканевые базофилы вырабатывают также гепарин, роль которого при воспалении заключается в том, что он препятствует образованию фибрина на внутренней оболочке капилляров, способствуя также увеличению проницаемости их стенки.
Лимфокины — вещества белковой природы, образующиеся в лимфоцитах, также относятся к медиаторам воспаления. Описано более десяти различных лимфокинов. При воспалении наибольшее значение имеют три из них: фактор, угнетающий эмиграцию макрофагоцитов, фактор, активирующий макрофагоциты, фактор хемотаксиса.
В клетках крови (лейкоцитах, тромбоцитах и др.) образуется еще одна группа веществ, играющих важную роль в динамике воспаления. Это простагландины. Источником их образования являются фосфолипиды клеточных мембран. Нарушение строго упорядоченной структуры фосфолипидов в мембране делает их доступными действию фосфолипазы А2, в результате чего отщепляется арахидоновая кислота. С нее начинается каскад химических реакции, идущих в двух направлениях. Сели на арахидоновую кислоту действует фермент циклоксигеназа, то в итоге образуются простагландины (ПГЕ2, ПГФ2, ПГИ2) или простациклины (ПГИ2), если же свою активность проявляет прежде всего липоксигеназа, то получаются лейкотриены. Дальнейшее превращение простагландинов происходит под влиянием тромбоксансинтетазы, в результате чего образуется тромбоксан А. Последний вызывает сужение сосудов, агрегацию тромбоцитов, тромбоз, отек, боль.
Другой путь биосинтеза простагландинов заключается в том, что под влиянием простациклинсинтетазы образуется простациклин (ПГИ2). Этот процесс совершается в эндотелиоцитах, где и находится указанный фермент. Он оказывает действие, противоположное тромбоксану: расширяет сосуды и подавляет агрегацию тромбоцитов. Таким образом, арахидоновая кислота дает начало двум веществам с противоположным действием, причем выбор одного из путей биосинтеза, по-видимому, связан с состоянием эндотелия. В неповрежденных эндотелиальных клетках содержится достаточно простациклинсинтетазы и весь ПГГ2 превращается в простациклин. Если же эндотелий поврежден, то этого фермента будет недоставать и потому часть ПГГ превращается в тромбоксан 2. Арахидоновый каскад представляет интерес еще и потому, что в ходе его образуются свободные радикалы, которые могут повреждать клеточные мембраны, в том числе и лизосом.
Лейкотриены оказывают хемотаксическое и хемокинетическое (нецеленаправленное движение) действие, повышают проницаемость, вызывают сокращение гладких мышц, индуцируют образование тромбоксанов.
К медиаторам воспаления относятся также циклические нуклеотиды, которые правильнее было бы назвать не медиаторами, а модуляторами, так как они не создают полной картины воспаления, а могут лишь в той или иной степени преобразовывать ее. Циклические нуклеотиды обусловливают эффект действия других медиаторов, выделение клетками лизосомальных ферментов и др. Отмечено противоположно направленное действие цАМФ и цГМФ. Так, первый подавляет выделение гистамина и лизосомальных ферментов, а второй, наоборот, способствует ему.
Из гуморальных медиаторов воспаления наибольшее значение имеют кинины – группа вазоактивных полипептидов, образующихся в результате каскада биохимических реакций, начинающихся с активации фактора Хагемана (рис. 12.4). Соприкосновение с поврежденной поверхностью или изменение внутренней среды (температура, рН) приводит к тому, что этот фактор становится активным и действует на находящийся в плазме прекалликреин, превращая его в калликреин. Последний в свою очередь влияет на ?2-глобулины, отщепляя от них полипептидную цепочку, состоящую из 9 (брадикинин) или 10 аминокислотных остатков (каллидин). Плазменные кинины оказывают непосредственное влияние на тонус и проницаемость сосудистой стенки, вызывая расширение прекапиллярных артериол и увеличивая проницаемость стенки капилляров. Кроме того, они обусловливают типичные для воспаления зуд и боль. Медиаторы калликреин-кининовой системы при воспалении влияют на реологические свойства крови, т.е. на ее способность находиться в жидком и текучем состоянии. Из рис. 12.4 видно, что активный фактор Хагемана может инициировать процессы кининообразования, гемокоагуляции и фибринолиза. Выпадение нитей фибрина и образование тромбов в зоне воспаления определенным образом связаны с состоянием калликреин-кининовой системы.
К гуморальным медиаторам воспаления относятся компоненты комплемента. Известно, что последний является важным защитным фактором организма, но вместе с этим он может способствовать повреждению собственных тканей, что бывает при воспалении, особенно иммунном. Объясняется это тем, что из 9 компонентов комплемента 3 имеют ближайшее отношение к рассматриваемому процессу. Так, комплемент С5 обладает способностью фиксироваться на сенсибилизированных и несенсибилизированных антителами клетках и разрушать их мембраны. Фрагменты СЗа и С5а, а также трехмолекулярный комплекс С567 вызывают хемотаксис лейкоцитов. Наконец, клетки, нагруженные фрагментами С36, становятся объектом активного фагоцитоза.
Медиаторы воспаления
Название Оказываемое действие Происхождение
Клеточные медиаторы
Гистамин Местное расширение сосудов, повышение их проницаемости, особенно венул Гранулы тучных клеток
Серотонин Спазм посткапиллярных венул, повышение проницаемости стенки сосудов Тромбоциты, хромаффинные клетки слизистой оболочки пищеварительного канала
Лизосомальные ферменты Вторичная альтерация, хемотаксис Гранулоциты, тканевые базофилы, макрофаги
Катионные белки Повышение проницаемости стенки сосудов Нейтрофильные гранулоциты
Продукты расщепления арахидоновой кислоты (кислые арахидониды)
Простагландины (ПГЕ 1 ) Проницаемость сосудов, отек, хемотаксис Арахидоновая кислота
Тромбоксан (ТХА 2 ) Агрегация тромбоцитов, вазоконстрикция, свертывание крови Тромбоциты
Простациклин (ПГИ 2 ) Дезагрегация тромбоцитов, расширение сосудов Эндотелиоциты
Лейкотриены Хемотаксис, сокращение гладких мышц, отек Лейкоциты
Гуморальные медиаторы
Кинины (брадикинин, каллидин) Расширение капилляров, увеличение проницаемости, боль, зуд ? 2 -глобулины крови
Система комплемента (фрагменты СЗа, С5а) Хемотаксис, цитолиз Плазма крови
Дата добавления: 2015-11-05; просмотров: 1459 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Источник
• Протеазы:
эластазы, коллагеназы, катепсины B,
D,G,
F;
• Гидролазы
гликозидов: β-глюкуронидаза, лизоцим,
нейраминидаза;
• Гидролазы эфиров:
ДНКаза;
• Гидролазы
липидов: фосфолипаза А1
и А2,
холестеролэстеразы;
• Другие ферменты:
кислая фосфатаза.
Ферменты эндоплазматического ретикулума
Таблица 4.1.2
Ферменты
эндоплазматического ретикулума и их
локализация
Ферменты | Локализация |
Ферменты | гладкий |
ферменты | гладкий |
Ферменты, локализованные в цитозоле
• Метаболизм
углеводов: ферменты гликолиза, включая,
фосфорилазу, киназу фосфорилазы,
протеинкиназу, гликогенсинтаза,
фосфоенолпируват-карбоксикиназа,
ферменты пентозо-фосфатного пути,
малатдегидрогеназа, изоцитратдегидрогеназа;
• Обмен липидов:
ацетил-СоА-карбоксилаза, комплекс
синтазы жирных кислот;
• Обмен аминокислот
и белков: аспартатаминотрансфераза,
аланинаминотрансфераза, аргиназа,
аминоацил-т-РНК-синтетазы;
• Синтез нуклеотидов:
нуклеозидкиназа, нуклеотидкиназа.
Мембранные ферменты
• Периферические
белки (легко экстрагируется из мембраны
солевым раствором).
• Интегральные
белки с небольшой частью полипептидной
цепи, закреплённой в мембране.
• Интегральный
белок с небольшой частью полипептидной
цепи, внедрённой в бислой.
• Интегральный
белок, пронизывающий липидный бислой,
(ионные трансферазы, такие как
Na,K-АТРаза,Са2+
-АТРаза).
• Белок, присоединённый
к мембране за счёт второго белка, который
находится в бислое (рис.4.3.2).
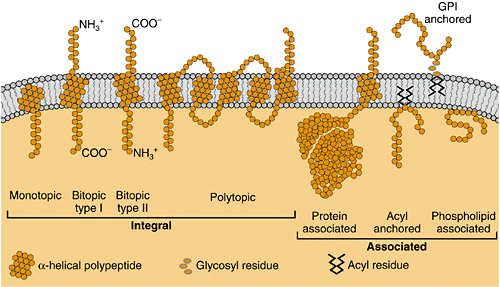
Рис. 4.1.2. Мембранные
ферменты
Уровни структурной организации ферментов в клетке
В клетке есть
ферменты разной структурной организации
– от простых мономерных до ферментов,
объединенных в ферментные ансамбли.
Ферменты по их структурной организации
можно разделить на:
1.
Мономерные
ферменты;
2. Олигомерные
ферменты (простые, построенные из
субъединиц одного типа);
3. Олигомерные
ферменты (сложные, построенные из
субъединиц разного типа);
4. Ферментные
комплексы : а) мультиферментные комплексы,
б)
мультиферментные конъюгаты;
5. Ферментные
ансамбли: а) адсорбционные,
б)
интегральные.
Значения
молекулярных масс ферментов колеблются
в широких пределах: от нескольких тысяч
до нескольких миллионов. В природе
насчитывается несколько десятков
ферментов, обладающих сравнительно
небольшими молекулами (до 50 кДа).
Большинство же ферментов представлено
белками более высокой молекулярной
массы, построенными из субъединиц
(рис.4.1.3).

a
б
в
г
Рис. 4.1.3. Модели
строения некоторых олигомерных ферментов:
а ‒ молекула глутаматдегидрогеназы,
состоящая из 6 протомеров; б ‒ молекула
РНК-полимеразы; в ‒ половина молекулы
каталазы; г ‒ молекулярный комплекс
пируватдегидрогеназы.
Так,
каталаза (252 кДа) содержит в молекуле
шесть протомеров с молекулярной массой
42 кДа каждый. Молекула фермента,
ускоряющего реакцию синтеза рибонуклеиновых
кислот (РНК-полимераза, 400 кДа), состоит
из 6 неравных субъединиц. Полная молекула
глутаматдегидрогеназы, ускоряющей
процесс окисления глутаминовой кислоты
(336 кДа), построена из 6 субъединиц с
молекулярной массой 56 кДа.
Процесс олигомеризации
придает субъединицам белков повышенную
стабильность. Связи в комплексе в
основном нековалентные, поэтому такие
ферменты легко диссоциируют на протомеры.
Способы
компоновки протомеров в мультимеры
разнообразны. Крайне важно, что достроенный
из субъединиц фермент проявляет
максимальную каталитическую активность
именно в виде мультимера: диссоциация
на протомеры резко снижает активность
фермента. Не все ферменты-мультимеры
построены исключительно из каталитически
активных протомеров. Наряду с
каталитическими в их составе отмечены
регуляторные субъединицы, как, например,
у аспартат-карбамоилтрансферазы.
Среди
ферментов-мультимеров безусловно
преобладают димеры и тетрамеры (их
несколько сотен), в меньшей мере
распространены гексамеры и октамеры
(несколько десятков) и необыкновенно
редко встречаются тримеры и пентамеры.
Молекулы
ферментов-мультимеров в ряде случаев
составлены из субъединиц двух типов,
обозначаемых условно как субъединицы
типа А
и В.
Они сходны друг с другом, но отличаются
по некоторым деталям первичной и
третичной структур. В зависимости от
соотношения протомеров типа А
и В
в мультимере последний может существовать
в виде нескольких изомеров, которые
называют изозимами. Так, при четырех
субъединицах возможны 5 изозимов:
IIIIIIIVV
AAAAAAABAABBABBBBBBB
В
настоящее время интерес к изозимам
резко повысился. Оказалось, что кроме
генетически детерминированных изозимов
существует большая группа ферментов,
обладающая множественными формами,
возникающими в результате их
посттрансляционной модификации.
Множественные формы ферментов и изозимы
в частности используются сейчас для
диагностики болезней в медицине,
прогнозирования продуктивности животных
подбора родительских пар при скрещивании
для обеспечения максимального гетерозиса
в потомстве и т. п. (более детально эти
вопросы рассмотрены в лекции 5.2).
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Клетки, функции которых активируются при воспалении, подразделяют на две группы по месту их пребывания на момент воздействия повреждающего агента: первая — дендритные клетки, макрофаги и тучные клетки, которые содержатся в тканях постоянно (клетки-резиденты), вторая — другие клетки, поступающие в зону воспаления извне (клетки-эмигранты). К ним относятся гранулоциты (ней-трофильные, эозинофильные), моноциты и лимфоциты.
Дендритные клетки вместе с моноцитами-макрофагами относятся к антиген-представляющим, или антигенпрезентирующим, клеткам (АПК), которые способны представлять Т-хелперам на своей цитоплазматической мембране инородные процессированные антигены вместе с молекулами ГКГС II класса. Благодаря наличию разветвленных отростков они образуют важную систему защиты в поверхностных структурах организма (кожа и слизистые оболочки) и органах (лимфатические узлы, селезенка, легкие), расположенных на путях наиболее возможного проникновения флогогенов. Кроме того, активированные АПК продуцируют специфические сигналы — “угрозы”. К этой группе относятся провоспалительные цитокины, такие как ИЛ-1, ИЛ-6, ФНО-α, ФНО-β и γ-ИФ, различные хемокины и др. Роль ИЛ-1 особенно важна. Под его влиянием Т-лимфоцитыхелперы 1-го типа в момент презентации антигена начинают продуцировать ИЛ-2, который активирует пролиферацию и дифференциацию Т-лимфоцитов-киллеров, а также функцию моноцитов-макрофагов и натуральных киллеров.
Макрофаги. «Классически активированные» в начале воспалительного процесса инфекционными факторами и Т-хелиерами 1-го типа макрофаги синтезируют ИЛ-1. Он находит свои мишени — клетки мышечной, костной, нервной тканей, синовиоциты, гепатоциты, лимфоциты. На мембранах этих клеток имеются специфические рецепторы для ИЛ-1. Действие ИЛ-1 стимулирующее и универсальное, т. е. проявляется при любой болезни воспалительной этиологии (инфекционной или неинфекционной), причем на ранних ее этапах. Есть основания считать, что ранние симптомы болезни (головная боль, боль в мышцах и суставах, сонливость, лихорадка, лейкоцитоз, повышение уровня белков, в том числе и иммуноглобулинов) объясняются именно действием ИЛ-1 (рис. 31).

Роль указанных макрофагов не ограничивается продукцией ИЛ-1. Они также синтезируют более 100 биологически активных провоспалительных цитокинов, фосфолипаз, протеиназ, лизосомальных гидролаз, факторов комплемента, эйкозаноидов, активных кислородных радикалов, в том числе NO, и др. Основная функция этих макрофагов — фагоцитоз собственных клеток, инфицированных бактериями, вирусами, простейшими, грибами, и погибших клеток, в том числе нейтрофилов.
“Альтернативно активированные” Т-хелперами 2-го типа макрофаги синтезируют противовоспалительные цитокины, ингибиторы протеиназ, антифосфолипазы, антиоксиданты, ингибиторы комплемента, биогенных аминов, кининов, фибринолиза, факторы роста и компоненты внеклеточного матрикса. Такое изменение функции моноцитов-макрофагов происходит лишь после обезвреживания флогогенного фактора, его переваривания и преобразования антигена в растворимую форму.
Тучные клетки (тканевые базофилы, мастоциты, лаброциты) после повреждения выбрасывают гистамин, гепарин и лейкотриен D4, факторы хемотаксиса нейтрофилов (ФХН) и эозинофилов (ФХЭ), фактор активации тромбоцитов (ФАТ), которые содержатся в их гранулах. Гистамин и гепарин прежде всего действуют на сосуды (гиперемия). Лейкотриен D4 является хемоаттрактантом, а также вызывает спазм неисчерченных мышц бронхиол и кишечника.
Нейтрофильные гранулоциты. Основная функция этих клеток — фагоцитоз грамотрицательных бактерий и некоторых грибов (гноеродная микрофлора). Попав в кровь из костного мозга, они под влиянием хемоаттрактантов мигрируют из сосудов и в большом количестве скапливаются в очаге воспаления. Размножение клеток, миграция, участие в фагоцитозе регулируются БАВ, для которых на поверхностной мембране нейтрофилов существуют специфические рецепторы.
В цитоплазме нейтрофильных гранулоцитов есть два типа гранул: первичные азурофильные (больших размеров) — обычные лизосомы, в состав которых входят кислые гидролазы, лизоцим, миелопероксидаза. Вторичные (специфические) гранулы более мелкие, а главное — они содержат другой набор веществ (ферментативных и неферментативных), щелочную фосфатазу, лизоцим и неферментативные (катионные) белки. Гликопротеид лактоферрин является хелатором железа (связывает 2 моль железа на 1 моль белка), отбирая у бактерий важное для их жизнедеятельности железо. Вместе с тем, снижение благодаря лактоферрину концентрации Fe2+тормозит образование гидроксильного радикала в реакции Фентона, что уменьшает повреждение собственных тканей. Мощнейшим бактерицидным фактором нейтрофилов служат активные кислородные радикалы, особенно гипохлорит, образующийся под влиянием миелопероксидазы.
Эозинофильные гранулоциты. Их роль в воспалении определяется способностью адсорбировать и разрушать свободный гистамин с помощью гидролитического энзима гистаминазы и обезвреживать лейкотриены арилсульфатазой-В. Антихимотрипсин-α1 ингибирует сериновые протеиназы. Важную роль играют эозинофильные цитотоксические белки (основной белок белок эозинофилов), которые способны повреждать гельминты и их личинки и нейтрализовать гепарин. Миграция и активация эозинофильных гранулоцитов происходят под действием фрагментов (С5а) и компонентов (С5, С6, C7) комплемента, пептидов тучных клеток, лейкотриенов и веществ, вырабатываемых гельминтами.
Тромбоциты. Роль тромбоцитов в процессе воспаления заключается большей частью в том, что они принимают непосредственное участие в процессах микроциркуляции. Очевидно, это наиболее постоянные и универсальные клетки воспаления. В них содержатся вещества, влияющие на проницаемость сосудистой стенки, ее тонус и адгезивные свойства, на рост и размножение клеток, а главное — на способность крови свертываться.
Лимфоциты принимают участие в любом воспалении, особенно иммунной этиологии. Иммунный ответ, как и эффекторная фаза иммунных реакций, регулируется растворимыми медиаторами (интерлейкинами). Основными продуцентами интерлейкинов являются T-лимфоциты, моноциты и тканевые макрофаги.
Фибробласты пролиферируют и активируются в последней стадии воспаления, накапливаясь в очаге воспаления, где они синтезируют коллаген, эластин и гликозаминогликаны. Обобщенные данные о клетках воспаления приведены в табл. 11.


Медиаторы воспаления — это БАВ, являющиеся центральным звеном патогенеза воспаления, поскольку оказывают непосредственное регуляторное влияние на воспалительный процесс, как правило, в пределах очага воспаления (табл. 12). Различают гуморальные и клеточные медиаторы воспаления.
Медиаторы, на момент повреждения находящиеся в плазме крови, называются гуморальными медиаторами. Они представляют собой систему протеиназ плазмы крови, которые синтезируются преимущественно в макрофагах и гепатоцитах и попадают в кровь в неактивном состоянии. Клеточные медиаторы либо синтезируются заново в процессе воспаления уже в активном состоянии (эйкозаноиды и АКР), либо депонируются в гранулах и везикулах клеток и при воспалении активируются и секретируются (биогенные амины, лизосомальные ферменты, катионные белки). Основной причиной образования и/или высвобождения медиаторов клеточного происхождения является альтерация. Именно в результате повреждения клеток выделяются и активируются лизосомальные ферменты, которые в свою очередь активируют другие ферменты, в том числе и пропротеиназы плазмы крови. При этом протеолитические ферменты расщепляют белки не до конца (ограниченный протеолиз), вследствие чего образуются протеиназы и другие специфические активные вещества, дающие определенный патофизиологический эффект Одни из них действуют преимущественно на сосуды, усиливая проницаемость их стенки, другие — на миграцию лейкоцитов, а некоторые — на размножение клеток.
Первым, кто увидел в воспалении определенный “порядок”, закономерность, был В. Менкин. В воспалительном экссудате он выявил химические вещества и установил их влияние на некоторые характерные для воспаления реакции: гиперемию, экссудацию, лейкоцитоз, хемотаксис. С той поры в фактическом материале многое изменилось, однако это направление (химия воспаления) успешно развивается.
Клеточные медиаторы воспаления представлены биогенными аминами, лизосомальными ферментами, неферментативными катионными белками, эозинофильными цитотоксическими белками, активными кислородными радикалами (см. выше), эйкозаноидами, фактором активации тромбоцитов, цитокинами.
Биогенные амины главным образом депонируются в гранулах тучных клеток (гистамин) и тромбоцитах (серотонин, адреналин и норадреналин). Дегрануляция и выброс этих медиаторов происходит под влиянием флогогенных факторов, цитокинов, лизосомальных ферментов, катионных белков, АКР, а также комплексов антигенов с IgE и IgG4, фиксированных на Fc-рецепторах тучных клеток в процессе анафилактической реакции. Адреналин и норадреналин вызывают быстрый и кратковременный спазм сосудов, а гистамин — расширение артериол, повышение проницаемости сосудов микроциркуляторного русла с развитием отека, спазм гладкомышечных клеток, раздражение болевых рецепторов. Серотонин в очаге воспаления действует на мелкие сосуды подобно гистамину, но спазмирует более крупные.
Лизосомальные ферменты нейтрофилов и макрофагов вместе с АКР, катионными белками и мембранатакующим комплексом комплемента являются основным средством защиты от микроорганизмов, убивая и переваривая их в фаголизосомах. В то же время эластаза, коллагеназа и другие нейтральные протеиназы обусловливают разрушение базальных мембран и других матриксных белков, усиливая вторичную альтерацию и повышая проницаемость сосудистой стенки.
Катионные белки адсорбируются на негативно заряженной мембране бактерий и других клеток благодаря своему положительному заряду. Встраивание этих неферментативных белков в мембрану клеток вызывает образование нерегулируемых ионных каналов, через которые в клетки проникают кальций, натрий и вода, что ведет к их набуханию, активации протеиназ и фосфолипаз, разрушению и гибели клеток.
Эозинофильные цитотоксические белки фиксируются преимущественно на наружной оболочке гельминтов, опсонизированной IgE, что приводит к ее повреждению. Это делает эозинофилы главным средством борьбы с гельминтами и одновременно фактором воспаления при гельминтозе.
Эйкозаноиды, как и АКР, образуются заново в процессе воспалительной реакции из ПНЖК, входящих в состав клеточных мембран. Преобладание в рационе, а следовательно, и в клеточных мембранах ω-6-ПНЖК (арахидоновой и линолевой) обусловливает избыточное образование при повреждении тканей сильных провоспалительных факторов — лейкотриена B4 и тромбоксана A2, а также проста-гландинов ПГЕ2, ПГF2α. В то же время достаточное количество в рационе ω-3-ПНЖК способствует образованию ПГI3, оказывающего выраженное противовоспалительное действие, лейкотриена B5 и тромбоксана A3 — слабых провоспалительных факторов.
Фактор активации тромбоцитов является 1-алкил-2-ацетилглицерил-3-фосфорилхолином, образующимся из ацетил-лизофосфатидилхолина мембран нейтрофилов, моноцитов, эндотелиоцитов, тучных клеток и тромбоцитов под влиянием эндотоксина бактерий, тромбина, ангиотензина II, гистамина, брадикинина, ИЛ-1, ФНО-α. ФАТ в свою очередь стимулирует синтез цитокинов, кининов, NO. Он акгивирует фосфолипазу С, что приводит к образованию диацилглицерола, который посредством дегрануляции тромбоцитов стимулирует их адгезию и агрегацию, активирует гранулоциты, способствует продукции АКР и повреждению клеточных мембран, что усиливает приток в цитоплазму Са2+. Диацилглицерол и Ca2+ активируют фосфолипазу A2, в результате чего из фосфолипидов мембран высвобождается арахидоновая кислота с образованием провоспалительных эйкозаноидов. При этом тромбоксан A2 суживает и тромбирует сосуды, в том числе и венечные, лейкотриен B4 вызывает бронхоспазм и эмиграцию нейтрофилов, а ПГI2 может обусловить вазодилатацию. ФАТ в 100—10 000 раз сильнее, чем гистамин, повышает проницаемость сосудов микроциркуляторного русла и является самым мощным активатором тромбоцитов и нейтрофилов.
Цитокины — низкомолекулярные белки или гликопептиды, секретируемые клетками крови, стромы и иммунной системы. Они оказывают паракринное и аутокринное регулирующее воздействие на рост, развитие и функцию клеток-мишеней посредством специфических рецепторов, экспрессию которых клетки в определенной степени могут контролировать. Важнейшими цитокинами являются факторы некроза опухолей, интерлейкины, хемокины, интерфероны и факторы роста.
ФИО-α (кахексия) продуцируется различными типами клеток, в том числе моноцитами-макрофагами, лимфоцитами, опухолевыми клетками и адипоцитами. В низких концентрациях он стимулирует синтез и экспрессию молекул клеточной адгезии на эндотелиоцитах, что обеспечивает адгезию к ним нейтрофилов. ФНО-α повышает фагоцитарную активность нейтрофилов и макрофагов, усиливает синтез лимфокинов хелперными T-лимфоцитами и стимулирует пролиферацию В-лимфоцитов. В высоких концентрациях ФНО-α вызывает внутри-сосудистый тромбоз и некроз опухолевой ткани, усиливает продукцию ИЛ-1, ИЛ-6, простагландинов, что может привести к развитию шока, блокирует тирозинкиназную активность инсулиновых рецепторов мышечных и печеночных клеток, обусловливая их инсулинорезистентность.
ФИО-β (лимфотоксин) вырабатывается акгивированными T-лимфоцитами. Главная его функция — индукция апоптоза клеток-мишеней.
Интерлейкины, хемокины и интерфероны рассматриваются далее при изложении эмиграции лейкоцитов и фагоцитоза, а значение факторов роста анализируется при рассмотрении процессов пролиферации и репарации.
Гуморальные медиаторы воспаления представлены в основном кининами и системой комплемента.
Кинины — группа вазоактивных полипептидов, образующихся в результате каскада биохимических реакций, которые начинаются с активации сериновой протеиназы — фактора Xaгeмана (XII фактор свертывающей системы крови). Столкновение с поврежденной поверхностью или изменение внутренней среды (температуры, pH) приводит к тому, что этот фактор становится активным и действует на прекалликреин, являющийся неактивной протеиназой, которая содержится в плазме крови, превращая его в активный фермент калликреин. Последний в свою очередь действует на α2-глобулины (кининоген), отщепляя от них полипептидную цепь, состоящую из 9 (брадикинин) или 10 (каллидин) аминокислотных остатков. Кинины плазмы крови оказывают непосредственное влияние на тонус и проницаемость сосудистой стенки, обусловливая расширение артериол и повышая проницаемость стенки капилляров. Кроме того, они вызывают типичные для воспаления зуд и боль. Медиаторы калликреин-кининовой системы при воспалении влияют на реологические свойства крови, ее способность к свертыванию и фибринолизу. На схеме 9 показано, как активированный фактор Хагемана инициирует процессы кининобразования, гемокоагуляции и фибринолиза. Выпадение нитей фибрина и образование тромбов в очаге воспаления определенным образом связаны с состоянием калликреин-кининовой системы.

Еще один важный медиатор воспаления гуморального происхождения — комплемент, представляющий собой каскадную систему протеиназ. Известно, что комплемент является защитным фактором организма, однако вместе с тем он может вызывать повреждение собственных тканей, наблюдающееся при воспалении, особенно иммунном. Это объясняется тем, что фрагменты комплемента С3а и С5а активируют выброс медиаторов из тучных клеток и образование лейкоцитами АКР, которые повреждают как микроорганизмы, так и собственные клетки. Фрагмент С5b способен фиксироваться на сенсибилизированных и несенсибили-зированных антителами клетках, образовывать мембранатакующий комплекс С5b6789, который разрушает мембраны и осуществляет лизис поврежденных клеток. Фрагмент С5а усиливает хемо?
