Роль лизосомальных ферментов при воспалении
Значение лизосом в патологии столь многогранно и существенно, что в настоящее время трудно представить патологический процесс, в который не был бы вовлечен лизосомальный аппарат клетки. Следует выделить два аспекта этой проблемы. Во-первых, вовлечение лизосом в развитие таких общих патологических процессов, как воспаление и некроз и в этом случае участие лизосом является одним из проявлений их нормальной защитной функции организма в ответ на возникновение очага инфекции. Однако развитие ряда патологий связано с нарушением структуры и функции самих лизосом. Нарушения в лизосомах являются первичным, пусковым звеном в развитии двух типов патологических процессов. Для первого из них характерно повреждение лизосомальных мембран. Каковы же обстоятельства, способствующие возникновению патологической дестабилизации лизосомальной мембраны, ведущей к выходу в клеточный матрикс кислых гидролаз? Установлено, что проницаемость лизосомальных мембран значительно увеличивается при гипоксии (недостаток кислорода), изменении кислотно-щелочного равновесия, после травм и хирургических вмешательств, голодании, при заболеваниях суставов и инфекционных заболеваниях, воздействии ионизирующей радиации и некоторых химических агентов. Последнее нашло практическое применение, в частности направленное повреждающее воздействие некоторых фармакологических агентов и ионизирующей радиации на мембраны лизосом опухолевых клеток используется при лекарственной и радиотерапии онкологических заболеваний. Из патологических состояний, связанных с повреждением лизосомальных мембран и высвобождением гидролаз, наиболее изучены болезни суставов — острый и ревматоидный артриты, подагра. При этих заболеваниях, в результате воздействия лизосомальных ферментов, наблюдается эрозия хрящей и деструкция суставов Показано, что аналогичные изменения могут быть получены у экспериментальных животных при введении в область сустава, веществ, обладающих дестабилизирующим действием на лизосомальные мембраны, например стрептолизина S. Наоборот, вещества, стабилизирующие лизосомальные мембраны (к ним относятся многие противовоспалительные препараты, например, глюкокортикостероид — кортизон), значительно уменьшают воспалительную реакцию.
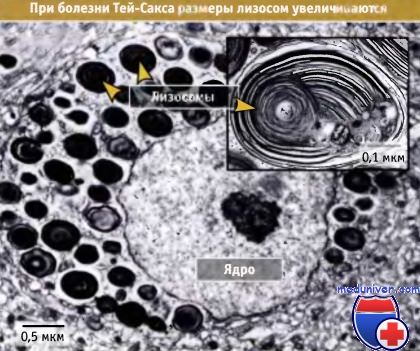
К другой, сравнительно редкой группе заболеваний обусловленных нарушением функции лизосом, относят врожденные генетические нарушения в системе синтеза лизосомальных ферментов. Эти нарушения приводит к развитию так называемых лизосомальных болезней накопления. Такие болезни вызываются, главным образом, мутацией в гене, кодирующем ту или иную гидролазу, что выражается либо в полном подавлении синтеза ферментного белка, либо в синтезе белковых молекул обладающих резко сниженной биокаталитической активностью. Кроме этого генетически обусловленными могут быть нарушения при которых ферментный белок синтезируется без сигнальных участков и по этой причине не распознается транспортной системой. В результате блокируется его доставка из аппарата Гольджи в лизосомы. Нерасщепленный субстрат такой гидролазы накапливается в лизосомах, что приводит к переполнению клеток разбухшими лизосомами, клетки приобретают пенистый вид (пенистые клетки), утрачивают вследствие этого свои функциональные свойства и в конечном результате погибают, что ведет к развитию тяжелых заболеваний (напр. болезнь Тей-Сакса, Гоше, Нимана-Пика и др.), заканчивающихся во многих случаях смертельным исходом в детском возрасте.
Источник
Работами последних лет показана большая роль лизосом в катаболитических процессах в клетке. Имеющиеся в лизосомах гидролитические ферменты (кислая фосфатаза, кислая ДНК-аза, РНК-аза, арилсульфатаза, протеазы, глюкуронидазы и др.) способны расщеплять важнейшие химические соединения, включая белки, нуклеиновые кислоты и полисахариды; благодаря этому они могут переваривать различные органоиды клетки. Многие авторы нашли увеличение активности ферментов лизосом в отмирающих клетках различных дегенерирующих и некротизирующихся тканей. Поскольку, как показали наши морфологические исследования, дегенерация и некроз происходят во многих соматических тканях нерестующей горбуши, представляет интерес изучить роль изменения активности лизосомальных ферментов в механизмах генетически обусловленной гибели клеток утих тканей.
Совместно с В. А. Рассказовым и А. И. Парсницкой мы изучили изменения активности кислой фосфатазы и кислой ДНК-азы в тканях и органах горбуши в разные периоды ее нереста. В печени, почках и селезенке горбуши установлено наличие связанной активности кислой фосфатазы, которая после разрушения лизосом (десятикратного замораживания и оттаивания) заметно возрастает. При этом особенно резко активность кислой фосфатазы увеличивается как у самок, так и у самцов в почке. В селезенке и печени горбуши активность увеличивается в меньшей степени. В ходе нереста горбуши общая, свободная и связанная активность кислой фосфатазы также значительно изменяется. Процесс увеличения общего количества кислой фосфатазы сопровождается резким возрастанием свободной кислой фосфатазы и снижением количества связанной кислой фосфатазы. Наиболее ярко это выражено в почке горбуши.
В речной период нерестовой миграции на фоне незначительного увеличения общей активности (в 1.2 раза у самок и в 2 раза у самцов) наблюдается возрастание свободной активности кислой фосфатазы (в 2 раза у самок и в 2.9 раза у самцов) и резкое снижение количества связанной активности кислой фосфатазы (в 3 раза у самок и в 1.5 раза у самцов). В почке отнерестившейся горбуши общая активность кислой фосфатазы увеличивается в 3.6 раза у самцов и в 2.5 раза у самок, свободная активность — в 3 раза у самцов и в 2 раза у самок. Связанная активность кислой фосфатазы исчезает. В печени нерестующей горбуши увеличение общей активности кислой фосфатазы (в 2.5 раза у самцов и в 2 раза у самок) также сопровождается увеличением ее свободной активности (в 1.8 раза у самцов и в 1.5 раза у самок) и исчезновением связанной активности кислой фосфатазы. В селезенке увеличение общей и свободной активности, сопровождающееся уменьшением количества связанной, выражено менее четко.

Активность ДНК-азы II в тканях отнерестившейся горбуши значительно возрастает у самцов и самок в мышцах (в 4 и 3 раза соответственно), в кишечнике (в 2.5 и 3 раза), в печени (в 1.7 и 3.1 раза), в селезенке (в 2 и 2.3 раза). В почке увеличения активности ДНК-азы не происходит.
Полученные нами результаты дают основание говорить о том, что у рыб, в частности у горбуши, кислая фосфатаза и ДНК-аза II, по-видимому, находятся в лизосомах или лизосомоподобных органоидах, которые в процессе нереста или разрушаются, пли изменяются таким образом, что увеличивается проницаемость их мембран. Увеличение активности кислой фосфатазы и ДНК-азы II в тканях нерестующей горбуши можно также связать с их инфильтрацией лейкоцитами, богатыми лизосомоподобными частицами. Значительное увеличение свободной кислой фосфатазы вместе с исчезновением связанной активности свидетельствует больше в пользу увеличения проницаемости оболочек лизосом или их разрушения в процессе нереста, чем в пользу инфильтрации лейкоцитами. Параллелизм между разрушением клеток и резким увеличением общей и свободной активности изученных ферментов свидетельствует о том, что состояние лизосом каким-то образом связано с механизмами генетически обусловленной гибели клеток соматических тканей горбуши, хотя характер этой связи остается невыясненным.
Интересно отметить, что гибель клеток при старении, так же как и генетически обусловленная гибель соматических клеток горбуши, сопровождается усилением активности многих лизосомальных ферментов: ДНК-азы и РНК-азы в гомогенате и фракции митохондрий печени крыс, кислой ДНК-азы в тимусе, селезенке, печени, почках крыс, арилсульфатазы в печени крыс, катепсина, кислой фосфатазы, арилсульфатазы в печени человека. Бьёкеруд, Бьёритори и Шерстей прямо говорят о том, что увеличение активности лизосомальных ферментов может быть ответственно за возрастную инволюцию организма.
— Читать далее «Нуклеиновые клетки стареющих клеток. Матричная активность старых клеток»
Оглавление темы «Представления о старении. Теории старения»:
1. Внутриклеточные пигменты и гибель клеток. Механизмы гибели неделящихся соматических клеток
2. Причины старения соматических клеток. Морфология неделящихся клеток
3. Старение клеток печени. Морфология клеток печени в различные периоды жизни
4. Лизосомальные ферменты. Роль лизосом в старении клеток
5. Нуклеиновые клетки стареющих клеток. Матричная активность старых клеток
6. Триптофанпирролаза. Роль триптофанпирролазы в старении
7. Нуклеиновые кислоты как фактор долголетия. Влияние нуклеиновых кислот на клетки
8. Фармакодинамика нуклеиновых кислот. Влияние ДНК на долголетие
9. Эффекты нуклеиновых кислот. Воздействие ДНК и РНК на клетки и организм
10. Эволюционная теория старения. Теории старения Вейсмана и Комфорта
Источник
• Протеазы:
эластазы, коллагеназы, катепсины B,
D,G,
F;
• Гидролазы
гликозидов: β-глюкуронидаза, лизоцим,
нейраминидаза;
• Гидролазы эфиров:
ДНКаза;
• Гидролазы
липидов: фосфолипаза А1
и А2,
холестеролэстеразы;
• Другие ферменты:
кислая фосфатаза.
Ферменты эндоплазматического ретикулума
Таблица 4.1.2
Ферменты
эндоплазматического ретикулума и их
локализация
Ферменты | Локализация |
Ферменты | гладкий |
ферменты | гладкий |
Ферменты, локализованные в цитозоле
• Метаболизм
углеводов: ферменты гликолиза, включая,
фосфорилазу, киназу фосфорилазы,
протеинкиназу, гликогенсинтаза,
фосфоенолпируват-карбоксикиназа,
ферменты пентозо-фосфатного пути,
малатдегидрогеназа, изоцитратдегидрогеназа;
• Обмен липидов:
ацетил-СоА-карбоксилаза, комплекс
синтазы жирных кислот;
• Обмен аминокислот
и белков: аспартатаминотрансфераза,
аланинаминотрансфераза, аргиназа,
аминоацил-т-РНК-синтетазы;
• Синтез нуклеотидов:
нуклеозидкиназа, нуклеотидкиназа.
Мембранные ферменты
• Периферические
белки (легко экстрагируется из мембраны
солевым раствором).
• Интегральные
белки с небольшой частью полипептидной
цепи, закреплённой в мембране.
• Интегральный
белок с небольшой частью полипептидной
цепи, внедрённой в бислой.
• Интегральный
белок, пронизывающий липидный бислой,
(ионные трансферазы, такие как
Na,K-АТРаза,Са2+
-АТРаза).
• Белок, присоединённый
к мембране за счёт второго белка, который
находится в бислое (рис.4.3.2).
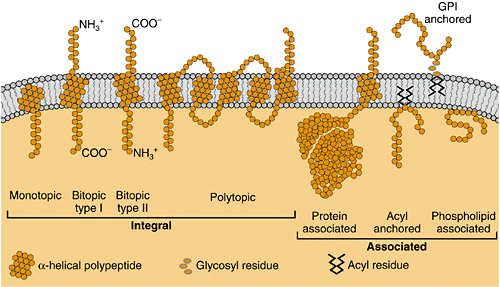
Рис. 4.1.2. Мембранные
ферменты
Уровни структурной организации ферментов в клетке
В клетке есть
ферменты разной структурной организации
– от простых мономерных до ферментов,
объединенных в ферментные ансамбли.
Ферменты по их структурной организации
можно разделить на:
1.
Мономерные
ферменты;
2. Олигомерные
ферменты (простые, построенные из
субъединиц одного типа);
3. Олигомерные
ферменты (сложные, построенные из
субъединиц разного типа);
4. Ферментные
комплексы : а) мультиферментные комплексы,
б)
мультиферментные конъюгаты;
5. Ферментные
ансамбли: а) адсорбционные,
б)
интегральные.
Значения
молекулярных масс ферментов колеблются
в широких пределах: от нескольких тысяч
до нескольких миллионов. В природе
насчитывается несколько десятков
ферментов, обладающих сравнительно
небольшими молекулами (до 50 кДа).
Большинство же ферментов представлено
белками более высокой молекулярной
массы, построенными из субъединиц
(рис.4.1.3).

a
б
в
г
Рис. 4.1.3. Модели
строения некоторых олигомерных ферментов:
а ‒ молекула глутаматдегидрогеназы,
состоящая из 6 протомеров; б ‒ молекула
РНК-полимеразы; в ‒ половина молекулы
каталазы; г ‒ молекулярный комплекс
пируватдегидрогеназы.
Так,
каталаза (252 кДа) содержит в молекуле
шесть протомеров с молекулярной массой
42 кДа каждый. Молекула фермента,
ускоряющего реакцию синтеза рибонуклеиновых
кислот (РНК-полимераза, 400 кДа), состоит
из 6 неравных субъединиц. Полная молекула
глутаматдегидрогеназы, ускоряющей
процесс окисления глутаминовой кислоты
(336 кДа), построена из 6 субъединиц с
молекулярной массой 56 кДа.
Процесс олигомеризации
придает субъединицам белков повышенную
стабильность. Связи в комплексе в
основном нековалентные, поэтому такие
ферменты легко диссоциируют на протомеры.
Способы
компоновки протомеров в мультимеры
разнообразны. Крайне важно, что достроенный
из субъединиц фермент проявляет
максимальную каталитическую активность
именно в виде мультимера: диссоциация
на протомеры резко снижает активность
фермента. Не все ферменты-мультимеры
построены исключительно из каталитически
активных протомеров. Наряду с
каталитическими в их составе отмечены
регуляторные субъединицы, как, например,
у аспартат-карбамоилтрансферазы.
Среди
ферментов-мультимеров безусловно
преобладают димеры и тетрамеры (их
несколько сотен), в меньшей мере
распространены гексамеры и октамеры
(несколько десятков) и необыкновенно
редко встречаются тримеры и пентамеры.
Молекулы
ферментов-мультимеров в ряде случаев
составлены из субъединиц двух типов,
обозначаемых условно как субъединицы
типа А
и В.
Они сходны друг с другом, но отличаются
по некоторым деталям первичной и
третичной структур. В зависимости от
соотношения протомеров типа А
и В
в мультимере последний может существовать
в виде нескольких изомеров, которые
называют изозимами. Так, при четырех
субъединицах возможны 5 изозимов:
IIIIIIIVV
AAAAAAABAABBABBBBBBB
В
настоящее время интерес к изозимам
резко повысился. Оказалось, что кроме
генетически детерминированных изозимов
существует большая группа ферментов,
обладающая множественными формами,
возникающими в результате их
посттрансляционной модификации.
Множественные формы ферментов и изозимы
в частности используются сейчас для
диагностики болезней в медицине,
прогнозирования продуктивности животных
подбора родительских пар при скрещивании
для обеспечения максимального гетерозиса
в потомстве и т. п. (более детально эти
вопросы рассмотрены в лекции 5.2).
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
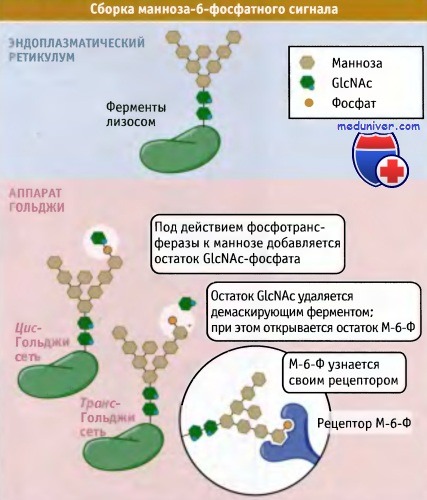
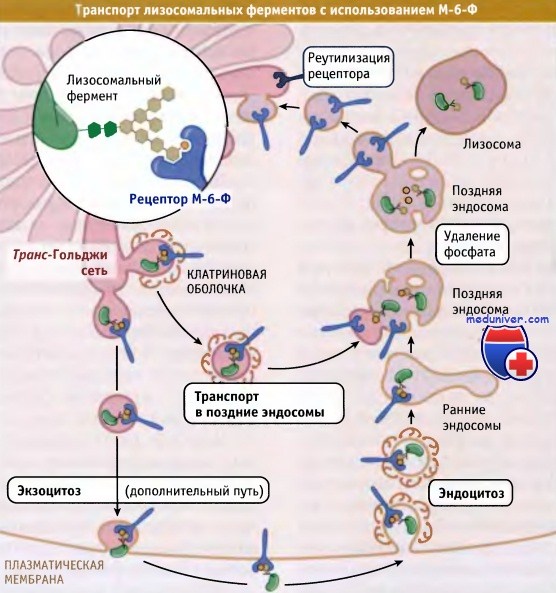
Транспорт и сортировка лизосомальных ферментов в транс-Гольджи• Все вновь синтезированные мембранные и секреторные белки следуют по одному транспортному пути до достижения транс-Гольджи сети, где они распределяются в различные транспортные везикулы, в соответствии с местом своего назначения • Клатриновые везикулы транспортируют лизосомальные белки из транс-Гольджи сети в созревающие эндосомы • В аппарате Гольджи к растворимым ферментам, предназначенным для лизосом, ковалентно присоединяется манноза-6-фосфат. Из транс-Гольджи сети эти ферменты выходят на путь эндоцитоза при участии рецептора манноза-6-фосфата • Белки лизосомальных мембран транспортируются из транс-Гольджи сети в созревающие эндосомы, однако для этого используются другие сигналы, чем для растворимых ферментов лизосом Так же как и другие белки, предназначенные для перемещения по механизму эндо- и экзоцитоза, белки лизосом синтезируются в ЭПР. Растворимые ферменты деградации и трансмембранные белки лизосом транспортируются из ЭПР через аппарат Гольджи в транс-Гольджи сеть, где они отделяются от белков клеточной поверхности и от белков другой внутриклеточной локализации. В клетках млекопитающих для сортировки растворимых ферментов лизосом в транс-Гольджи сети необходим сигнал, отличающийся от сигналов сортировки цитоплазматических белков, которые рассматривались до сих пор. В данном случае сигнал лизосомальной сортировки называется маннозо-6-фосфатный сигнал (М-6-Ф). Он образуется в люмене при модификации олигосахаридов, ковалентно присоединенных к лизосомаль-ным ферментам. Этот сигнал был обнаружен при изучении некоторых заболеваний, связанных с нарушениями функционирования лизосом, например при болезни 1-клеток (также называемой муколипидоз II типа). В лизосомах больных, страдающих этим заболеванием, отсутствуют необходимые ферменты, и вместо поступления в лизосомы ферменты экскретируются во внеклеточное пространство. Поэтому в лизосомах накапливаются непереваренные белки, образующие характерные внутриклеточные включения (называемые «I» при болезни 1-клеток). Аналогичные включения обнаруживаются и при других болезнях накопления, например при болезни Тей-Сакса, при которой в клетке отсутствует фермент гексозаминидаза А.
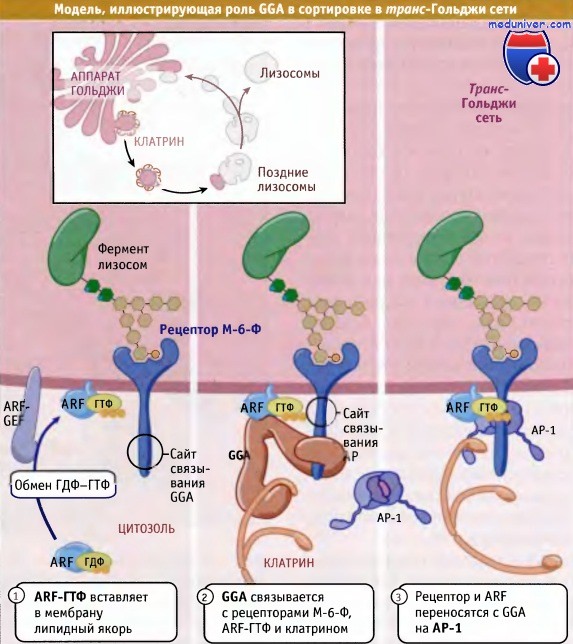
Сигнал М-6-Ф образуется в результате фосфорилирования N-терминального маннозного остатка. Как показано на рисунке ниже, N-ацетилглюкозаминфосфат (G1cNAc-P) добавляется к С-6-гидроксильной группе избранного терминального маннозного остатка при участии фермента фосфотрансферазы (при болезни 1-клеток большинство ферментов лизосом не получают М-6-Ф сигнала, поскольку фосфотрансфераза у них отсутствует). Скорее всего, остаток G1cNAc-P добавляется на ранних этапах нахождения белка в аппарате Гольджи. Затем специальный фермент, который присутствует в транс-Гольджи сети, удаляет остаток G1cNAc, открывая группу М-6-Ф. Таким образом, сигнал сортировки появляется только тогда, когда начинается сам процесс сортировки. Конечно, для многих белков, транспортируемых по механизму экзоцитоза, характерно присутствие олигосахаридов с высоким содержанием маннозы, причем эти белки не являются ферментами лизосом. Поэтому, наряду с М-6-Ф сигналом сортировки, также должна существовать другая информация, специфичная только для лизосомальных ферментов. Эта информация не заложена в линейной последовательности аминокислот, как в случае многих других сигналов сортировки, а находится в определенном участке молекулы лизосомального фермента. М-6-Ф сигнал сортировки узнается рецепторами М-6-Ф (существует два типа этих рецепторов), которые локализованы в транс-Гольджи сети. Цитоплазматические участки обоих типов рецепторов содержат сигналы сортировки, обеспечивающие транспорт в эндосомы. Один из них представляет собой тирозиновый сигнал, он может узнаваться АР-1 клатриновым адаптерным комплексом, расположенным в транс-Гольджи сети. Другой сигнал, расположенный на цитоплазматической части М-6-Ф рецептора, содержит два остатка лейцина, находящихся в окружении кислых аминокислот. Этот сигнал отличается от таких же сигналов, обеспечивающих захват белков с клеточной поверхности, и взаимодействует с GGA-белком. GGA относится к семейству белков, названных так потому, что они локализуются в аппарате Гольджи, содержат последовательности гомологичные дополнительному домену у-адаптина, и связываются с фактором АДФ-рибозилирования. Предполагается, что белки GGA являются упаковочными молекулами, которые помогают загружать М-6-Ф-рецепторы, связанные с лизосомальными ферментами, в клатриновые везикулы, отпочковывающиеся от транс-Гольджи сети. По-видимому, GGA передают М-6-Ф-рецептор и клатрин на комплекс АР-1, присутствующий в образовавшейся везикуле. Как показано на рисунке ниже, образующиеся в транс-Гольджи сети клатриновые везикулы, вероятно, направляются в поздние эндосомы, где происходит диссоциация М-6-Ф-рецептора и связанного с ним фермента, подобно тому, как это осуществляется для комплекса рецептор-лиганд при эндоцитозе. Доставка фермента из транс-Гольджи сети в ранние эндосомы также может происходить более редким путем — через клеточную поверхность. Эндосомы обладают более кислой средой, чем транс-Гольджи сеть, и при кислых pH ферменты отщепляются от М-6-Ф-рецеп-торов, что приводит к накоплению свободных ферментов в люмене эндосом. Затем М-6-Ф-рецепторы рециклируют из эндосом в транс-Гольджи сеть и повторно участвуют в транспортном процессе. При рециклировании используется другой адаптерный белок, TIP47, который узнает другой сигнал сортировки (содержащий фенилаланин/триптофан или остатки гидрофобных аминокислот) в цитоплазматическом участке М-6-Ф-рецептора. TIP47 отличается от других известных адаптеров тем, что он концентрирует в образующихся везикулах, которые возвращают М-6-Ф-рецепторы в транс-Гольджи сеть, белок Rab9. Rab9 участвует в дальнейшем адресовании этих везикул.
Транспорт растворимых лизосомальных ферментов в эндосомы по механизму экзоцитоза представляет собой часть обычного процесса их созревания. Пока лизосомальные ферменты не достигнут конечного места назначения, они защищены от воздействия ферментов деградации. Существуют, по крайней мере, три механизма, которые обеспечивают активность ферментов только в определенных компартментах: • Лизосомальные ферменты не проявляют активности при pH, характерном для ЭПР и аппарата Гольджи, и активируются только при кислых значениях pH, свойственных эндосомам и лизосомам. Таким образом, кислое значение pH в эндосомах не только благоприятствует диссоциации М-6-Ф-рецепторов, но и существенно для активации фермента. • Некоторые лизосомальные ферменты образуются в ЭПР в виде проферментов, в N-терминальной области которых находится короткая последовательность, ингибирующая их активность. Ингибирование сохраняется до тех пор, пока последовательность не отщепится в эндосомах. Нередко отщепление носит «аутокаталитический» характер, т. е. определенная протеаза активируется самостоятельно, при достижении органеллы с достаточно низкой величиной pH. • Некоторые активирующие ферменты представляют собой фосфатазы, которые расщепляют М-6-Ф-сигналы сортировки. Удаление этих сигналов помогает ограничить выход в транс-Гольджи сеть активных ферментов лизосом за счет предотвращения их связывания с рециклирующими М-6-Ф-рецепторами. Все эти события созревания начинаются на уровне поздних эндосом, при вступлении фермента на путь эндоцитоза. При последующем продвижении ферментов в лизосомы скорость протекания и эффективность этих событий увеличиваются. Начиная от ранних эндосом и до лизосом происходит постепенное снижение величины pH: от 6,5-6,8 до 4,5-5,0. Поскольку для большинства лизосомальных ферментов оптимальное значение pH составляет < 5, то по мере продвижения по пути эндоцитоза они постепенно увеличивают активность. Резидентные белки мембран лизосом, например лизосомальные гликопротеины (lgps) и лизосомальные мембранные белки (lamps), транспортируются из транс-Гольджи сети по механизму, независимому от М-6-Ф. В цитоплазматическом домене этих белков присутствуют тирозин-содержащие сигналы, которые определяют их взаимодействие с одним или несколькими адаптерными комплексами (АР-1 или АР-3) или с GGA-белками. В эндосомы эти белки доставляются из транс-Гольджи сети, вероятно, посредством клатриновых везикул, и накапливаются в лизосомах. В отличие от М-6-Ф-рецепторов они не рециклируют в транс-Гольджи сети, поскольку, вероятно, не способны реагировать с TIP47. Хотя большинство мембранных белков подвергаются в лизосомах деградации, белки lgp и lamp устойчивы к протеолизу. Они содержат много гликозильных групп, и считается, что последние либо образуют некое защитное покрытие, либо обладают плотной упаковкой, которая обеспечивает устойчивость к ферментам. Сортировка лизосомальных белков у дрожжей и в клетках млекопитающих происходит различным образом. У дрожжей органеллы, эквивалентные лизосомам, называются вакуоли. В них также содержится набор растворимых гидролитических ферментов, которые поступают туда с участием мембранных рецепторов. Однако транспорт из транс-Гольджи сети в вакуоли не требует узнавания маркера М-6-Ф и происходит без участия М-6-Ф рецепторов, для которых у дрожжей не существует гомологов. Природа сигналов, которые обеспечивают адресование растворимых ферментов в дрожжевые вакуоли, неизвестна, однако не исключено, что ферменты связываются с рецептором на мембране. Генетический анализ позволяет предполагать, что этот рецептор может взаимодействовать с GGA-белками, что свидетельствует о консерватизме, свойственном стратегии сортировки. Подобно белкам мембран лизосом у животных, транспорт белков мембран вакуолей из аппарата Гольджи происходит у дрожжей с участием клатриновых адаптеров (например АР-3). Однако у дрожжей АР-3 может взаимодействовать с сигналом, содержащим остатки двух лейцинов, а не тирозина.
— Также рекомендуем «Сортировка белка в поляризованных клетках эпителия» Оглавление темы «Физиология и биология клетки»:
|
Источник