Роль интерлейкинов в воспалении
Интерлейкин 6, интерлейкин 8 и хемокины. Роли интерлейкина 6, интерлейкина 8 и хемокинов при воспалении.Интерлейкин 6 (IL-6) является мультифункциональным цитокином, который продуцируют как лимфоидные, так и нелимфоидные клетки и который регулирует иммунный ответ, острофазный воспалительный ответ и гемопоэз. Рецепторы для 1L-6 обнаруживаются и на лимфоидных, и на нелимфоидных клетках. Одной из основных функций IL-6 является регуляция процессов созревания антителопродуцирующих клеток из В-лимфоцитов и самой продукции иммуноглобулинов. IL-6 участвует также в активации Т-лимфоцитов. Не менее существенный вклад вносит IL-6 в регуляцию синтеза острофазных белков, сопутствующего воспалению. Биосинтез острофазных белков геиатоцитами регулируется всей группой провоспалительных цитокинов, но IL-6 отводится особая роль «гепатоцит-активирующего фактора». IL-6 может индуцировать синтез многих острофазных белков: фибриногена, al-антихимотрипсина, al-кислого гликопротеина, гаптоглобина, сывороточного амилоида A, CRP, a1-антитрипсина и а2-макроглобулина. Продукция альбумина при этом снижается. При развитии острой фазы воспаления уровень IL-6 в сыворотке крови коррелирует с уровнем CRP и с уровнем лихорадки у больного. Повышение уровня IL-6 в сыворотке крови может предшествовать подъему уровня CRP. Между провоспалительными цитокинами, для которых характерны синергидные эффекты, существуют достаточно сложные взаимнорегули-рующие отношения. В частности, IL-6 ингибирует продукцию IL-1 и TNFa, которые являются оба активными индукторами синтеза IL-6. Кроме того, IL-6 через гипоталамус-гипофизарное регуляторное звено усиливает продукцию кортизола, который, в свою очередь, действует на клетки печени, усиливая индукцию 1L-6 острофазных белков, но ингибирует экспрессию гена IL-6, как и генов других провоспалительных цитокинов.
Интерлейкин 8 и хемокиныВсе современные цитокины, основной биологической функцией которых является хемоаттрактантная активность, объединены под названием хемокины, а по структуре разделены на два семейства. Первое, с последовательностью С-Х-С, представлено прежде всего IL-8 и PF4, а также другими, менее изученными: GROa, GROp, GROy, NAP-2, ENA-78, IP-10 и GCP-2. Основными представителями второго семейства с последовательностью С-С являются МСР-1, MIP-1 и RANTES. Источниками хемокинов являются большинство клеток периферической крови и тканей. Основные биологические эффекты хемокинов связаны с их хемоаттрактантной активностью. Однако некоторые цитокины в отношении различных клеток-мишеней обладают и другими эффектами, связанными с активацией этих клеток. Еще задолго до открытия IL-8 у альвеолярных макрофагов была обнаружена способность продуцировать хемоаттрактант для нейтрофилов. В последние годы установлено, что эти наблюдения связаны преимущественно с IL-8. Так, у больных идиопатическим фиброзом легких была обнаружена повышенная экспрессия mRNA для IL-8, что коррелировало с содержанием IL-8, числом нейтрофилов в БАЖ и с тяжестью заболевания. Аналогичные наблюдения имеются в отношении МСР-1, который экспрессируется макрофагами, эпителиальными, эндотелиальными и гладкомышечными клетками легких. Высокий уровень IL-8 в легких обнаружен при остром воспалении. У больных респираторным дистресс-синдромом содержание IL-8, количество нейтрофилов коррелировало со смертностью. При муковисцидозе нейтрофильная эластаза, присутствующая в БАЖ, индуцирует продукцию IL-8 эпителиальными клетками бронхов. Хемокины также являются медиаторами аллергического воспаления. У больных БА наблюдается повышенная экспрессия IL-8 эпителиальными клетками бронхов, а повышенное наличие GM-CSF, IL-3 и IL-5 повышает чувствительность базофилов и эозинофилов больных БА к С-Х-С и С-С хемокинам. — Также рекомендуем «Интерлейкин 10, 4. Роли интерлейкина 10 и 4 при воспалении.» Оглавление темы «Воспаление легких.»: |
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июля 2019;
проверки требуют 3 правки.
Цитокины — небольшие пептидные информационные молекулы.
Цитокины имеют молекулярную массу, не превышающую 30 кD.
Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом, от клетки А к клетке В передается сигнал, который запускает в клетке В дальнейшие реакции.
Их основными продуцентами являются лимфоциты.
Кроме лимфоцитов их секретируют макрофаги, гранулоциты, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Термин предложен Стэнли Коэном (англ. S. Cohen) в 1974 г.[1]
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
- провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
- противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
- регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины — антигеннеспецифические факторы, поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники:[2] например, Интерлейкин 1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
См. также[править | править код]
- Фактор некроза опухоли (ФНО, англ. TNF)
- Остеопонтин
Примечания[править | править код]
Ссылки[править | править код]
- Научно-практический журнал «Цитокины и Воспаление»
- Цитокины — причина парадонтита (недоступная ссылка)
- Все о цитокинах — Иммунинфо
Источник
Ãëàâà 37
Ðîëü öèòîêèíîâ, ëèìôîêèíîâ, èíòåðëåéêèíîâ â ðåãóëÿöèè àêòèâíîñòè èììóííîé ñèñòåìû
Äëÿ âñåõ ôîðì èììóííîãî îòâåòà òðåáóåòñÿ ñîãëàñîâàííîå âçàèìîäåéñòâèå îñíîâíûõ ôàêòîðîâ èììóííîé ñèñòåìû: ìàêðîôàãîâ, Â-ëèìôîöèòîâ, Ò-ëèìôîöèòîâ, NK-êëåòîê, íóëåâûõ êëåòîê (Ê-êëåòîê), ñèñòåìû êîìïëåìåíòà, èíòåðôåðîíîâ, ãëàâíîé ñèñòåìû ãèñòîñîâìåñòèìîñòè, à òàêæå àíòèòåë. Âçàèìîäåéñòâèå ìåæäó íèìè îñóùåñòâëÿåòñÿ ñ ïîìîùüþ ðàçíîîáðàçíûõ ñèíòåçèðóåìûõ è ñåêðåòèðóåìûõ ìåäèàòîðîâ. Âñå èììóíîêîìïåòåíòíûå êëåòêè íåñóò íà ñâîèõ ìåìáðàíàõ óíèêàëüíûå ðåöåïòîðû, ñ ïîìîùüþ êîòîðûõ îíè ðàñïîçíàþò è âîñïðèíèìàþò ñèãíàëû îò äðóãèõ èììóííûõ êëåòîê, ïåðåñòðàèâàþò ñâîé ìåòàáîëèçì, ñèíòåçèðóþò èëè óñòðàíÿþò ñâîè ñîáñòâåííûå ðåöåïòîðû. Áëàãîäàðÿ ýòèì õèìè÷åñêèì ñèãíàëàì-ìåäèàòîðàì âñå êëåòêè èììóííîé ñèñòåìû ôóíêöèîíèðóþò êàê õîðîøî îòëàæåííûé ñèìôîíè÷åñêèé îðêåñòð, â êîòîðîì â êà÷åñòâå äèðèæåðîâ ïîñòîÿííî âûñòóïàþò òî îäíà, òî äðóãàÿ, à ÷àùå âñåãî îäíîâðåìåííî íåñêîëüêî åå ÷àñòåé. Áëàãîäàðÿ ïðÿìîé è îáðàòíîé ñâÿçè ìåæäó ðàçëè÷íûìè ñóáïîïóëÿöèÿìè êëåòîê èììóííîé ñèñòåìû, îñóùåñòâëÿåìîé êàê ïóòåì ïðÿìîãî êîíòàêòà, òàê è ÷åðåç ðàçëè÷íûå ôàêòîðû àêòèâàöèè, ïðîëèôåðàöèè, äèôôåðåíöèàöèè è ïðåçåíòàöèè (ïðåäñòàâëåíèÿ), îáåñïå÷èâàåòñÿ óñòîé÷èâûé ìåõàíèçì ñàìîðåãóëÿöèè âñåé èììóííîé ñèñòåìû. Ìåäèàòîðû, âûðàáàòûâàåìûå êëåòêàìè èììóííîé ñèñòåìû è ó÷àñòâóþùèå â ðåãóëÿöèè åå àêòèâíîñòè, ïîëó÷èëè îáùåå íàçâàíèå öèòîêèíîâ (ãðå÷. kytos êëåòêà, kineo ïðèâîäèòü â äâèæåíèå). Èõ ïîäðàçäåëÿþò íà ìîíîêèíû ìåäèàòîðû, ïðîäóöèðóåìûå ìîíîöèòàìè è ìàêðîôàãàìè, è ëèìôîêèíû ìåäèàòîðû, ñåêðåòèðóåìûå àêòèâèðîâàííûìè ëèìôîöèòàìè. Ëèìôîêèíû ïðåäñòàâëÿþò ñîáîé áåëêè è ïåïòèäû, íå îòíîñÿùèåñÿ ê èììóíîãëîáóëèíàì. Äëÿ òåõ ëèìôîêèíîâ, êîòîðûå õèìè÷åñêè èäåíòèôèöèðîâàíû è ïîëó÷åíû â ÷èñòîì âèäå, â 1979 ã. áûëî ïðåäëîæåíî íàçâàíèå èíòåðëåéêèíîâ, îíè îáîçíà÷àþòñÿ íîìåðàìè 1 20.
Èíòåðëåéêèíû ñåìåéñòâî áèîëîãè÷åñêè àêòèâíûõ ãîðìîíîïîäîáíûõ áåëêîâûõ ìîëåêóë, ðàçëè÷íûõ ïî ñòðóêòóðå è ôóíêöèÿì, êîòîðûå ó÷àñòâóþò â ðåãóëÿöèè èììóíèòåòà è âîñïàëèòåëüíûõ ïðîöåññîâ.  îòëè÷èå îò àíòèòåë èõ ñòðóêòóðà íå îïðåäåëÿåòñÿ ñòðóêòóðîé àíòèãåíà, èíäóöèðóþùåãî èõ ñèíòåç è ñåêðåöèþ. Ñèíòåç èíòåðëåéêèíîâ ïîáóæäàåòñÿ äåéñòâèåì íå òîëüêî àíòèãåíîâ, íî è äðóãèõ ôàêòîðîâ, â òîì ÷èñëå è ñàìèõ èíòåðëåéêèíîâ. Îíè ñèíòåçèðóþòñÿ ïðè ðàçëè÷íûõ èììóííûõ îòâåòàõ, èíôåêöèîííûõ ïðîöåññàõ, ïîâðåæäåíèè òêàíåé.
Âñå èíòåðëåéêèíû ïîëèôóíêöèîíàëüíû, à èõ äåéñòâèå îïîñðåäóåòñÿ ðàçëè÷íûìè êëåòî÷íûìè ïîâåðõíîñòíûìè ðåöåïòîðàìè. Íàèáîëåå ïîëíî èçó÷åíû ñëåäóþùèå èíòåðëåéêèíû.
Èíòåðëåéêèí-1 (IL-1). Áåëîê ñ ìîëåêóëÿðíîé ìàññîé 17,5 êÄ, ñèíòåçèðóåòñÿ ìàêðîôàãàìè, ìîíîöèòàìè, äåíäðèòíûìè, ýíäîòåëèàëüíûìè è ýïèòåëèàëüíûìè êëåòêàìè, NK-êëåòêàìè, ôèáðîáëàñòàìè, àñòðîöèòàìè. IL-1 ÿâëÿåòñÿ ôàêòîðîì àêòèâàöèè ëèìôîöèòîâ, êîôàêòîðîì ðîñòà è ñîçðåâàíèÿ Ò è Â-ëèìôîöèòîâ. Àêòèâèðóåò Ò è Â-ëèìôîöèòû, NK-êëåòêè, âûçûâàåò õåìîòàêñèñ ìàêðîôàãîâ, íåéòðîôèëîâ è ëèìôîöèòîâ, îáëàäàåò ïèðîãåííûì äåéñòâèåì. IL-1 èíäóöèðóåò ñèíòåç IL-2, IL-4, IL-6, ?-èíòåðôåðîíà, ýêñïðåññèþ ðåöåïòîðîâ IL-2. Ñóùåñòâóåò äâà âàðèàíòà èíòåðëåéêèíà-1 IL-1? è IL-1?; îíè êîäèðóþòñÿ ðàçíûìè ãåíàìè. Ñèíòåç IL-1 èíäóöèðóåòñÿ ËÏÑ, ìèòîãåíàìè, à òàêæå íåéðî è èììóíîïåïòèäàìè.
Èíòåðëåéêèí-2 (IL-2). Áåëîê ñ ìîëåêóëÿðíîé ìàññîé 15 êÄ. Ñèíòåçèðóåòñÿ òîëüêî àêòèâèðîâàííûìè Ò-êëåòêàìè, ñòèìóëèðóåò ðîñò è ñîçðåâàíèå àêòèâèðîâàííûõ Ò-êëåòîê è îáðàçîâàíèå èìè ëèìôîêèíîâ; ñòèìóëèðóåò àêòèâíîñòü Ò-öèòîòîêñè÷åñêèõ êëåòîê, NK-êëåòîê, ìîíîöèòîâ. ßâëÿåòñÿ êîôàêòîðîì ïðîëèôåðàöèè Â-ëèìôîöèòîâ, ñòèìóëèðóåò èõ ñîçðåâàíèå è çàùèùàåò êëåòêè îò àïîïòîçà.
Èíòåðëåéêèí-3 (IL-3). Ñèíòåçèðóåòñÿ àêòèâèðîâàííûìè Ò-êëåòêàìè. Ó ìûøåé èìååò ìîëåêóëÿðíóþ ìàññó 28 êÄ (ó ÷åëîâåêà îíà íå îïðåäåëåíà). IL-3 ñòèìóëèðóåò ðîñò ïîëèïîòåíòíûõ ñòâîëîâûõ êðîâåòâîðíûõ êëåòîê è èõ ñïåöèàëèçèðîâàííûõ ïîòîìêîâ. Ñòèìóëèðóåò «äûõàòåëüíûé âçðûâ» ôàãîöèòèðóþùèõ êëåòîê; íåîáõîäèì äëÿ ïîääåðæàíèÿ ðîñòà êëåòîê-ïðåäøåñòâåííèêîâ Â-ëèìôîöèòîâ è ìàñòîöèòîâ.
Èíòåðëåéêèí-4 (IL-4). Áåëîê, ó ìûøåé ñ ìîëåêóëÿðíîé ìàññîé 15 20 êÄ. Ñèíòåçèðóåòñÿ è âûäåëÿåòñÿ àêòèâèðîâàííûìè Ò-êëåòêàìè, ìàñòîöèòàìè, ëèíèåé Â-ëèìôîöèòîâ, ñëóæèò êîôàêòîðîì ñòèìóëÿöèè àíòèòåëîîáðàçîâàíèÿ; ÿâëÿåòñÿ ôàêòîðîì ðîñòà Ò-ëèìôîöèòîâ, ñòèìóëèðóåò àíòèãåíïðåäñòàâëÿþùèå ôóíêöèè ìàêðîôàãîâ è Â-ëèìôîöèòîâ, à òàêæå ÿâëÿåòñÿ ôàêòîðîì ðîñòà äëÿ ïðåäøåñòâåííèêîâ êðîâåòâîðíûõ êëåòîê.
Èíòåðëåéêèí-5 (IL-5). Áåëîê, ó ìûøåé ñ ìîëåêóëÿðíîé ìàññîé 45 60 êÄ. Ñèíòåçèðóåòñÿ Ò-êëåòêàìè. ßâëÿåòñÿ ôàêòîðîì, çàìåíÿþùèì Ò-õåëïåðíûå êëåòêè. Ñòèìóëèðóåò ïðîëèôåðàöèþ àêòèâèðîâàííûõ Â-ëèìôîöèòîâ è èõ ñîçðåâàíèå, à òàêæå ñåêðåöèþ àíòèòåë, ñòèìóëèðóåò ðîñò è ñîçðåâàíèå Ò-öèòîòîêñè÷åñêèõ ëèìôîöèòîâ, ðîñò è ñîçðåâàíèå ýîçèíîôèëîâ.
Èíòåðëåéêèí-6 (IL-6). Áåëîê ñ ìîëåêóëÿðíîé ìàññîé ó ÷åëîâåêà 19 34 êÄ. Ñèíòåçèðóåòñÿ Ò-ëèìôîöèòàìè, ìàêðîôàãàìè, ìîíîöèòàìè, ôèáðîáëàñòàìè, íåêîòîðûìè îïóõîëåâûìè êëåòêàìè, à òàêæå ãèáðèäîìàìè. ßâëÿåòñÿ ôàêòîðîì ðîñòà ïëàçìîöèòmîì è ãèáðèämîì. Ñòèìóëèðóåò îáðàçîâàíèå àíòèòåë Â-ëèìôîöèòàìè, ñèíòåç ìîëåêóë ÌÍÑ êëàññà I íà ôèáðîáëàñòàõ, ñèíòåç íåêîòîðûõ áåëêîâ êëåòêàìè ïå÷åíè, ÿâëÿåòñÿ êîôàêòîðîì ñòèìóëÿöèè ðîñòà Ò-ëèìôîöèòîâ.
Èíòåðëåéêèí-7 (IL-7). Èäåíòèôèöèðîâàí êàê ôàêòîð, ïîääåðæèâàþùèé ðîñò ïðå-Â-ëèìôîöèòîâ, ïîýòîìó ïîëó÷èë íàçâàíèå ëèìôîïîýòèíà 1. Áåëîê ñ ìîëåêóëÿðíîé ìàññîé ó ìûøåé 25 êÄ.
Èíòåðëåéêèí-8 (IL-8). Èäåíòèôèöèðîâàí êàê ãðàíóëîöèòíûé õåìîòàêñè÷åñêèé ôàêòîð. Ñòèìóëèðóåò àêòèâíîñòü íåéòðîôèëîâ. Áåëîê ñ ì. ì. 8,8 êÄ. Îñíîâíûå ïðîäóöåíòû ëèìôîèäíûå è ìàêðîôàãàëüíûå êëåòêè. Åãî ñèíòåç èíäóöèðóþò áàêòåðèàëüíûå àíòèãåíû, IL-1, ôàêòîð íåêðîçà îïóõîëåé.
Îñîáûé èíòåðåñ ñðåäè èíòåðëåéêèíîâ ïðåäñòàâëÿåò òàê íàçûâàåìûé íåéðîëåéêèí, èñïîëüçóåìûé íåðâíîé è èììóííîé ñèñòåìàìè. Íåéðîëåéêèí ïðîäóöèðóþò àêòèâèðîâàííûå Ò-ëèìôîöèòû; ÿâëÿÿñü ìåäèàòîðîì òðîôè÷åñêîé ñâÿçè ÷åðåç íåðâíî-ìûøå÷íûé ñèíàïñ, îí ñòèìóëèðóåò äèôôåðåíöèðîâêó Â-ëèìôîöèòîâ â àíòèòåëîîáðàçóþùèå êëåòêè, ò. å. âåäåò ñåáÿ êàê èíòåðëåéêèí. Ïî-âèäèìîìó, ñåìåéñòâî èíòåðëåéêèíîâ áóäåò ïîïîëíÿòüñÿ íîâûìè ïðåäñòàâèòåëÿìè, ñðåäè êîòîðûõ ìîãóò îêàçàòüñÿ ìåäèàòîðû, îïîñðåäóþùèå âçàèìîäåéñòâèå è âçàèìîðåãóëÿöèþ èììóííîé, íåðâíîé è ýíäîêðèííîé ñèñòåì.
 ïîñëåäíèå ãîäû óñòàíîâëåíî, ÷òî IL-1 ïðîäóöèðóþò íåéðîíû ãîëîâíîãî ìîçãà, ïåðèôåðè÷åñêèå ñèìïàòè÷åñêèå íåéðîíû è íîðàäðåíåðãè÷åñêèå êëåòêè ìîçãîâîãî âåùåñòâà íàäïî÷å÷íèêîâ. Îí àêòèâèðóåò ãèïîòàëàìî-ãèïîôèçàðíî-àäðåíîêîðòèêîòðîïíóþ ñèñòåìó è, ïî-âèäèìîìó, ñïîñîáåí èçìåíÿòü àêòèâíîñòü ðàçëè÷íûõ íåéðîãóìîðàëüíûõ ôàêòîðîâ.
Источник

Анафилаксия — это жизнеугрожающая аллергическая реакция, которая зависит от высокоаффинного к ней аллергенспецифического IgE. Гоутаман и соавторы продемонстрировали, что новый интерлейкин (ИЛ-13), который экспрессируется субпопуляцией Т-хелперов (Tfh), специфически стимулирует ответную реакцию при участии IgE. Данное открытие дает потенциальную возможность в применении новых стратегий для лечения аллергии.
Атопические и аллергические заболевания влияют на миллионы людей в США, а их рост за последние 30–40 лет носит эпидемический характер. Аллергические реакции могут приводить к анафилаксии — жизнеугрожающей форме аллергического иммунного ответа, при котором возможно резкое снижение артериального давления и нарушение функций органов. Пищевая аллергия, особенно на арахисовые белки, часто сопровождается анафилактическими реакциями.
Во время фазы инициации аллергической иммунной реакции Т-хелперы продуцируют интерлейкин-4 (ИЛ-4), что в свою очередь активирует выработку В-клетками антиген-специфических антител IgE. Затем большинство IgE прочно связывается Fcε-рецепторами тучных клеток. IgE с низким аффинитетом к белковому аллергену не способны спровоцировать активацию тучных клеток и вызвать анафилаксию (рис. 1А). Однако взаимодействие белков аллергена с высокоаффинными аллерген-специфическими IgE на поверхности тучных клеток способствует сшиванию Fce-рецепторов, запускающему каскад сигналов. Это приводит к дегрануляции тучных клеток и высвобождению медиаторов воспаления, которые образуются заранее и хранятся в виде гранул в цитоплазме. К ним относятся гистамин, протеазы, цитокины, хемокины (рис. 1Б). Выброс медиаторов воспаления во время системного ответа приводит к тяжелой аллергической реакции.
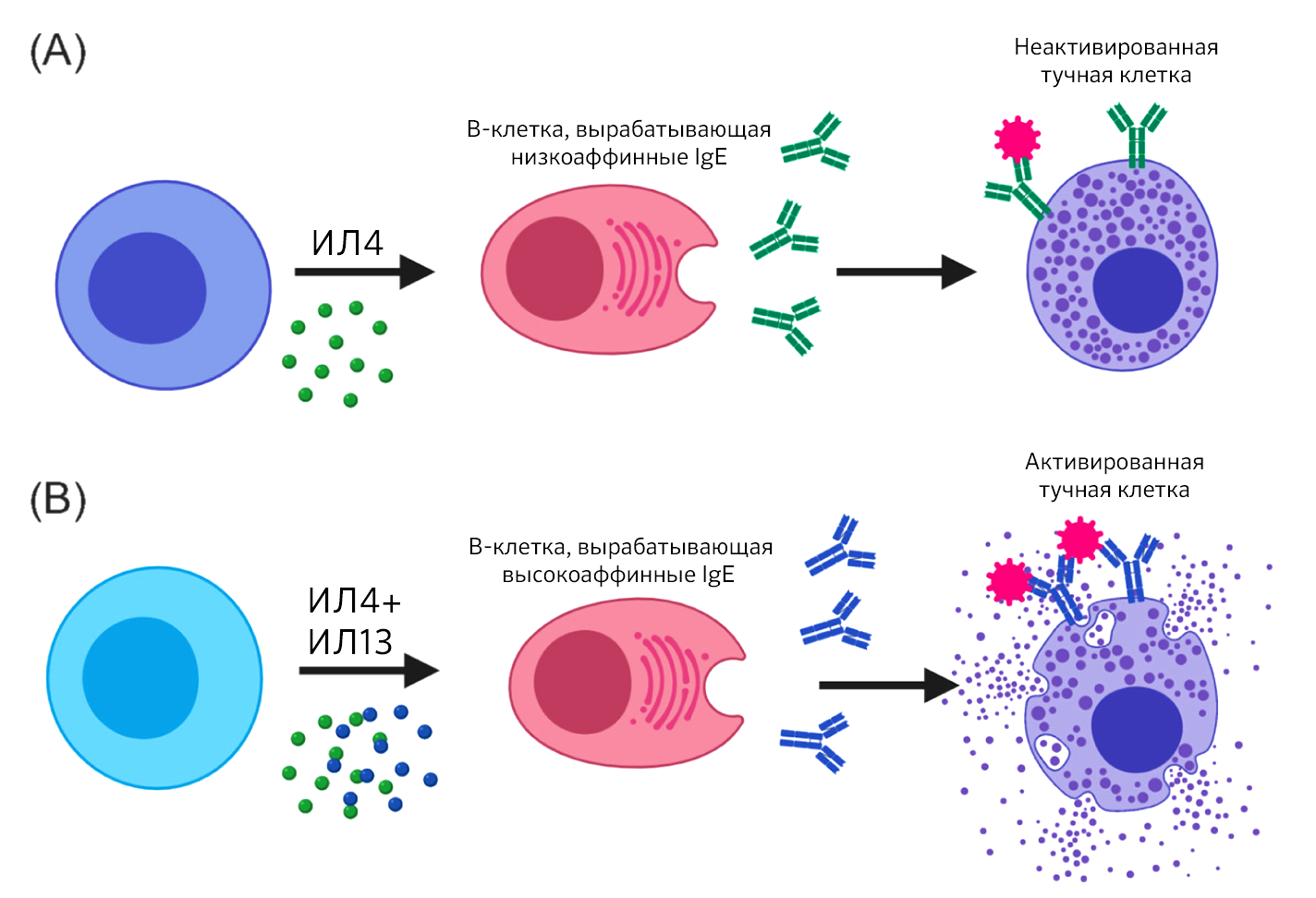
Гоутаман и соавторы показывают, как Tfh2 помогают В-клеткам продуцировать низкоаффинные IgE посредством секреции ИЛ-4 (А), в то время как Tfh13 помогают В-клеткам вырабатывать высокоаффинные IgE посредством секреции ИЛ-4 и ИЛ-13 (Б).
Недавние исследования показали, что в культуре клеток, взятой из герминативного центра лимфоидной ткани, специализированные фолликулярные Т-хелперы, продуцирующие ИЛ-4, необходимы для выработки IgE активированными В-клетками. Данное открытие расширило представление ученых о механизмах, которые контролируют развитие аллергии. Несмотря на то, что ключевым звеном в анафилактическом ответе является IgE, имеющий сродство к аллергену, вопрос о том, каким образом он образуется в герминативном центре, остался неясным. В настоящее время, исследователи из Йельского университета и Лаборатории медицинской геномики Джексона под руководством Стефани Айзенбарт обнаружили особый интерлейкин-13 (ИЛ-13), который продуцируется Т-хелперами, ответственными за индукцию выработки IgE. Данный интерлейкин может способствовать развитию анафилактических реакций. Это открытие проливает новый свет на диагностику и, возможно, лечение опасных для жизни аллергий.
Известно, что пациенты с дефектами гена цитокина-8 (DOCK8) обычно страдают от гипер-IgE-синдрома, тяжелых аллергий и астмы. Гоутаман вместе с командой начали свое исследование путем характеристики аллергического ответа у мышей, которые имели дефект DOCK8 в Т-клетках. Они заметили, что фенотип гипер-IgE-синдрома был найден у мышей после первой иммунизации, при котором не должна была происходить активация выработки IgE. Эти результаты показали, что фенотип гипер-IgE-синдрома с недостатком цитокина-8 развивался при помощи Т-клеток. Затем с помощью пассивной анафилаксии авторы показали, что IgE от мышей с T-DOCK8 ^-/- способствовали ее развитию. Тем не менее, частота и общее количество Т-клеток, которые необходимы для продукции IgE, были сопоставимы с количеством у мышей с T-DOCK8 ^-/- и диких мышей. В связи с этим авторами был произведен более детальный анализ Т-клеток у мышей с T-DOCK8 ^-/-, в результате которого они обнаружили новую субпопуляцию Т-клеток (Tfh13), которые экспрессировали ИЛ-13. В отличие от Tfh , Tfh13 действуют вне герминативного центра. Гоутаман и его команда обнаружили Tfh13 у диких мышей без мутаций, у которых была индуцирована аллергия дыхательных путей или пищевая аллергия. Это отразило связь Tfh13 с развитием аллергических болезней. Важно отметить, что в момент активности Tfh13 уровень высокоаффинных IgE увеличивался, что опосредовало анафилаксию у диких мышей.
Используя секвенирование одноцепочечной РНК, авторы показали, что Tfh13 являются уникальным клетками, отличными от Tfh и Th2, но в то же время имеющими некоторые свойства, характерные для них. В отличие от обычных Tfh, Tfh13 экспрессируют главный фактор транскрипции Th2-клеток — Gata3, а также продуцируют три цитокина, характерных для Th2: ИЛ-5, ИЛ-4 и ИЛ-13. Tfh13 также экспрессируют главный фактор транскрипции Tfh, Bcl6, который вызывает репрессию Gata3 и транскрипцию генов Th2, отвечающих за выработку цитокинов. Tfh13, вероятно, поддерживают баланс между достаточным количеством Bcl для стимулирования фенотипа Tfh и количеством Gata3 для транскрипции цитокинов Th2. Однако важный вопрос о том, как развиваются Tfh13, остается все еще без ответа. Отличаются ли Tfh13 от Th2, или от обычных Tfh при действии сильной поляризации на Th2, или непосредственно от CD4 T-клеток?
Команда Гоутамана показала, что Tfh13 были необходимы для выработки высокоафинных IgE и, предположительно, ИЛ-4, производимых субпопуляцией Tfh-клеток, называемых Tfh2, которые способствовали выработке низкоаффинных IgE (рис. 1А). Дальнейшая работа показала, что для выработки анафилактических IgE необходим ИЛ-13, вырабатываемый Tfh13 (рис. 1Б). Учёные также имели намерения спроецировать данные результаты на людей, поскольку они обнаружили более высокий уровень Tfh13 среди циркулирующих Tfh у пациентов с повышенным уровнем специфического арахисового IgE. Эти выводы помогли устранить давнее несоответствие между иммунологией человека и мыши, когда было известно, что ИЛ-13 запускает выработку IgE в человеческих B-клетках, но не запускает в мышиных. Для подтверждения роли ИЛ-13, команда Гоутамана продемонстрировала субпопуляцию активированных мышиных B-клеток в герминативном центре, которые экспрессировали рецепторы к ИЛ-13 и могли бы индуцировать выработку IgE в присутствии ИЛ-13.
Ученые также заметили, что уровень высокоаффинных IgE был значительно выше в случае с T-DOCK8 ^-/- мышами, в то время как уровень IgG1+ клеток памяти с высоким сродством был ниже по сравнению с контрольной группой. Как показали недавние исследования, плазматические клетки, продуцирующие высокоаффинные IgE, могут дифференциироваться в IgG1+ клетки памяти при повторном воздействии аллергенов. Снижение уровня высокоаффинных IgG1+ в случае с T-DOCK8 ^-/- мышами указывает на то, что Tfh13 провоцируют IgG1+ клетки памяти превращаться в плазматические клетки, секретирующие IgE. Ключевой вопрос заключается в том, какую роль играет ИЛ-13, производимый Tfh13 клетками, в превращении IgG1+ клеток памяти в плазматические клетки. Однако вопрос о том, превращаются ли высокоафинные IgG1+ клетки памяти в плазмоциты, не изучался. Если IgG1+ клетки памяти имеют повышенную экспрессию рецепторов к ИЛ-13, то это может быть механизмом данного селективного ответа
Интересно, что гельминтные инфекции не индуцировали выработку высокоаффинных IgE Tfh13, хотя развивались сильные ответы Th2. Таким образом, клеточные ответы Th2 не всегда коррелируют с клеточными ответами Th13. Каковы механизмы и почему гельминтные инфекции отличаются от аллергических реакций с точки зрения индукции клеток Tfh13? Решение данного вопроса поможет нам лучше понять аллергии, а также разработать специфическую терапию для различных Th2-опосредованных заболеваний, таких как астма и атопический дерматит.
В настоящее время, единственное лечение, которое может предотвратить дегрануляцию тучных клеток, приводящую к анафилактическому шоку, включает в себя неспецифическую терапию снижения уровня IgE с использованием омализумаба. Это моноклональное антитело, которое ингибирует связывание IgE с тучными клетками. Методы лечения, в основе которых лежит специфическое подавление выработки IgE, могут стать альтернативной терапевтической стратегией для борьбы с аллергическими реакциями и анафилаксией. Поскольку Tfh13 экспрессируют высокие уровни GATA3, использование ДНК-фермента, расщепляющего Gata3, с последующим подавлением Tfh13 и выработки IgE, может иметь терапевтическую пользу при сильной аллергии.
Авторы отметили, что клинические испытания ДНК-фермента показали эффективность в уменьшении эозинофилии, но о подавлении Tfh13 или IgE ничего не известно.
В конечном счете, понимание механизма стимулирования В-клеток для получения высокоаффинного IgE при атопическом заболевании является клинически важной областью иммунологического исследования. Айзенбарт и его коллеги сделали прорыв в этом важном вопросе, раскрыв, как новая популяция Т-клеток, Tfh13, важна в отношении выработки IgE. Эти выводы положили основу для более глубокого понимания регуляции выработки IgE и анафилаксии, а также обеспечили возможность создания более точной иммунотерапии атопических заболеваний.
Источник