Роль циклических нуклеотидов в воспалении

Циклические нуклеотиды – это нуклеотиды, в молекулах которых остаток фосфорной кислоты, связываясь с углеродными атомами рибозы в 5″ и 3″ положениях, образует кольцо. Одним из представителей циклических неклеотидов является цАМФ(3’,5’-аденозинмонофосфат).
 Циклический 3″,5″-аденозинмонофосфат (цАМФ)
Циклический 3″,5″-аденозинмонофосфат (цАМФ)
6.1. Циклический AMФ синтезируется аденилатциклазой и расщепляется фосфодиэстеразой
цАМФ образуется из АТФ под действием мембранного фермента аденилатциклазы:
Эта реакция в небольшой степени эндергонична. Источником энергии для синтеза цАМФ служит последующий гидролиз пирофосфата. Специфическая фосфодиэстераза разрушает цАМФ путем гидролиза до AMФ:
6.2. АМФ служит вторым посредником при действии многих гормонов
Работа Эрла Сазерленда , по выяснению механизма действия адреналина и глюкагона га распад гликогена и образование глюкозы, привела к созданию концепции о роли цАМФ как второго посредника в механизме действия некоторых гормонов. Первым посредником является сам гормон. Сущность этой концепции заключается в следующем.
1.Плазматические мембраны клеток содержат рецепторы гормонов.
2. Взаимодействие гормона с его специфическим рецептором на плазматической мембране ведет к стимуляции аденилатциклазы, также связанной с плазматической мембраной.
3.В результате активации аденилатци клазы в клетке увеличивается содержание цАМФ.
4. Действие цАМФ проявляется внутри клетки и состоит в изменении скорости одного или более процессов.
Важная особенность этой гипотезы второго посредника состоит в том, что она не предполагает проникновения гормона в клетку.
Действие самого гормона ограничивается клеточной мембраной. Биологический эффект гормона опосредован действием цАМФ внутри клетки; непосредственного действия сам гормон не оказывает. Обоснованность этой концепции была проверена с использованием целого ряда экспериментальных критериев, а именно:
1. Аденилатциклазу клетки должны стимулировать те гормоны, которые дествуют на эту клетку как на мишень. Гормоны, не вызывающие специфического биологического ответа данной клетки, не должны повышать в ней активности этого фермента.
2. Концентрация цАМФ в клетках-мишенях должна изменяться пропорционально биологическому ответу этих клеток на гормональную стимуляцию, т.е. она должна проявлять временную и количественную зависимость от концентрации гормона.
Ингибиторы фосфодиэстеразы, например теофиллин или кофеин, должны действовать синергично с теми гормонами, эффект которых опосредован вторым посредником.
4. Добавление цАМФ или родственного ему соединения к клеткам-мишеням должно имитировать биологическое действие гормона. (На практике цАМФ в таких опытах не используется, так как он плохо проникает в клетки; однако менее полярные производные цАМФ, в частности дибутирил- цАМФ, проникают в клетки и оказывают свое действие.)
Проведенные опыты показали, что циклический AMP является вторым посредником при действии не только адреналина и глюкагона, но и многих других гормонов. цАМФ оказывает влияние на исключительно большое число клеточных процессов. Так, под действием этого соединения увеличивается распад накопленных запасов топливных веществ, повышается выделение соляной кислоты слизистой желудка, происходит дисперсия пигментных гранул меланина, уменьшается агрегация тромбоцитов.
Источник
Циклические нуклеотиды, нуклеотиды, в молекулах которых остаток фосфорной кислоты, связываясь с углеродными атомами рибозы в 5′ и 3′ положениях, образует кольцо; универсальные регуляторы биохимических процессов в живых клетках.
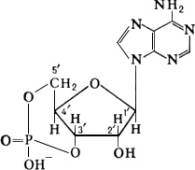
Циклический 3′,5′-аденозинмонофосфат (цАМФ)
Наиболее изучен циклический 3′, 5′-аденозинмонофосфат (цАМФ) — белый порошок, хорошо растворимый в воде. цАМФ открыт в 1957 американским биохимиком Э. Сазерлендом с сотрудниками при исследовании механизма активации фермента фосфорилазы печени гормонами глюкагоном и адреналином. В тканях животных и человека цАМФ служит посредником в осуществлении многообразных функций различных гормонов и др. биологически активных соединений (некоторых медиаторов, токсинов, лактинов). У бактерий при недостатке в среде легкоусвояемых соединений, например глюкозы, увеличивается содержание цАМФ в клетке, что приводит к биосинтезу адаптивных (индуцируемых) ферментов, необходимых для усвоения др. источников питания. Уровень цАМФ в клетках сальмонеллы Salmonella thyphimurium определяет будущее попавшего в неё фага (при высокой концентрации цАМФ происходит лизогенизация культуры бактерий, при низкой — фаг вызывает её лизис). У миксоамёбы Dictyostelium discoideum цАМФ играет роль аттрактанта, привлекающего клетки друг к другу. У высших растений цАМФ опосредует влияние фитохрома на синтез пигментов бетационинов (у Amaranthus paniculatus).
Концентрация цАМФ в тканях млекопитающих очень мала и составляет десятые доли микромоля на 1 кг сырой ткани (10-7—10-6моль). При активации аденилатциклазы, катализирующей биосинтез цАМФ, или блокировании фосфодиэстеразы, осуществляющей гидролиз этого нуклеотида, концентрация цАМФ в клетке быстро увеличивается. Т. о., содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый «посредник») и цАМФ (второй «посредник») осуществляет т. н. аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, во многих случаях активизирует аденилатциклазу, которая катализирует биосинтез цАМФ. Концентрация цАМФ, образующегося т. о. в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цАМФ в тканях животных и человека лежит его взаимодействие с протеинкиназами — ферментами, активность которых проявляется в присутствии этого нуклеотида (см. схему). Связывание цАМФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в т. ч. ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. Например, при действии адреналина на клетки печени происходит фосфорилирование двух ферментов — фосфорилазы и гликогенсинтетазы. Фосфорилаза при этом активируется, что приводит к быстрому гидролизу гликогена — запасного вещества печени. Одновременно с началом гидролиза гликогена прекращается его новый синтез, т.к. фермент, участвующий в его образовании, — гликогенсинтетаза при фосфорилировании его протеинкиназами теряет свою активность. Один и тот же гормон, действуя через посредство цАМФ, в разных тканях вызывает различные функциональные ответы, зависящие от особенностей данной ткани. При стрессе, когда потребность в энергии очень велика, мозговой слой надпочечников в повышенном количестве образует гормон адреналин. В печени адреналин обусловливает активное расщепление (фосфоролиз) гликогена, образование фосфорных эфиров глюкозы и выброс в кровь большого количества глюкозы, в жировой ткани — приводит к гидролизу липидов, достигнув сердца, — увеличивает силу сокращения сердечной мышцы, усиливает кровообращение и улучшает питание тканей, осуществляя мобилизацию всех сил организма. цАМФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др. Некоторые медиаторы, например ацетилхолин, могут ускорять образование др. Ц. н. — 3′,5′-гуанозинмонофосфата (цГМФ), который синтезируется в клетке из гуанозинтрифосфата при активации фермента гуанилатциклазы, входящей в гуанилатциклазный комплекс, расположенный в клеточной мембране. Характерно, что многие эффекты цГМФ прямо противоположны эффектам цАМФ. Антагонистические отношения Ц. н. проявляются чаще всего в сложных системах, когда для регуляции клеточной функции требуется разновременная модификация многих белков, осуществляемая согласованным действием попеременно активируемых цАМФ- и цГМФ-зависимых протеинкиназ. У бактерий цАМФ, соединившись с неферментным рецепторным белком, присоединяется к ДНК и позволяет ферменту РНК-полимеразе начать транскрипцию гена, ответственного за синтез индуцируемого фермента (см. Оперон). Т. о., механизм действия цАМФ у бактерий и в тканях животных и человека принципиально различен. Исследования роли Ц. н. в живых клетках — одно из наиболее быстро развивающихся направлений в биохимии, уже внёсшее существенный вклад в понимание механизмов биологической регуляции на молекулярном уровне.
Лит.: Боннер Дж., Гормоны миксомицетов и млекопитающих, в кн.: Молекулы и клетки, пер. с англ., в. 5, М., 1970; Васильев В. Ю., Гуляев Н. Н., Северин Е. С., Циклический аденозинмонофосфат — биологическая роль и механизм действия, «Журнал Всесоюзного химического общества им. Д. И. Менделеева», 1975, т. 20, № 3; Доман Н. Г., Феденко Е. П., Биологическая роль циклического АМФ, «Успехи биологической химии», 1976, т. 17; Федоров Н. А., Циклический гуанозинмонофосфат (цГМФ): метаболизм и его биологическая роль, «Успехи современной биологии», 1976, т. 82, в. 1 (4); Sutherland Е. W., Roil Т. W., The properties of an adenine ribonucleotide produced with cellular particles, ATP, Mg++ and epinephrine or glucagon, «Journal of the American Chemical Society», 1957, v. 79, № 13; Advances in cyclic nucleotide research, v 1—6 N. Y. Amst., 1972—75.
Е. П. Феденко.

Схема механизма действия цАМФ в клетках животных и растений. АТФ — аденозинтрифосфат; АДФ — аденозиндифосфат; фн — фосфат; фф — пирофосфат.
Оглавление
Источник
05.08.2011г.
Циклические нуклеотиды занимают центральное положение в регуляции процессов метаболизма мышечного волокна.
Являясь производными адениловой и гуаниловой кислот, эти соединения имеют рациональные химические названия — циклический 3,5-аденозинмонофосфат (цАМФ) и циклический 3,5-гуанозинмонофосфат (цГМФ); в медицинской литературе их часто обозначают, исходя из их физиологической роли, клеточными медиаторами.
Строение циклических нуклеотидоа

Строение циклических нуклеотидоа: а — цАМФ; б — цГМФ.
Наиболее изучен обмен цАМФ. Содержание этого соединения в клетке зависит от активности двух ферментов — аденилатциклазы (АЦ) и фосфодиэстеразы (ФДЭ). Встроенная в мембрану АЦ катализирует синтез цАМФ из АТФ; ФДЭ осуществляет гидролиз соединения до неактивной формы [Sutherland W. et al., 1968]. В свою очередь влияние нуклеотида на обменные процессы опосредовано через систему протеинкиназ (ПК) и изменения уровня кальция [Cheung W., 1972].
ПК имеет сложное строение и состоит из 2 субъединиц — регуляторной и каталитической. Присоединение цАМФ к регуляторной субъединице приводит к освобождению каталитической, которая путем фосфорилирования ряда ферментов и структурных белков контролирует течение различных физиологических процессов; метаболизм гликогена, жирных кислот, мембранные процессы, связанные с обменом электролитов и прежде всего кальция, работу генетического аппарата клетки и др. [Буларгина Т. В. и др., 1980; Северин Е. С. и др., 1980].
Увеличение концентрации цАМФ при стимуляции симпатической нервной системы ведет к возрастанию активности ПК и запуску каскада биохимических реакций. Соматический отдел нервной системы, по-видимому, оказывает противоположное воздействие на циклазную систему, изменяя сродство ПК и цАМФ.
Согласно данным V. Novak и соавт. (1972), чувствительность ПК к цАМФ из эмбриональных мышц (лишенных соматической иннервации) в 4 — 6 раз выше, чем в зрелых. Одновременно система цАМФ путем фосфорилирования специфических белков сарколеммы обеспечивает активное состояние пассивных ионных каналов [Spereakis N., Sheider К., 1976] и подавляет работу натриевого и кальциевого насосов, т. е. участвует в формировании потенциала действия.
Участие цАМФ в регуляции уровня кальция имеет важное биологическое значение. Кальций служит связывающим звеном между нервным сигналом, инициацией мышечного сокращения и усилением реакций, поставляющих энергию для этого процесса [Fisher Е., 1977]. Регуляцию процессов метаболизма кальций осуществляет изменением активности отдельных ферментов, но главным образом системы цАМФ. Таким образом, эффекты кальция и цАМФ взаимосвязаны.
Система цАМФ ткани мышц

Деполяризация плазмолеммы сопутствует увеличению тока кальция через систему медленных ионных каналов и освобождению иона из участков мышечных мембран. Процесс находится под контролем цАМФ-зависимой ПК. Увеличение количества ионов (в 1,5 — 2 раза) стимулирует активность АЦ, соответственно увеличивает скорость тока и ингибирует работу кальциевого насоса.
Увеличение содержания кальция служит одним из факторов инициации массированного перехода иона в саркоплазму из цистерн саркоплазматического ретикулума, что, однако, ограничивает дальнейшее возрастание уровня цАМФ из-за активации ФД и торможения активности АЦ. Ионы кальция после достижения определенной концентрации устремляются в миофиламенты, где захватываются тропонином [Mayer F. et al., 1970].
Удаление иона кальция из саркоплазмы в цистерны саркоплазматического ретикулума после акта сокращения также зависит от состояния циклазной системы [Fisher Е. et al., 1976]. Выяснено, что саркоплазматический ретикулум обладает АЦ- и ПК-ной активностью и максимум интенсивности фосфорилирования специфических его белков совпадает с пиком поглощения иона кальция.
«Нервно-мышечные болезни»,
Б.М.Гехт, Н.А.Ильина
Читайте далее:
- Роль трофического влияния нервной системы в патогенезе ПМД
- Система кальций — циклические нуклеотиды
Источник
Циклический нуклеотид (cNMP) представляет собой одно- фосфатный нуклеотид с циклическим расположением связей между сахаром и фосфатными группами. Как и в других нуклеотидов, циклические нуклеотиды состоят из трех функциональных групп: сахар, азотистое основание , и один фосфатной группы. Как можно видеть в циклического аденозинмонофосфата (цАМФ) и циклического гуанозинмонофосфата (цГМФ) , рисунки, «циклическую» часть состоит из двух связей между фосфатной группой и 3′ и 5′ гидроксильных групп сахара, очень часто рибоза .
Их биологическое значение включает в себя широкий спектр белка — лиганд взаимодействий. Они были идентифицированы как вторичных мессенджеров в обоих гормонов и ионных каналов передачи сигналов в эукариотических клетках, а также аллостерических эффекторных соединений ДНК — связывающих белков в прокариотических клетках. цАМФа и цГМФа в настоящее время наиболее хорошо документированные циклические нуклеотиды, однако есть свидетельства того, что ЦЩКА ( цитозин ) также участвуют в эукариотических сотовых сообщениях. Роль циклического монофосфата уридина (cUMP) даже менее хорошо известно.
Обнаружение циклических нуклеотидов в значительной степени способствовали пониманию киназы и фосфатазы механизмов, а также регулирования белка в целом. Хотя прошли с момента их первоначального открытия более 50 лет, интерес циклических нуклеотидов и их биохимическое и физиологическое значение продолжаются.
история
Понимание концепции вторичных мессенджеров, и в частности роль циклических нуклеотидов и их способность к релейным физиологические сигналы в клетке , берет свое начало в исследовании гликогена метаболизма Карла и Герти Кори , для которых они были отмечены Нобелевской премия по физиологии и медицине в 1947 году ряд дополнительных , но важных открытий через 1950 добавил к их исследованиям, в первую очередь внимание на активность гликогенфосфорилазы в собачьей печени . Гликогенфосфорилазы катализируют первый шаг в гликогенолизе , процесс разрушения гликогена в его заместителе глюкозы части. Эрл Сазерленд исследовал влияние гормонов адреналина и глюкагона на гликогенфосфорилазы, что принесло ему Нобелевскую премию по физиологии и медицине в 1971 году.
В 1956 году Эдвин Кребс и Эдмон Фишер обнаружил , что аденозинтрифосфат (АТФ) необходим для превращения гликогенфосфорилазы Ь в гликоген фосфорилазы а. При исследовании действия адреналина на гликогенолизе в следующем году, Сазерленд и Вальтер Wosilait сообщили , что неорганический фосфат высвобождается , когда фермент фосфорилаза печени инактивируется; но когда она активирована, она включает в себя фосфат. «Активный фактор» , что гормоны , полученные окончательно очищали в 1958 году, а затем идентифицировали как содержащая рибозу , фосфат, и аденин в равных соотношениях. Кроме того, было доказано , что этот фактор возвращается к 5′-АМФ , когда он был инактивируется.
Евгений Фесенко, Станислав Колесников и Аркадий ЛЮБАРСКИЙ обнаружил , что в 1985 году циклического гуанозинмонофосфата (цГМФ) может инициировать фотоотклик в стержнях . Вскоре после того , роль cNMP в закрытых ионных каналах химиочувствительных ресничек из обонятельных сенсорных нейронов , сообщает Tadashi Nakamura и Джеффри Gold. В 1992 году Лоуренс Хейнс и Кинг-Вай Яу раскрыта роль cNMP в свете зависящих от циклического нуклеотида закрытого канала конуса фоторецепторов . К концу десятилетия, понималось наличие двух типов рецепторов внутримембранных: Rs (который стимулирует циклазу ) и Ri (который ингибирует циклазу). Вэй-Жень Тан и Джеймс Херли сообщили в 1998 году , что аденилатциклаза, который синтезирует цАМФ, регулируется не только гормонов и нейромедиаторов , но также фосфорилированием , кальция , форсколина и гуанин нуклеотидных-связывающих белков ( G белков ).
Химия cNMPs
Состав
Два наиболее хорошо изученных циклических нуклеотидов циклического АМФ (цАМФ) и циклический GMP (цГМФ), в то время циклического CMP (CCMP) и циклического УМЗ (cUMP) менее понятны. цАМФ 3’5′-циклический аденозинмонофосфат, цГМФа являются 3’5′-циклический гуанозинмонофосфат, ЦЩКА является цитидином 3′ , 5′-монофосфат и cUMP является уридином 2′ , 3′-циклический фосфат.
Каждый нуклеотид циклический состоит из трех компонентов. Он содержит азотистое основание (то есть он содержит азот): например, аденин в цАМФ и гуанина в цГМФ. Он также содержит сахар, в частности, пяти- углерода рибозы. И , наконец, циклический нуклеотид содержит фосфат. Двойное кольцо пурина является азотистое основание для цАМФ и цГМФ, в то время как цитозин, тимин и урацил каждый имеет одну кольцевую азотистое основание ( пиримидинового ).
Эти три компонента соединены таким образом, что азотистое основание присоединен к первому атому углерода рибозы (1′ углерода), а фосфатная группа присоединена к 5′-углерода рибозы. В то время как все нуклеотиды имеют такую структуру, фосфатная группа делает второе соединение с рибозы кольцом у атома углерода 3′ в циклических нуклеотидов. Поскольку фосфатная группа имеет две отдельные облигации рибозы сахара, он образует циклическое кольцо.
Атом нумерация обозначение используется для идентификации атомов углерода и атома азота в пределах циклического нуклеотида. В пентозах, углерод ближайший к карбонильной группе обозначена С-1. Когда пентозы соединены с азотистым основанием, нумерация атомов углерода выделяются с штрихом ( ‘) обозначением, которое отличает эти атомы углерода от нумерации атомов азотистого основания.
Таким образом, для цАМФ, 3’5′-циклического аденозинмонофосфата указывает на то, что одна фосфатная группа образует циклическую структуру с группой рибозы на ее 3′ и 5′ атомов углерода, в то время как группа рибозы также присоединена к аденозина (эта связь понимается чтобы быть в положении 1′ рибозы).
биохимия
Циклические нуклеотиды обнаружены в обеих прокариотических и эукариотических клетках. Контроль внутриклеточных концентраций поддерживаются с помощью ряда ферментативных реакций с участием нескольких семейств белков. У высших млекопитающих порядка, cNMPs присутствует во многих типах тканей.
Синтез и деградация
Родовая циклическая реакция биосинтеза нуклеотида по циклазе
Циклические нуклеотиды получают из общей реакции NTP → cNMP + PP я , где N представляет собой азотистое основание. Реакция катализируется специфическими nucleotidyl циклаз, таким образом, что производство цАМФ катализируемых аденилатциклазы и производство цГМФ , катализируемых гуанилатциклазы . Аденилилциклаз был обнаружен в обеих трансмембранных и цитозольной форме, представляющий различные классы белков и различные источники цАМФа.
Родовая реакция гидролиза 3′ cNMP фосфодиэфирной связи с фосфодиэстеразой
Оба цАМФ и цГМФ разлагаются под действием гидролиза из 3′ — фосфодиэфирной св зи , что приводит к 5’NMP. Деградация осуществляется главным классом ферментов , известных как фосфодиэстеразы (ФДЭ). В клетках млекопитающих, существует 11 известные PDE семьи с различной изоформы каждого белка , экспрессированной на основе потребностей регуляторных клетки. Некоторые фосфодиэстеразы являются cNMP специфическими, в то время как другие могут гидролизовать неспецифически. Тем не менее, путей деградации цАМФ и цГМФ намного более понятны , чем те , либо для ЦЩКУ или cUMP. Определение конкретных ФДЭ для ЦЩКИ и cU не так тщательно установлено.
Целевая Binding
Циклические нуклеотиды могут быть найдены во многих различных типах эукариотических клеток, в том числе фото-рецепторных палочек и колбочек, клетки гладких мышц и клетки печени . Клеточные концентрации циклических нуклеотидов могут быть очень низкими, в 10 -7 М диапазона, потому что метаболизм и функция часто локализованы в отдельных частях клетки. Весьма консервативный циклический нуклеотид-связывающий домен (НБЧ) присутствует во всех белках , которые связываются cNMPs, независимо от их биологической функции. Домен состоит из беты — сэндвич архитектуры, с циклическим нуклеотидным связыванием карманы между бета — листами . Связывание cNMP вызывает конформационные изменения , которые влияют на деятельность белка. Существует также данные , чтобы поддержать синергический эффект связывания между несколькими циклическими нуклеотидами, с ЦЩКОЙ снижения эффективной концентрации (EC 50 ) цАМФа для активации протеинкиназы A (PKA).
Биология
Циклические нуклеотиды являются неотъемлемой частью системы связи, которая действует внутри клеток. Они действуют в качестве «вторичных мессенджеров», передавая сигналы многих первых мессенджеров, таких как гормоны и нейромедиаторы, их физиологическим направлениям. Циклические нуклеотиды участвуют во многих физиологических реакций, в том числе рецептор-эффекторной связи, понижающей регуляции отзывчивости наркотиков, белок-киназа каскадов, и трансмембранный сигнальной трансдукции.
Циклические нуклеотиды выступают в качестве вторичных мессенджеров, когда первые мессенджеры, которые не могут войти в камеру, а не связываются с рецепторами в клеточной мембране. Рецептора изменяет конформацию и передает сигнал, который активирует фермент во внутреннем клеточной мембране под названием аденилатциклаз. Это освобождает цАМФ внутрь клетки, где он стимулирует протеинкиназу называемый циклический АМФ-зависимой протеинкиназы. Фосфорилирование белков, циклическая АМФ-зависимая протеинкиназа изменяет активность белка. Роль цАМФ в этом процессе завершается после гидролиза с помощью AMP фосфодиэстеразы.
Циклические нуклеотиды хорошо подходят , чтобы действовать как вторичные мессенджеры по нескольким причинам. Их синтез является энергетически выгодным, и они являются производными от общих метаболических компонентов (АТФ и ГТФ). Когда они распадаются на AMP / GMP и неорганический фосфат, эти компоненты не являются токсичными. Наконец, циклические нуклеотиды можно отличить от не-циклических нуклеотидов , поскольку они имеют меньшие размеры и менее пол рный .
Биологическое значение
Участие циклических нуклеотидов на биологические функции изменяется, в то время как понимание их роли продолжает расти. Есть несколько примеров их биологического воздействия. Они связаны с долгосрочной и кратковременной памяти. Они также работают в печени координировать различные ферменты , которые контролируют уровень глюкозы в крови и другие питательные вещества . В бактерии , циклические нуклеотиды связываются с катаболитной гена белка — активатора (CAP), который действует , чтобы увеличить метаболическую ферментативную активность за счет увеличения скорости ДНК транскрипции . Они также способствуют релаксации гладкомышечных клеток в сосудистой ткани, и активировать циклические каналы CNG в сетчатке глаза фоторецепторов и обонятельных сенсорных нейронах . Кроме того, они потенциально активировать циклические каналы CNG в: шишковидной железе светочувствительности, сенсорные нейроны вомероназального органа (который участвует в обнаружении феромонов ), вкусовые рецепторы клетку, клеточная сигнализацию в сперме , дыхательные пути эпителиальные клетки, гонадотропин-рилизинг гормон (ГнРГ) -secreting нейрональной линии клеток и почки внутреннего медуллярный собирающий протока .
Тропинка мутации и связанные с ними заболевания
Примеры сбоев путей распространения cNMP включают: мутации в CNG канал генов связаны с дегенерацией сетчатки и с цветовой слепотой ; и избыточная экспрессия цитозольного или растворимого аденилатциклазы (САК) была связана с человеческой карциномой простаты . Ингибирование Sac или нокдаун с помощью РНК — интерференции (RNAi) трансфекции , как было показано , чтобы предотвратить распространение карциномы клеток простаты. Регулирующий путь , как представляется , быть частью пути ЕПАК , а не путь ПКА.
Фосфодиэстеразы, принцип регуляторы деградации cNMP, часто мишени для терапии. Кофеин является известным ингибитором ФДЭ, в то время как лекарственные средства , используемые для лечения эректильной дисфункции как силденафил и тадалафил также действовать через ингибирование активности фосфодиэстеразы.
Рекомендации
внешняя ссылка
- Нуклеотиды, + Циклический в США Национальной библиотеке медицина Медицинских предметных рубрик (MeSH)
Источник

