Рецепторы макрофагов при воспалении
Макрофаги выполняют следующие функции:
- Осуществляют фагоцитоз.
- Процессируют антиген, а затем рекомендуют (презентируют) его пептиды Т-хелперам, поддерживая осуществление иммунного ответа (рис. 6).
- Выполняют секреторную функцию, состоящую в синтезе и выделении ферментов (кислые гидролазы и нейтральные протеиназы), компонентов комплемента, ингибиторов ферментов, компонентов межклеточного матрикса, биологически активных липидов (простагландинов и лейкотриенов), эндогенных пирогенов, цитокинов (ИЛ-1β, ИЛ-6, ФНО-α и пр.).
- Оказывают цитотоксическое влияние на клетки-мишени при условии фиксации на них антитез ы соответствующей стимуляции со стороны Т-лимфоцитов (так называемые реакции антителозависимой клеточно-опосредованной цитотоксичности).
- Изменяют метаболизм при воспалении.
- Принимают участие в асептическом воспалении и разрушении инородных частиц.
- Обеспечивают процесс заживления ран.
см. Фагоцитоз
Основным свойством макрофага (рис. 4) является способность к фагоцитозу — селективному эндоцитозу и дальнейшей деструкции объектов, содержащих патогенсвязанные молекулярные шаблоны или присоединенные опсонины (рис. 5, 6).
Рецепторы макрофагов
см. Рецепторы врожденного иммунитета#Рецепторы фагоцитов
Для выявления таких объектов макрофаги содержат на своей поверхности рецепторы шаблонного распознавания (в частности, маннозосвязывающий рецептор и рецептор к бактериальным липополисахаридам), а также рецепторы к опсонинам (например, к C3b и Fc-фрагментам антител).
Макрофаги на своей поверхности экспрессируют рецепторы, обеспечивающие процессы адгезии (например, CDllc и CDllb), восприятие регуляторных влияний и участие в межклеточном взаимодействии. Так, есть рецепторы к различным цитокинам, гормонам, биологически активным веществам.
Бактериолиз
см. Бактериолиз
Презентация антигена
см. Презентация антигена
Пока происходит разрушение захваченного объекта, на мембране макрофага существенно возрастает количество рецепторов шаблонного распознавания и рецепторов к опсонинам, что позволяет продолжать осуществление фагоцитоза, а также повышается экспрессия молекул главного комплекса гистосовместимости II класса, вовлекаемых в процессы презентации (рекомендации) антигена иммунокомпетентным клеткам. Параллельно макрофаг производит синтез доиммунных цитокинов (в первую очередь ИЛ-1β, ИЛ-6 и фактора некроза опухоли α), привлекающих к работе другие фагоциты и активирующих иммунокомпетентные клетки, подготавливая их к предстоящему распознаванию антигена. Остатки патогена удаляются из макрофага путем экзоцитоза, а иммуногенные пептиды в комплексе с НLA II поступают на поверхность клетки для активации Т-хелперов, т.е. поддержания иммунного ответа.
Хорошо известна важная роль макрофагов в асептическом воспалении, которое развивается в очагах неинфекционного некроза (в частности, ишемического). Благодаря экспрессии рецепторов к «мусору» (scavenger receptor) эти клетки эффективно фагоцитируют и обезвреживают элементы тканевого детрита.
Также именно макрофаги захватывают и перерабатывают инородные частицы (например, пыль, частицы металла), по разным причинам попавшие в организм. Трудность фагоцитоза таких объектов состоит в том, что они абсолютно лишены молекулярных шаблонов и не фиксируют опсонины. Чтобы выйти из этой сложной ситуации, макрофаг начинает синтезировать компоненты межклеточного матрикса (фибронектин, протеогликаны и др.), которыми обволакивает частицу, т.е. искусственно создает такие ее поверхностные структуры, которые легко распознаются. Материал с сайта https://wiki-med.com
Установлено, что за счет деятельности макрофагов происходит перестройка метаболизма при воспалении. Так, ФНО-α активирует липопротеинлипазу, мобилизирующую липиды из депо, что при длительном течении воспаления приводит к похуданию. За счет синтеза доиммунных цитокинов макрофаги способны угнетать синтез целого ряда продуктов в печени (так, ФНО-α угнетает синтез гепатоцитами альбуминов) и повышать образование острофазовых белков (в первую очередь за счет ИЛ-6), относящихся преимущественно к глобулиновой фракции. Подобная перепрофилизация гепатоцитов наряду с увеличением синтеза антител (иммуноглобулинов) приводит к снижению альбумино-глобулинового коэффициента, что используется как лабораторный маркер воспалительного процесса.
Кроме классически активированных макрофагов, речь о которых шла выше, выделяют субпопуляцию альтернативно активированных макрофагов, которые обеспечивают процесс заживления ран и репарацию после воспалительной реакции. Эти клетки продуцируют большое количество ростовых факторов — тромбоцитарного, инсулинового, факторов роста, трансформирующего фактора роста β и фактора роста эндотелия сосудов. Альтернативно активированные макрофаги формируются под действием цитокинов ИЛ-13 и ИЛ-4, т.е. в условиях реализации преимущественно гуморального иммунного ответа.
 На этой странице материал по темам:
На этой странице материал по темам:
макрофаги функции в иммунном ответе
поверхностные рецепторы макрофагов
что такое макрофаги норма
мокрофюги
макрофаги в груди норма
Источник
Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу.
Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.
Тканевые макрофаги — первая «линия обороны» против инфекции. В течение нескольких минут после начала воспаления макрофаги, уже присутствующие в тканях, немедленно начинают свое фагоцитарное действие, будь то гистиоциты в подкожных тканях, альвеолярные макрофаги в легких, микроглия в мозге или др. При активации продуктами инфицирования и воспаления первым эффектом является быстрое увеличение каждого из макрофагов.
Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции: (1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области.
Этот эффект, показанный на рисунке, называют маргинацией (или краевым стоянием лейкоцитов), (2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедеза непосредственно из крови в тканевые пространства; (3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
— Также рекомендуем «Нейтрофилия. Защитные механизмы воспаления»
Оглавление темы «Клетки иммунитета. Виды иммунитета»:
1. Ретикулоэндотелиальная система. Макрофаги в лимфатических узлах
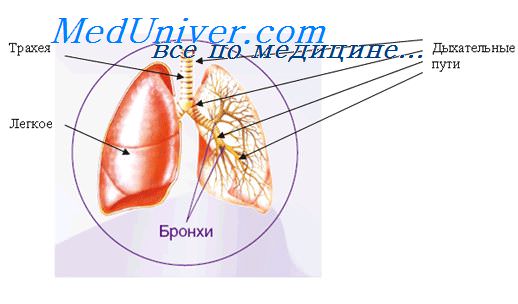
2. Альвеолярные макрофаги в легких. Клетки Купфера печени
3. Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
4. Нейтрофилия. Защитные механизмы воспаления
5. Образование гноя. Эозинофилы и базофилы
6. Лейкопения. Лейкемии и его типы
7. Врожденный иммунитет. Приобретенный или адаптивный иммунитет
8. Типы приобретенного иммунитета. Лимфоциты в приобретенном иммунитете
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов
Источник
Альвеолярные макрофаги. Значение альвеолярных макрофагов при воспалении в легких.Альвеолярные макрофаги ответственны за очищение от вдыхаемых чужеродных частиц различной природы. Взаимодействие альвеолярных макрофагов с удаляемыми частицами через определенные рецепторы определяет выраженность воспалительного ответа: от минимальной до активного воспаления с повреждением легочной ткани. Ответ альвеолярных макрофагов существенно различается в зависимости от рецепторов, задействованных при фагоцитозе частиц. Максимально выражен воспалительный ответ на захват опсонизированных частиц через Fc-peцепторы, от которых исходит сильнейший сигнал активации респираторного взрыва, секреции TNF-a и хемокинов. Опсонин-независимый фагоцитоз не сопровождается столь выраженной активацией метаболизма макрофагов. Захват неопсонизированных частиц альвеолярными макрофагами возможен через интегриновые рецепторы или через рецепторы для различных поверхностных компонентов частиц: лектиноподобные (MMR) для углеводов, рецепторы для обломков апоптотических клеток, скавенджер-рецепторы для модифицированных LDL и др. Экспрессия всех этих рецепторов регулируется провоспалительными цитокинами. Экспрессией их определяется роль альвеолярных макрофагов как барьера на пути проникновения в организм различных компонентов загрязнений воздуха (air pollutions), которые особенно опасны для людей с хроническими воспалительными заболеваниями бронхов и легких. Особенностью альвеолярных макрофагов является слабая экспрессия CD14 по сравнению с моноцитами крови в сочетании с повышенной экспрессией особого мембранного полипептида РАМ-1. Альвеолярные макрофаги экспрессируют три класса рецепторов для Fc-фрагмента IgG: FcyRI(CD64), FcyRII(CD32), FcyRIII(CD16). Первые два из них экспрессируют и моноциты крови, а третий является особенностью альвеолярных макрофагов. Между моноцитами и альвеолярными макрофагами имеется различие и по экспрессии рецепторов для фракций комплемента. На альвеолярных макрофагах усилена экспрессия CR4 при ослабленной экспрессии CR3 и CR1. Альвеолярные макрофаги отличаются от моноцитов крови сниженной экспрессией адгезионных молекул LFA1 и отсутствием на мембране представителей семейства интегринов (VLA). По уровню экспрессии антигенов гистосовместимости МНСН альвеолярные макрофаги не уступают моноцитам крови.
Когда патогенный микроорганизм преодолевает эпителиальный барьер, в субэпителиальной соединительной ткани он встречается с макрофагом. Взаимодействие микроорганизма с макрофагом влечет за собой несколько следствий. Во-первых, микроорганизм захватывается, убивается и переваривается внутри макрофага. Этих событий может оказаться достаточно для предотвращения дальнейшего развития инфекции. Однако многие патогенные микроорганизмы в процессе эволюции паразитизма приобрели факторы стратегии, позволяющие им избегать захвата или внутриклеточной гибели и переваривания в макрофагах.Так, например, полисахаридная капсула предохраняет пневмококков и клебсиелл от взаимодействия с рецепторами макрофагов. Инфицирующая доза микроорганизмов может быть столь велика, что макрофаги не справляются с их элиминацией. Однако взаимодействие микроорганизмов с рецепторами макрофагов имеет еще одно важное следствие — индукцию продукции и секреции провоспалительных цитокинов, обеспечивающих развитие раннего воспалительного ответа на инфекцию. Кроме того, захват и переработка макрофагами возбудителя является первой фазой индукции специфического иммунного ответа на его антигены. Макрофаги относятся к профессиональным антиген-презентирующим клеткам, способным взаимодействовать с Т-лимфоцитами. Главными антиген-презентирующими клетками в респираторном тракте считаются дендритные клетки, расположенные в паренхиме легких. Что касается роли альвеолярных макрофагов в иммунном ответе, то оценки ее весьма противоречивы. Особое внимание привлекают литературные данные о супрессирующем действии альвеолярных макрофагов на индуцированный антигеном пролиферативный ответ Т-лимфоцитов. На мембране макрофагов экспрессированы рецепторы для многих регулирующих цитокинов, главным активирующим среди которых является IFNy. Созревание, дифференцировка и активация макрофагов зависят от ростовых факторов: GM-CSF и M-CSF. Альтернативным регулирующим цитокином для макрофагов является IL-10, который ингибирует все свойства и функции макрофагов, которые стимулирует IFNy. Промежуточное влияние на функции макрофагов оказывают IL-4, IL-13, M-CSF и TGF-P. Среди продуктов секреции макрофагов главное место занимают провоспалительные (IL-1, IL-6, TNF-a, IL-8, IL-12) и противовоспалительные (ILIO, TGF-P) цитокины. Макрофаги продуцируют и секретируют факторы роста для аутокринной регуляции и для регуляции других клеток (фактор роста фибробластов). Среди монокинов обнаруживаются хемокины для разных клеток. Продукты макрофагов обеспечивают адгезию лейкоцитов к эндотелию сосудов и последующую трансэндотелиальную миграцию (TNF-a, IL-8 и др.хемокины). — Также рекомендуем «Цитокины и биологически активные вещества макрофагов.» Оглавление темы «Клетки крови и воспаление легких.»: |
Источник
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрессивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстановления поврежденных тканей.
Липидные «антенны»
Своей потенциальной «многоликостью» макрофаг обязан необычной организации генетического материала – так называемому открытому хроматину. Этот не до конца изученный вариант структуры клеточного генома обеспечивает быстрое изменение уровня экспрессии (активности) генов в ответ на различные стимулы.

Выполнение макрофагом той или иной функции зависит от характера получаемых им стимулов. Если стимул будет распознан как «чужой», то происходит активация тех генов (и соответственно функций) макрофага, которые направлены на уничтожение «пришельца». Однако макрофаг могут активировать и сигнальные молекулы самого организма, которые побуждают эту иммунную клетку участвовать в организации и регуляции обмена веществ. Так, в условиях «мирного времени», т. е. при отсутствии патогена и обусловленного им воспалительного процесса, макрофаги участвуют в регуляции экспрессии генов, отвечающих за метаболизм липидов и глюкозы, дифференцировку клеток жировой ткани.
Интеграция между взаимоисключающими «мирным» и «военным» направлениями работы макрофагов осуществляется путем изменения активности рецепторов клеточного ядра, представляющих собой особую группу регуляторных белков.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
«Классический» макрофаг М1 формируется из клетки-предшественника (моноцита) под действием каскада внутриклеточных сигналов, запускающихся после распознавания инфекционного агента с помощью специальных рецепторов, расположенных на поверхности клетки.
Образование «пожирателя» М1 происходит в результате мощной активации генома, сопровождаемой активацией синтеза более чем сотни белков – так называемых факторов воспаления. К ним относятся ферменты, способствующие генерации свободных радикалов кислорода; белки, привлекающие в очаг воспаления другие клетки иммунной системы, а также белки, способные разрушать оболочку бактерий; воспалительные цитокины – вещества, обладающие свойствами активировать иммунные клетки и оказывать токсическое действие на остальное клеточное окружение. В клетке активируется фагоцитоз и макрофаг начинает активно разрушать и переваривать все, что встретится на его пути (Шварц, Свистельник, 2012). Так появляется очаг воспаления.
Однако уже на начальных этапах воспалительного процесса макрофаг М1 начинает активно секретировать и противовоспалительные субстанции – низкомолекулярные липидные молекулы. Эти сигналы «второго эшелона» начинают активировать вышеупомянутые липидные сенсоры в новых «рекрутах»-моноцитах, прибывающих в очаг воспаления. Внутри клетки запускается цепь событий, в результате которых активирующий сигнал поступает на определенные регуляторные участки ДНК, усиливая экспрессию генов, отвечающих за гармонизацию обмена веществ и одновременно подавляя активность «провоспалительных» (т. е. провоцирующих воспаление) генов (Душкин, 2012).
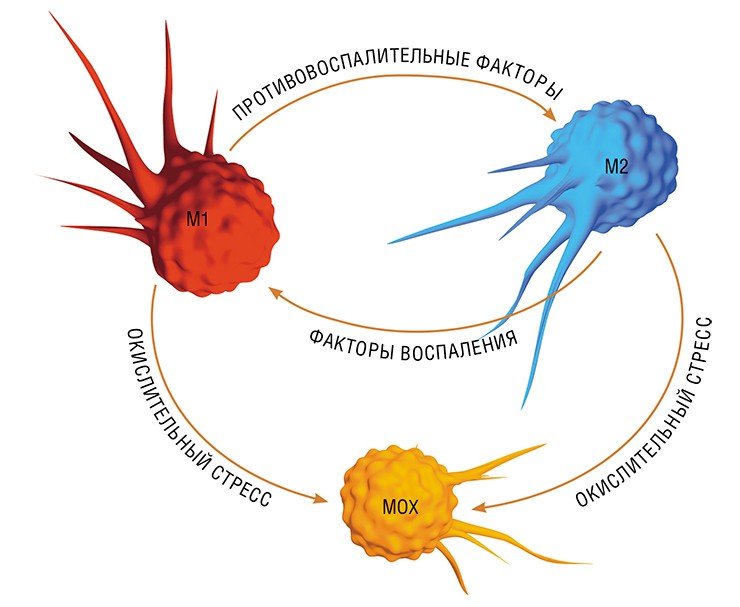
Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
Пенистый камикадзе
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Была высказана гипотеза, ставшая общепринятой, что пенистые клетки образуются в стенке атеросклеротических сосудов в результате неконтролируемого поглощения макрофагами липопротеинов низкой плотности, переносящих «плохой» холестерин. Однако впоследствии было обнаружено, что накопление липидов и драматическое (в десятки раз!) возрастание скорости синтеза ряда липидов в макрофагах можно спровоцировать в эксперименте только лишь одним воспалением, без всякого участия липопротеинов низкой плотности (Душкин, 2012).
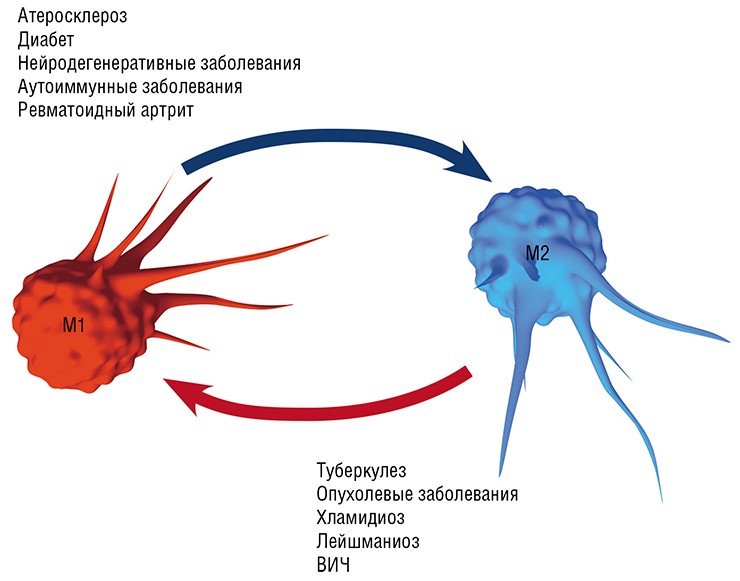
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
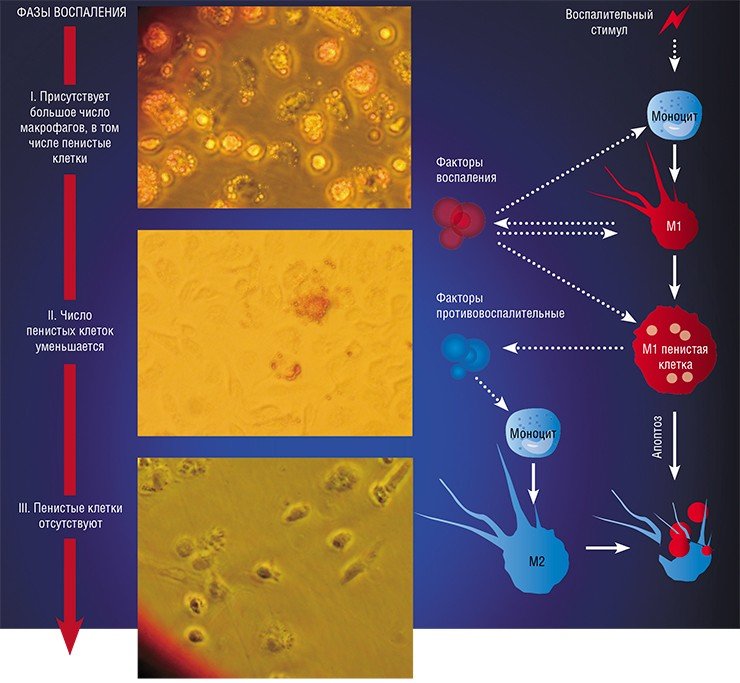
Оказалось, что активация провоспалительных сигнальных путей в М1 макрофагах приводит к «выключению» тех самых липидных сенсоров, которые в нормальных условиях контролируют и нормализуют липидный обмен (Душкин, 2012). При их «выключении» клетка и начинает накапливать липиды. При этом образующиеся липидные включения представляют собой вовсе не пассивные жировые резервуары: входящие в их состав липиды обладают способностью усиливать воспалительные сигнальные каскады. Главная цель всех этих драматических изменений – любыми средствами активировать и усилить защитную функцию макрофага, направленную на уничтожение «чужих» (Melo, Drorak, 2012).
Однако высокое содержание холестерина и жирных кислот дорого обходится пенистой клетке – они стимулируют ее гибель путем апоптоза, запрограммированной клеточной смерти. На внешней поверхности мембраны таких «обреченных» клеток обнаруживается фосфолипид фосфатидилсерин, в норме расположенный внутри клетки: появление его снаружи является своеобразным «похоронным звоном». Это сигнал «съешь меня», который воспринимают М2 макрофаги. Поглощая апоптозные пенистые клетки, они начинают активно секретировать медиаторы заключительной, восстановительной стадии воспаления.
Фармакологическая мишень
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
Если в этом случае использовать синтетические активаторы липидных сенсоров, которые препятствуют образованию жировых включений и, соответственно, предотвращают «пенистую» трансформацию макрофага, то можно подавить рост и понизить жизнеспособность инфекционных патогенов. По крайней мере в экспериментах на животных уже удалось в разы снизить обсемененность легких мышей туберкулезными бациллами, используя стимулятор одного из липидных сенсоров или ингибитор синтеза жирных кислот (Lugo-Villarino et al., 2012).
 Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Формированию таких нестабильных атеросклеротических бляшек и способствует макрофаг М1/пенистая клетка, который продуцирует ферменты, растворяющие коллагеновое покрытие бляшки. В этом случае наиболее эффективная стратегия лечения – превращение нестабильной бляшки в стабильную, богатую коллагеном, для чего требуется трансформировать «агрессивный» макрофаг М1 в «умиротворенный» М2.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
Нужно добавить, что такая трансформация макрофагов актуальна при ожирении и диабете 2 типа (большая часть макрофагов жировой ткани имеет М1 фенотип), а также при лечении нейродегенеративных заболеваний мозга. В последнем случае в мозговых тканях происходит «классическая» активация макрофагов, что приводит к повреждению нейронов и накоплению токсичных веществ. Превращение М1-агрессоров в мирных дворников М2 и Mox, уничтожающих биологический «мусор», может в ближайшее время стать ведущей стратегией лечения этих заболеваний (Walace, 2012).
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
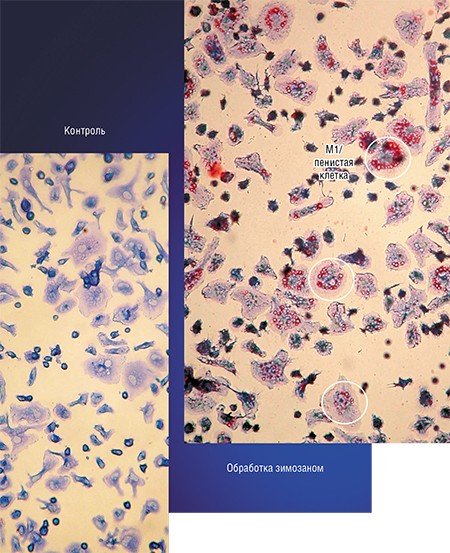
Примером такого подхода служит технология, разработанная в новосибирском Институте клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях,