Перекисное окисление липидов воспаление

Бронхиальная астма (БА) является глобальной проблемой здравоохранения. По оценкам ВОЗ, в мире около 300 млн. больных БА, при этом распространенность заболевания в разных странах мира колеблется от 1 до 18 % [1].
Согласно определению экспертов GINA (2014), БА — это гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей и определяющееся историей респираторных симптомов (свистящие хрипы, кашель, заложенность в грудной клетке, одышка), которые сопровождаются вариабельной обструкцией дыхательных путей и варьируют по времени и интенсивности [2]. На современном этапе значительное внимание уделяется изучению патогенеза данного заболевания [3]. Воспаление дыхательных путей считается основной причиной повторяющихся эпизодов бронхиальной обструкции при БА, а активные формы кислорода играют ключевую роль в инициации и усилении воспалительного процесса в бронхах [4].
Существуют эндогенные (фагоцитирующие клетки, эндоплазматическтй ретикулум, пероксисомы, митохондрии и др.) и экзогенные (табачный дым, алкоголь, пестициды, тяжелые и переходные металлы, промышленное загрязнение, некоторые лекарственные препараты, радиация и др.) источники активных форм кислорода и азота. [5]. Повышенное образование свободных радикалов в сочетании с недостаточностью антиоксидантных систем приводит к развитию оксидативного стресса, который играет важную роль в развитии хронического воспаления при БА [6]. Оксиданты оказывают негативное влияние на различные классы биомолекул, инактивируют или модифицируют нуклеиновые кислоты, липиды, протеины [7]. Это связано с тем, что свободные радикалы быстро реагируют с ненасыщенными липидами мембран, способствуя образованию липидных перекисей, и окисляют восприимчивые группы белков и нуклеиновых кислот. [8]. Кроме того, активные формы кислорода и азота способствуют формированию дисбаланса в системе протеолиз-антипротеолиз, инактивируя антипротеазы [9].
Дисбаланс в оксидантно-антиоксидантной системе является фактором риска возникновения БА как у детей [10], так и у взрослых [11].
Оксиданты опосредуют множество процессов, способствующих развитию воспалительных изменений в легких (повреждение фибробластов, образование тромбоксана, снижение активности сурфактанта, ухудшение функции ресничек, повышение проницаемости эпителия) [12]. Дисбаланс в оксидантно-антиоксидантной системе приводит к возникновению следующих патофизиологических эффектов, связанных с БА: гиперсекреция слизи, повышение сосудистой проницаемости, сокращение гладкой мускулатуры [4], что обусловливает основные клинические проявления: воспаление, нарушение функции внешнего дыхания, вторичную эмфизему [8]. Кроме того, оксидативный стресс способствует десенситизации бета-адренорецепторов [7], а также формированию резистентности к глюкокортикостероидной терапии, которая обусловлена ремоделированием дыхательных путей [13]. По данным морфологических исследований легочной ткани, последствия дисбаланса в оксидантно-антиоксидантной системе связаны с гиперплазией интерстициальных клеток, гипертрофией и гиперплазией альвеолоцитов II типа, интерстициальным отеком, разрушением легочных капилляров [14]. Низкая активность антиоксидантных ферментов в сочетании с высоким уровнем свободных радикалов создает условия для рецидивирования воспаления [15].
Оксидативный стресс способствует персистенции воспалительного процесса в респираторном тракте, активируя клетки через механизмы сигнальной трансдукции и вызывая экспрессию генов цитокинов. Вследствие оксидативного стресса, ассоциированного с воспалением при бронхиальной астме, происходит активация транскрипционных факторов [16]. При этом увеличивается транскрипция генов фактора некроза опухоли-α, интерлейкинов-1, -6, -8. Цитокины способствуют нарушению баланса оксидантов/антиоксидантов, активизируют клетки воспаления [17].
При БА отмечается повышенное содержание малонового диальдегида, окиси азота, перекиси водорода [17], свободных радикалов и метгемоглобина на фоне снижения антиоксидантов (трансферрин и церулоплазмин, супероксиддисмутаза, каталаза) [18].
Установлено, что степень увеличения содержания липидных перекисей в мембранах эритроцитов зависит от интенсивности клинических симптомов БА [19], а общая антиоксидантная активность крови коррелирует с ОФВ1 [20]. Доказано, что интенсивность свободнорадикальных процессов отражает тяжесть клинических проявлений при БА, а в динамике позволяет оценить эффективность лечения [15].
В настоящее время важное значение имеют различные аспекты оптимизации терапии БА [21–31]. Применение антиоксидантов для усиления эндогенной антиоксидантной защиты или устранения избыточной продукции активных форм кислорода может быть использовано, чтобы ослабить или предотвратить воспалительную реакцию при БA [4]. Назначение антиоксидантных препаратов пациентам с бронхиальной астмой показано при недостаточной эффективности консервативной терапии, для профилактики сезонных обострений БА, лечения и профилактики острых респираторных инфекций, при наличии астматической триады. В качестве антиоксидантов применяются соединения селена, витамины С и Е, ацетилцистеин [32]. Показана клиническая эффективность лечения пациентов с БА при применении рутина, который, оказывая антиоксидантное действие, препятствует последующим патогенетическим этапам воспаления [15]. Антиоксидантным и мембраностабилизирующим свойством обладает деринат [33]. Отмечено повышение антиоксидантной активности (уровень церулоплазмина и активность каталазы) в период клинического выздоровления при использовании данного препарата в сочетании с базисной терапией БА [8]. В комплексном лечении БА применяется ацетилцистеин, антиоксидантное действие которого связано с наличием нуклеофильной тиоловой SH–группы, которая легко отдает водород, нейтрализуя свободные радикалы. Данный препарат способствует синтезу глутатиона — основной антиокислительной системы организма, что повышает защиту клеток от повреждающего воздействия свободнорадикального окисления, свойственного интенсивному воспалительному процессу [34]. Положительное воздействие на ферментативное и неферментативное звенья антиоксидантной защиты оказывает эмоксипин, что способствует уменьшению субъективных и объективных проявлений бронхиальной обструкции у больных БА [35]. По данным Фархутдинова У. Р. и соавт., применение в комплексной терапии антиоксиданта церулоплазмина способствует устранению нарушений свободнорадикального окисления, что позволяет оптимизировать терапию пациентов с БА [36].
Литература:
1. Глобальная стратегия лечения и профилактики бронхиальной астмы Global strategy for asthma management and prevention: пересмотр, 2011 г. / пер. с англ. / под ред. А. С. Белевский. М.: Российское респираторное общество, 2012. 108 с.
2. The Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA) 2015. Available from: https://www.ginasthma.org/.
3. Будневский А. В. Системный подход к изучению психонейроиммунологических взаимодействий при бронхиальной астме // Системный анализ и управление в биомедицинских системах. 2005. Т. 4. № 1. С. 20–23.
4. Nadeem A, Masood A, Siddiqui N Oxidant-antioxidant imbalance in asthma: scientific evidence, epidemiological data and possible therapeutic options // Ther Adv Respir Dis. 2008. № 2(4). P.215–235.
5. Phaniendra A, Jestadi DB, Periyasamy L Free radicals: properties, sources, targets, and their implication in various diseases//Indian J Clin Biochem. 2015. № 30(1). P.11–26.
6. Al-Harbi NO et al. Oxidative airway inflammation leads to systemic and vascular oxidative stress in a murine model of allergic asthma// Int Immunopharmacol. 2015 № 26(1). Р. 237–245.
7. Nadeem A, Siddiqui N, Alharbi NO, Alharbi MM Airway and systemic oxidant-antioxidant dysregulation in asthma: a possible scenario of oxidants spill over from lung into blood // Pulm Pharmacol Ther. 2014. № 29(1). P. 31–40.
8. Ахвердиева Т. Б., Васькова Н. А., Герасимова Н. Г., Коваленко Е. Н., Зотова Л. В., Чернова О. В. «Деринат» в комплексной терапии бронхиальной астмы у детей. Режим доступа: https://rae.ru/forum2012/9/1724 (дата обращения 25.04.2015).
9. Соодаева С. К., Климанов И. А. Нарушения окислительного метаболизма при заболеваниях респираторного тракта и современные подходы к антиоксидантной терапии // АтмосферА. Пульмонология и аллергология. 2009. № 1. С. 34–38.
10. Bakkeheim E, Mowinckel P, Carlsen KH, Burney P, Carlsen KC. Altered oxidative state in schoolchildren with asthma and allergic rhinitis //Pediatr Allergy Immunol. 2011 № 22(2). Р.178–185.
11. Larkin EK et al. New risk factors for adult-onset incident asthma. A nested case-control study of host antioxidant defense // Am J Respir Crit Care Med. 2015 № 191(1). P. 45–53.
12. Adam W. DNA and 2′-deoxyguanosine damage in the horseradish-peroxidase-catalyzed autoxidation of aldehydes: the search for the oxidizing species // Free Radic. Biol. Med. 1999. V.26, № 5–6. P.566–579.
13. Sartorelli C. F., Rehder J., Neto A. C. et al. Assessment of inflammation based on the release of oxygen radicals by granulocytes in chronic uncontrolled asthma // J. Pediatr. (Rio J). 2009. № 85(2). P. 143–148.
14. Levine SA, Reinhardt JH. Biochemical pathology initiated by free radicals, oxidant chemicals and therapeutic drugs in the etiology of chemical hypersensitivity diseases // Orthomol Psychiatry. 1983. № 12. P. 166–183.
15. Новиков Ю. К. Свободнорадикальное воспаление и антирадикальная защита у больных бронхиальной астмой // Русский мед. журнал. 1997. Т.5. № 17. С. 27–31.
16. Barnes, P. J. Transcription factors in airway diseases // Lab. Invest. 2006. V.86, № 9. Р. 867–872.
17. Латышева А. Н., Смирнова С. В., Колпакова А. Ф. Бронхиальная астма и хроническая обструктивная болезнь легких: особенности системы оксидант-антиоксидант. Красноярск: Издательство КраГМУ; 2011. — 110 с.
18. Колпакова А. Ф. Влияние комбинированной терапии отечественными ингаляционными противоастматическими препаратами на оксидантно-антиоксидантный статус больных бронхиальной астмой// Терапевтический архив. 2007. № 3. С. 41–44.
19. Аматуни В. Г., Карагезян К. Г., Сафарян М. Д. Роль перекисного окисления липидов мембран (ПОЛ) и антирадикальной защиты в патогенезе бронхиальной астмы// Терапевтический архив. — 1980. — № 3.- С.96–100.
20. Yoon S. Y., Kim T. B., Baek S., Kim S., Kwon H. S., Lee Y. S. et al. The impact of total antioxidant capacity on pulmonary function in asthma patients // Int. J. Tuberc. Lung Dis. 2012. № 16(11). P.1544–1550.
21. Будневский А. В. Оптимизация терапии бронхиальной астмы: психосоматические аспекты // Системный анализ и управление в биомедицинских системах. 2005. Т. 4. № 2. С. 152–154.
22. Будневский А. В., Бурлачук В. Т., Олышева И. А. Терапевтические подходы к контролю воспаления на уровне мелких бронхов при бронхиальной астме // Российский аллергологический журнал. 2010. № 4. С. 85–94.
23. Будневский А. В., Трибунцева Л. В., Разворотнев А. В. Системный подход к анализу эффективности вакцинации больных бронхиальной астмой в муниципальном районе // Вестник новых медицинских технологий. 2013. Т. 20. № 1. С. 53–55.
24. Будневский А. В., Бурлачук В. Т., Разворотнев А. В. и др. Оптимизация лечебно-профилактической помощи больным бронхиальной астмой, проживающим в сельской местности // Системный анализ и управление в биомедицинских системах. 2012.- Т. 11, № 1. С. 9–11.
25. Гамазина М. В., Будневский А. В. Клиническая эффективность комплексной реабилитационной программы у больных бронхиальной астмой с сопутствующей язвенной болезнью желудка и (или) двенадцатиперстной кишки // Научно-медицинский вестник Центрального Черноземья. 2008. № 32. С. 33–39.
26. Ермолова А. В., Будневский А. В. Бронхиальная астма и метаболический синдром: возможности достижения контроля над заболеванием и улучшения качества жизни // Врач-аспирант. 2013. Т. 61. № 6.2. С. 319–325.
27. Олышева И. А., Бурлачук В. Т., Будневский А. В. и др. Немедикаментозные методы терапии в достижении контроля бронхиальной астмы // Справочник врача общей практики. 2014. № 2. С. 45.
28. Провоторов В. М., Будневский А. В. Психологические аспекты организации и проведения занятий в «астма-школе» // Пульмонология. 2000. № 4. С. 63–67.
29. Каменюк Е. В., Будневский А. В., Разворотнев А. В. и др. Системный подход к управлению лечебно-диагностическим процессом при бронхиальной астме // Вестник новых медицинских технологий. 2012. № 3. С. 83–84.
30. Трибунцева Л. В., Будневский А. В., Разворотнев А. В. Системный подход к управлению терапией больных бронхиальной астмой // Врач-аспирант. 2012. № 1.2 (5). С.338.-342.
31. Будневский А. В. Возможности контроля над бронхиальной астмой: роль малых дыхательных путей / А. В. Будневский, В. Т. Бурлачук, И. А. Олышева, Е. В. Токмачев // Пульмонология. 2011. № 2. С. 101–108.
32. Лечение клинико-патогенетических вариантов бронхиальной астмы. Available at: https://genmed.ru/med_b2_83_03.html
33. Деринат. Available at: https://evropharm.ru/products/derinat-1–5-percent-5ml-amp-h-5.aspx
34. Зайцева О. В. Рациональный выбор муколитической терапии в лечении болезней органов дыхания у детей // Русский медицинский журнал. 2009. Т. 17. № 19. С. 1217–1222.
35. Лапик С. В., Жмуров В. А., Попова Т. В. Эмоксипин в лечении бронхиальной астмы. Пульмонология. 2000. № 1. С. 62–65.
36. Фархутдинов У. Р., Фархутдинов Ш. У. Эффективность церулоплазмина у больных бронхиальной астмой // Терапевтический архив. 2012. № 12. С. 45–48.
Основные термины (генерируются автоматически): активная форма кислорода, бронхиальная астма, оксидантно-антиоксидантная система, GINA, антиоксидантное действие, бронхиальная обструкция, воспалительный процесс, хроническое воспаление.
Источник
Перекисное окисление липидов (ПОЛ) представляет собой жизненно необходимое звено метаболического обмена. Основная функция его заключается в обновлении липидов клеточных мембран.
У здорового человека процессы перекисного окисления липидов контролируются так называемой антиокислительной системой, которая регулирует скорость и активность фосфорилирования путем связывания провоцирующих факторов или нейтрализации достаточного количества перекисей, чтобы не допустить переизбыток конечных продуктов обмена. Усиление процесса окисления может стать отправной точкой в патофизиологических процессах значительного количества заболеваний. Этот процесс включает в себя стадии ферментативного и неферментативного аутоокисления.
Виды
Для модификации фосфолипидного бислоя клеточных мембран проходит ферментативное окисление. Кроме того, он участвует в образовании биологически активных веществ, детоксикации организма, метаболических реакциях. Неферментативное же окисление проявляет себя как разрушающий фактор в жизни клетки. Из-за образования большого количества свободных радикалов и накопления перекисей активность антиоксидантной системы снижается и, как следствие, наблюдается гибель клеток организма.
Цикл ПОЛ
Для начала перекисного окисления липидов необходимо наличие свободных радикалов кислорода, имеющих на крайнем энергетическом уровне один неспаренный электрон. После восстановления молекулы образуется супероксид кислорода, который реагирует с атомами водорода, превращаясь в перекись водорода. Для регулирования количества супероксидов внутри клетки существуют супероксиддисмутаза, образующая перекись водорода, а каталаза, пероксидаза нейтрализуют ее до воды. Если живой организм подвергся действию ионизирующего излучения, количество свободных гидроксильных радикалов резко увеличится. Кроме гидроксида кислорода и другие его активные формы могут выступать инициаторами запуска процесса перекисного окисления липидов.
Продукты перекисного окисления липидов либо утилизируются организмом, либо используются для синтеза простагландинов (веществ, участвующих в реакциях воспаления), тромбоксанов (входят в каскад тромбообразующих реакций), гормонов надпочечников.
Система контроля
В зависимости от базовой структуры мембраны клетки скорость, активность и количество получившихся продуктов окисления могут варьироваться. Так, например, активность перекисного окисления липидов выше там, где в составе клеточной стенки преобладают ненасыщенные жирные кислоты, и медленнее, если основой КС является холестерин. Кроме того, фактором, регулирующим количество и скорость образования свободных кислородных радикалов, а также утилизацию перекисей, являются метаболические ферменты. Еще в реакции перекисного окисления липидов принимают участие вещества, влияющие на липидный состав мембраны клетки и его произвольное изменение в соответствии с потребностями организма. К ним относятся витамин Е и К, тироксин (гормон щитовидной железы), гидрокортизон, кортизон и альдостерон (по принципу обратной связи). Дестабилизируют клеточную стенку ионы металлов, витамины С и D.
Нарушение процесса
Метаболические продукты перекисного окисления липидов могут накапливаться в тканях и жидкостях организма, если антиоксидантная система не успевает утилизировать их с необходимой скоростью. Вследствие этого нарушается транспорт ионов через мембрану клетки, что опосредованно может влиять на ионный состав жидкой части крови, скорость поляризации и деполяризации мембран мышечных клеток (нарушать проводимость нервных импульсов, их сократимость, увеличивать рефрактерный период), способствовать выходу жидкости во внеклеточное пространство (отеки, сгущение крови, нарушение электролитного баланса). Кроме того, основные продукты перекисного окисления липидов, после ряда биохимических реакций, превращаются в альдегиды, кетоновые тела, кислоты и пр. Эти вещества оказывают токсическое влияние на организм, проявляющееся в снижении скорости синтеза ДНК, повышении проницаемости капилляров, повышении онкотического давления и, как следствие, сладж-синдроме.
Проявления в клинике
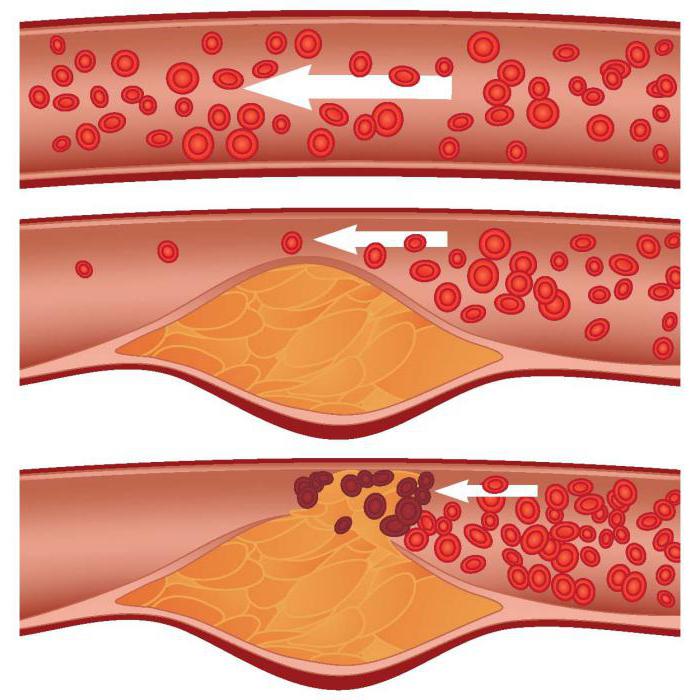
Так как увеличение количества свободных радикалов кислорода оказывает повреждающее влияние на клеточную стенку, а продукты обмена нарушают процесс метаболизма и синтеза нуклеиновых кислот, а также отравляют организм, они являются патофизиологическим фактором развития ряда клинических состояний. Роль перекисного окисления липидов является немаловажной при заболеваний печени, суставов, паразитарных инфекционных заболеваний, нарушениях гемодинамики, онкологических заболеваниях, травмах и ожогах. ПОЛ выступает одним из факторов развития атеросклероза. Свободные радикалы, окисляя холестерин и его низкомолекулярные фракции, образуют продукты, повреждающие сосудистую стенку. При этом запускается каскад типичных патологических реакций, направленных на устранение повреждения. Это провоцирует тромбообразование, накопление сгустков крови в просвете мелких сосудов или прикрепление к их стенкам. В результате движение крови на этом участке замедляется, так как просвет сосуда стал уже. Это способствует дальнейшему накоплению тромбов. Наиболее подвержены подобным изменениям коронарные артерии, аорта, проявляющиеся в клинике как симптомы ишемической болезни сердца.
Превентивные меры

Практикующим специалистам необходимо помнить, что проведение диагностических и лечебных процедур может активировать механизм перекисного окисления липидов. Об этом следует предупредить пациента. К провоцирующим факторам относятся лучевая терапия (при онкологии), ультрафиолетовое облучение (при рахите, воспалительных заболеваниях пазух носа, антибактериальной обработке помещений), магнитные поля (МРТ, КТ, физиотерапия), сеансы в барокамере (при полиомиелите, горной болезни).
Профилактика и терапия

Персоналу, работающему в рентгенкабинетах, санитаркам и медсёстрам, специалистам по физиотерапии, альпинистам, людям с избыточным весом нужно употреблять в пищу продукты, содержащие естественные антиоксиданты: рыбу, подсолнечное или оливковое масло, зелень, яйца, зеленый чай.
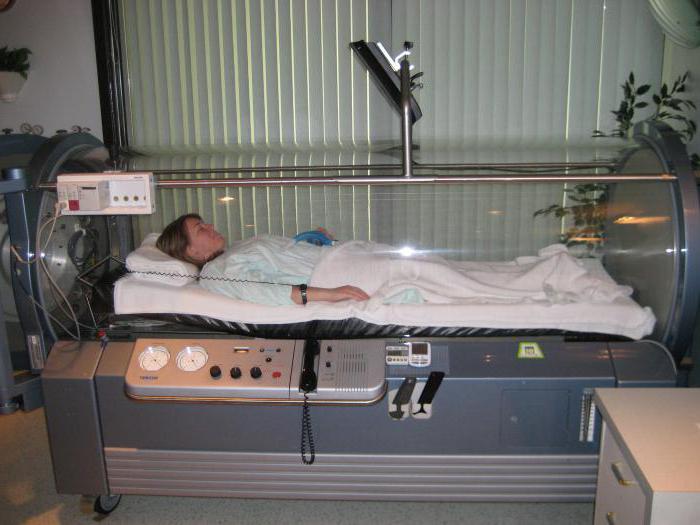
Помимо изменения диеты, можно использовать лекарственные средства, которые связывают некоторые группы свободных радикалов или соединяются с металлами переменной валентности. Таким образом они замещают свободные молекулы активного кислорода, не давая им связываться с усилителями ПОЛ.
Диагностика
На нынешнем этапе развития лабораторных исследований мы имеем возможность обнаружить перекиси в составе биологических жидкостей организма человека. Для этого нужно провести флуоресцентную микроскопию. Проще говоря, выявить перекисное окисление липидов. Значение этого диагностического теста не нуждается в объяснении. Ведь в основе значительного количества заболеваний лежит чрезмерная активность перекисного окисления липидов. Выявление этого состояния определяет тактику лечения.
С точки зрения нормальной физиологии перекисное окисление липидов необходимо для образования стероидных гормонов, медиаторов воспаления, цитокинов и тромбоксанов. Но когда количество продуктов обмена данных химических реакций превышает допустимое значение и перекиси повреждают органеллы клетки, нарушают синтез ДНК и белков, в действие вступает антиоксидантная система, снижающая количество свободных радикалов кислорода, ионов металлов с изменчивой валентностью. Кроме этого, она повышает синтез каталазы и пероксидазы с целью утилизации излишков перекисей и продуктов их дальнейшего метаболизма.
Источник
