Незавершенный фагоцитоз при воспалении

Поглощённые фагоцитами бактерии обычно погибают и разрушаются, но некоторые микроорганизмы, снабжённые капсулами или плотными гидрофобными клеточными стенками, захваченные фагоцитом, могут быть устойчивы к действию лизосомальных ферментов или способны блокировать слияние фаго-сом и лизосом. В силу этого обстоятельства они на длительное время остаются в фагоцитах в жизнеспособном состоянии. Такая разновидность фагоцитоза получила название незавершённого. Существует множество причин незавершённого фагоцитоза, основные из них перечислены на рисунке.
Многие факультативные и облигатные внутриклеточные паразиты не только сохраняют жизнеспособность внутри клеток, но и способны размножаться. Персистирование патогенов опосредуют три основных механизма.
• Блокада фагосомо-лизосомального слияния. Этот феномен обнаружен у вирусов (например, у вируса гриппа), бактерий (например, у микобактерий) и простейших (например, у токсоплазм).
• Резистентность к лизосомальным ферментам (например, гонококки и стафилококки).
• Способность патогенных микроорганизмов быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (например, риккетсии).
Фагоцитоз сопряжен с процессом передачи информации об Аг лимфоцитам. Это происходит тогда, когда объектом фагоцитоза являлся носитель чужеродной антигенной информации (клетки, микроорганизмы, опухолевые и вируссодержащие клетки, белковые неклеточные структуры и др.). В этом случае Аг после его модификации в фагоците (процессинг) экспрессируется на поверхности клетки. Такой Аг значительно более иммуногенен, чем интактный Аг. Фагоцитирующие клетки, осуществляющие процессинг, называют антигенпред-ставляющими клетками. При этом фагоцит представляет (презентирует) клеткам иммунной системы двоякую информацию: о чужеродном Аг и о собственных Аг, кодируемых генами HLA и необходимых для сравнения их с чужими Аг.
Фагоциты также продуцируют и выделяют в межклеточную жидкость ряд БАВ, регулирующих развитие либо иммунитета, либо аллергии, либо состояния толерантности. Таким образом, воспаление непосредственно связано с формированием иммунитета или иммунопатологических реакций в организме.
Основные причины незавершённого фагоцитоза.
Пролиферация
Пролиферация — компонент воспалительного процесса и завершающая его стадия — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и/или замещение разрушенных тканевых элементов. Существенное значение на этой стадии воспаления имеют различные БАВ, в особенности стимулирующие пролиферацию клеток (митогены).
Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного фактора на ткань и более выражены по периферии зоны воспаления. Одним из условий оптимального течения пролиферации является затухание процессов альтерации и экссудации.
Формы и степень пролиферации органоспецифических клеток различны и определяются характером клеточных популяций.
• У части органов и тканей (например, печени, кожи, ЖКТ, дыхательных путей) клетки обладают высокой пролиферативной способностью, достаточной для ликвидации дефекта структур в очаге воспаления.
• У других органов и тканей эта способность весьма ограничена (например, у тканей сухожилий, хрящей, связок, почек и др.).
• У ряда органов и тканей паренхиматозные клетки практически не обладают пролиферативной активностью (например, миоциты сердечной мышцы, нейроны). В связи с этим при завершении воспалительного процесса в тканях миокарда и нервной системы на месте очага воспаления пролифе-рируют клетки стромы, в основном фибробласты, которые образуют и неклеточные структуры. В результате этого формируется соединительнотканный рубец. Вместе с тем известно, что паренхиматозные клетки указанных тканей обладают высокой способностью к гипертрофии и гиперплазии субклеточных структур.
Активация пролиферативных процессов коррелирует с образованием БАВ, обладающих антивоспалительным эффектом (своеобразных противовоспалительных медиаторов). К числу наиболее действенных среди них относятся:
• ингибиторы гидролаз, в частности протеаз (например, антитрипсина), р-микроглобулина, плазмина или факторов комплемента;
• антиоксиданты (например, церулоплазмин, гаптоглобин, пероксидазы, СОД);
• полиамины (например, путресцин, спермин, кадаверин);
• глюкокортикоиды;
• гепарин (подавляющий адгезию и агрегацию лейкоцитов, активность кининов, биогенных аминов, факторов комплемента).
Замещение погибших и повреждённых при воспалении тканевых элементов отмечается после деструкции и элиминации их (этот процесс получил название раневого очищения).
— Читать далее «Регуляция пролиферации. Острое воспаление.»
Источник
Дефицит
белка.Дефицит
витаминов.Наследственные
ферментопатии.Иммунодефициты.
Особенности
возбудителя (его размеры значительно
превышают размеры самого фагоцита).Объектом
фагоцитоза являются комплексы
антиген-антитело, находящиеся на
плоской поверхности сосудистого
эндотелия.
Как
следствие, раздраженные мононуклеары
выделяют монокины, лимфокины, которые
стимулируют хемотаксис, соседние клетки
соединительной ткани и др. Активированные
хемоаттрактантами фагоциты способны
высвобождать содержимое своих гранул
не только внутрь фагосомы, но и во
внеклеточное пространство. При этом
содержимое гранул и продуцируемые
фагоцитами активные метаболиты кислорода
воздействуют
и на объект атаки, и на ткани организма
хозяина.
Дистантно развивается лейкоцитоз.
При
затяжных воспалительных процессах
(сопровождающихся незавершенным
фагоцитозом)
целесообразно применять
Стимуляторы
иммунитета, в частности, фагоцитоза
путем
искусственного обострения воспаления,
вводя, например, искусственно получаемые
эндотоксины бактерий (продигиозан);через
активацию лимфоцитов иммуностимуляторами
(см. тему «Патология иммунитета»).
Создание
гипертермии (положительный эффект на
активность ферментов, диссоциацию
оксигемоглобина).
Витаминотерапию.
Специфическую
антибиотикотерапию.
Механизмы пролиферации.
Пролиферация
— репаративная стадия воспаления, это
размножение клеток. Нейтрофилы погибают,
макрофаги расчищают поле для регенерации.
Фибробласты
— главные эффекторы репарации. Механизм
— стимуляция пролиферации через
синтез ДНК и митотическую активность.
Начинается с 1
стадии воспаления, а ее пик приходит к
3 стадии.
Медиаторы пролиферации (трефоны)
Полиамины
— путресцин, спермидин (продукты
орнитиндекарбоксилазы).Факторы
роста фибробластов
— тромбоцитарный и гипофизарный.Эндотелиальный
хемотаксический фактор
(из макрофагов) — для врастания сосудов
в грануляционную ткань.Тканеспецифические
стимуляторы
— иммуноглобулины G
и M.Лимфокины
(из Т-лимфоцитов) участвуют в пролиферации
лимфоцитов и макрофагов.Монокины
(из макрофагов).Эндотелиальный
фактор роста.Кейлоны
(ингибиторы пролиферации).
Их
эффекты ослабляет: адреналин,
глюкокортикоиды, цАМФ. Усиливает
альдостерон, цГМФ.
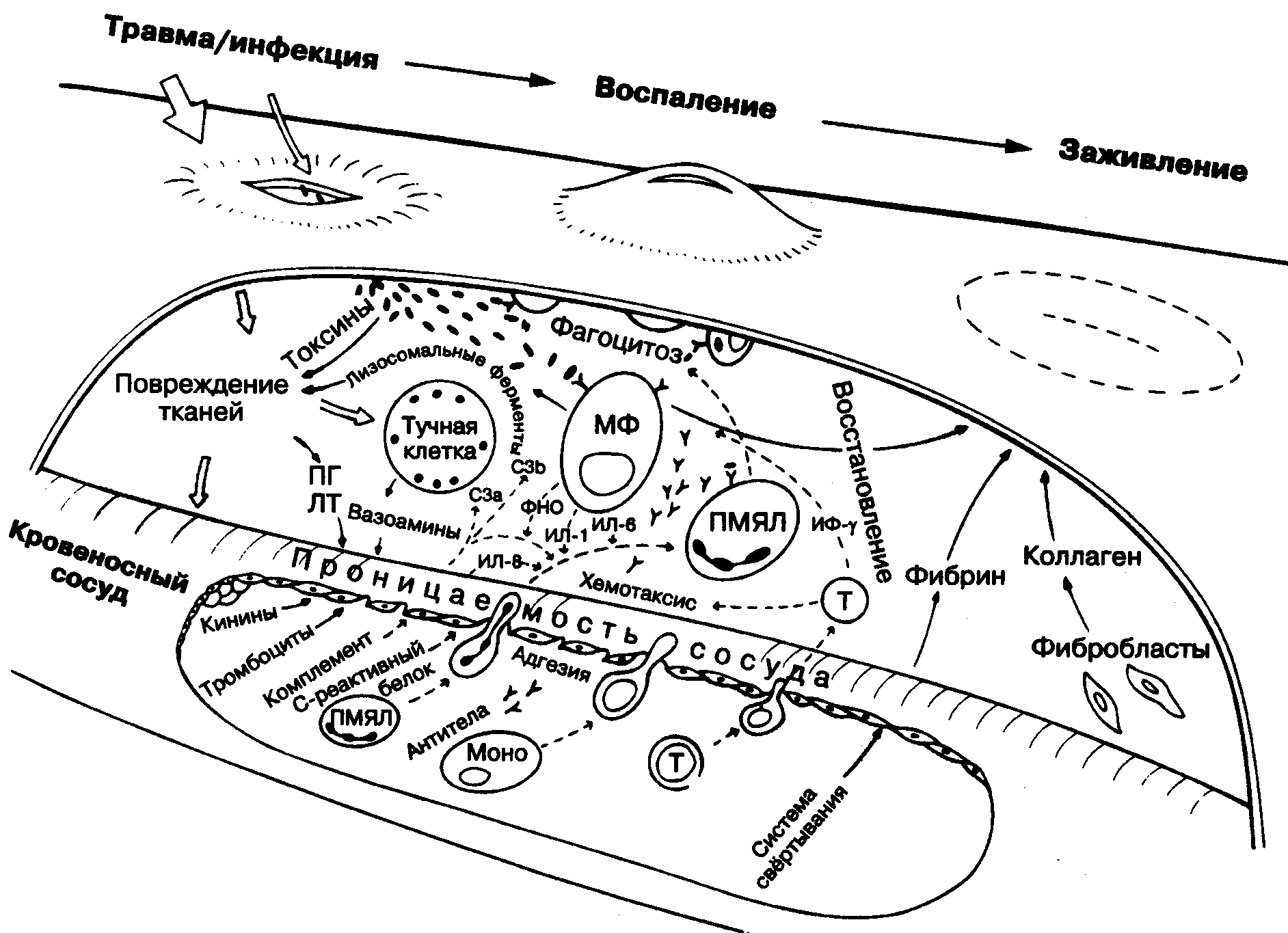
Рис. 10.5. Общая схема
острого воспаления.
Хроническое воспаление. Гранулема.
Хроническое
воспаление
развивается, когда повреждающий агент
действует длительное время, или первично
(при аллергических и аутоиммунных
болезнях), и характеризуется преобладанием
процессов пролиферации.
Причины хронического
воспаления
Слабая реактивность,
чаще у детей и стариков.Слабые сосудистые
реакции.Незавершённый
фагоцитоз.Устойчивые
микроорганизмы (при туберкулёзе,
проказе, листериозе, токсикоплазмозе).Неперевариваемые
объекты — инородные тела (металл,
древесина).
Активация
лимфоцитов как хронический аутоиммунный
процесс бывает при ревматоидном артрите,
системной красной волчанке (СКВ). Этому
способствует изменение антигенной
структуры клеток в очаге воспаления.

Рис. 10.6. Схема
хронического и клеточно-опосредованного
(гранулематозного) воспаления.
Гранулематозное
воспаление
— хроническое
воспаление, вызванное нерастворимыми
или медленно разрушающимися
(персистирующими) раздражителями и
сопровождающееся образованием гранулем,
возникающих в результате пролиферации
и трансформации способных к фагоцитозу
клеток.
Этиологические
факторы гранулематозного воспаления
Эндогенные
труднорастворимые
продукты повреждения тканей, в первую
очередь жировой ткани (например, мыла),продукты нарушенного
обмена, такие, как ураты.
Экзогенные
биологические
факторы (бактерии, грибы, простейшие,
гельминты и т. д.),органические
и неорганические вещества (при пылевых
болезнях — силикоз, талькоз, асбестоз,
биссиноз и др., крахмальные и тальковые
гранулемы, шовные гранулемы, вызванные
экзогенными жирами, сульфатом бария,
ртутью и т. д.), в том числе лекарственные
средства (гранулематозный гепатит,
олеогранулематозная болезнь).
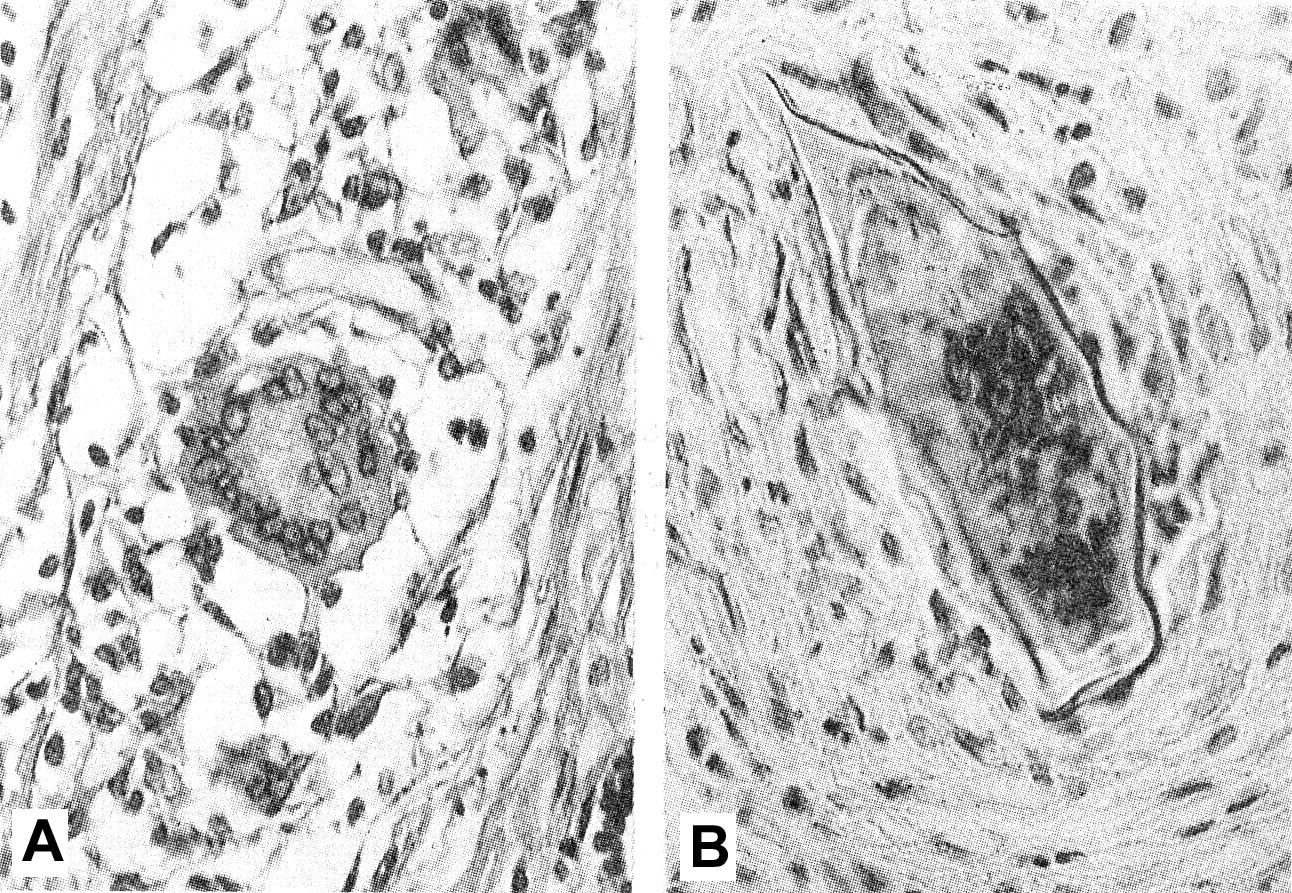
Рис.
10.7. Эпителиоидно-клеточные
гранулемы саркоидного типа.
Примечание.
А — гранулема саркоидного типа в стенке
тонкой кишки при болезни Крона, в центре
гранулемы — гигантская многоядерная
клетка Пирогова-Лангханса (увеличение
в 400 раз); В — гранулема саркоидного типа
вокруг яиц паразита при шистосомозе в
подслизистом слое тонкой кишки (увеличение
в 250 раз).
Длительно
раздражённые макрофаги выделяют
монокины, которые и формируют гранулёму.
Гранулемы
представляют собой компактное скопление
Макрофагов.
Эпителиоидных
клеток.Дополнительные
признаки (могут не быть)
инфильтрация
другими клетками (лимфоцитами,
плазматическими клетками, нейтрофильными
или эозинофильными гранулоцитами);наличием
фибробластов и развитием склероза;развитием
деструктивных изменений и некроза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
1. Приближение (случайное и хемотаксис).
Основныее медиаторы хемотаксиса
· Интерлейкин 8.
· С5а.
· Лейкотриен В4.
· Иммунные комплексы.
· Фактор адгезии тромбоцитов.
· Некротаксин.
· Продукты микроорганизмов.
2. Контакт, распознавание и прилипание.
В процессе распознавания большую роль играет опсонизация — это покрытие объекта фагоцитоза сыворочными факторами — опсонинами (антителами IgG, М и Е, они «метят» объекты, подлежащие элиминации).
Прилипание осуществляется посредством связи опсонинов с рецепторами фагоцитов. Завершенный фагоцитоз идет только с участием опсонинов.
3. Поглощение (механизм: псевдоподии ® фагосомы ® фаголизосомы).
При поглощениее живых микроорганизмов,последние сначала должны быть убиты. В лейкоцитах существует 2 бактерицидных механизма:
· зависящий от кислорода;
· независящий от кислорода.
Зависящий от кислорода бактерицидный фактор связан с образованием активных метаболитов кислорода. Продукция этих веществ начинается после контакта фагоцитов с опсонизированными бактериями. Именно в это время фагоциты, которые в обычных условиях используют энергию анаэробного гликолиза, начинают усиленно поглощать кислород, что обозначают термином респираторный взрыв.
Возникновение его обусловлено активацией цитопламатической НАДФН-оксидазы, которая катализирует одноэлектронное восстановление молекулы кислорода до супероксидного радикального аниона, «отбирая» электрон от восстановленного пиридинового нуклеотида НАДФН:
оксидаза
2О2 + надфн ¾¾¾® 2о2- + надф+ + н+.
Расходуемые во время «респираторного взрыва» запасы НАДФН начинают немедленно восполняться усиленным окислением глюкозы через гексозомонофосфатный шунт.
Большая часть образующихся при восстановлении О2 супероксидных анионов О2- подвергается дисмутации до Н2О2:
2О2- + 2н+ ¾® о2 + н2о2.
Некоторая часть молекул Н2О2 взаимодействует в присутствии железа или меди с супероксидным анионом с образованием чрезвычайно активного гидроксильного радикала ОН·:
О2- + Н2О2 ¾® ОН· + ОН- + О2.
Цитоплазматическая НАДФ·Н-оксидаза активируется в месте контакта фагоцита с микробом, а образование супероксидных анионов происходит на внешней стороне мембраны лейкоцитов, вне внутренней среды клетки. Процесс продолжается и после завершения образования фагосомы, вследствие чего внутри нее создается высокая концентрация бактерицидных радикалов. Проникающие внутрь цитоплазмы фагоцита радикалы нейтрализуются ферментами супероксиддисмутазой и каталазой.
Система образования бактерицидных метаболитов кислорода действует во всех профессиональных фагоцитах. В нейтрофилах совместно с ней действует еще одна мощная бактерицидная система – система миелопероксидазы (сходная с ней пероксидазная система имеется также у эозинофилов, но ее нет у моноцитов и макрофагов).
Миелопероксидаза — фермент, содержащийся в азурофильных гранулах нейтрофилов, катализирует реакцию между ионом галогена (обычно хлора) и перекисью водорода, что приводит к образованию хлорноватистой кислоты (гипохлоритного аниона ОС1-):
миелопероксидаза
CI- + Н2О2 ¾¾¾¾¾¾¾¾® OCI- + Н2О.
Гипохлорит оказывает выраженное бактерицидное действие сам по себе. Кроме того, он может реагировать с аммонием или аминами, образуя бактерицидные хлорамины.
Независящий от кислорода бактерицидный механизм связан с дегрануляцией — поступлением внутрь фагосомы бактерицидных веществ, которые содержатся во внутриклеточных гранулах фагоцитов.
Когда образование фагосомы завершается, к ней вплотную приближаются гранулы цитоплазмы фагоцитов. Мембрана гранул сливается с мембраной фагосомы, и содержимое гранул вливается внутрь фагосомы. Полагают, что стимулом к дегрануляции является увеличение цитозольного Са2+, концентрация которого возрастает особенно сильно вблизи фагосомы, где располагаются органеллы, накапливающие кальций.
Цитоплазматические гранулы всех облигатных фагоцитов содержат большое количество биологически активных веществ, способных убивать и переваривать микроорганизмы и другие поглощенные фагоцитами объекты. В нейтрофилах, например, имеется 3 типа гранул:
· секреторные пузырьки;
· первичные (азурофильные);
· вторичные (специфические) гранулы.
Наиболее легко мобилизуемые секреторные пузырьки облегчают выход нейтрофилов из сосудов, их миграцию в тканях. Уничтожают и разрушают поглощенные частицы вещества азурофильных и специфических гранул. В азурофильных гранулах, помимо уже упомянутой миелопероксидазы, содержатся действующие независимо от кислорода низкомолекулярные бактерицидные пептиды дефенсины, слабое бактерицидное вещество лизоцим и множество разрушающих ферментов; в специфических гранулах лизоцим и белки, останавливающие размножение микроорганизмов, в частности, лактоферрин, связывающий необходимое для жизнедеятельности микроорганизмов железо.
На внутренней мембране специфических и азурофильных гранул находится протонный насос, который переносит водородные ионы из цитоплазмы фагоцита внутрь фагосомы. В результате рН среды в фагосоме понижается до 4-5, что вызывает гибель многих находящихся внутри фагосомы микроорганизмов. После того как микроорганизмы погибают, они разрушаются внутри фагосомы с помощью кислых гидролаз азурофильных гранул.
К числу важных бактерицидных факторов, действующих в активированных макрофагах, следует отнести и продукцию оксида азота (NO), которая осуществляется с помощью индуцибильной NO-синтазы. Фермент этот активируется g-интерфероном, фактором некроза опухолей, ИЛ-1 и другими воспалительными цитокинами. NO действует цитостатически на опухолевые клетки, бактерии, паразиты, вирусы, ингибируя активность многих ферментов, участвующих в синтезе белков и нуклеиновых кислот. Оксид азота может соединяться с О2-, образуя пероксинитрит, который распадается на цитотоксические свободные радикалы ОН· и NO-.
4. Переваривание за счёт сильных эндогенных окислителей и ферментов, таких как гидролазы, комплемент, лизоцим, аргиназа.
Рис. 10.4. Схема фагоцитоза.
Некоторые микроорганизмы (микобактерии, трипаносомы, листерии, сальмонеллы) ингибируют образование фаголизосом, и возбудители персистируют в фагоците. Они сохраняются, оказываясь при этом «отгороженными» мембраной и цитоплазмой фагоцитов от противомикробных лекарств. Последняя (4-я) стадия фагоцитоза не развивается, формируется незавершенный фагоцитоз.
Причины незавершенного фагоцитоза:
1. Дефицит белка.
2. Дефицит витаминов.
3. Наследственные ферментопатии.
4. Иммунодефициты.
5. Особенности возбудителя (его размеры значительно превышают размеры самого фагоцита).
6. Объектом фагоцитоза являются комплексы антиген-антитело, находящиеся на плоской поверхности сосудистого эндотелия.
Как следствие, раздраженные мононуклеары выделяют монокины, лимфокины, которые стимулируют хемотаксис, соседние клетки соединительной ткани и др. Активированные хемоаттрактантами фагоциты способны высвобождать содержимое своих гранул не только внутрь фагосомы, но и во внеклеточное пространство. При этом содержимое гранул и продуцируемые фагоцитами активные метаболиты кислорода воздействуют и на объект атаки, и на ткани организма хозяина. Дистантно развивается лейкоцитоз.
При затяжных воспалительных процессах (сопровождающихся незавершенным фагоцитозом) целесообразно применять
1. Стимуляторы иммунитета, в частности, фагоцитоза
· путем искусственного обострения воспаления, вводя, например, искусственно получаемые эндотоксины бактерий (продигиозан);
· через активацию лимфоцитов иммуностимуляторами (см. тему «Патология иммунитета»).
Создание гипертермии (положительный эффект на активность ферментов, диссоциацию оксигемоглобина).
Витаминотерапию.
Специфическую антибиотикотерапию.
V. Механизмы пролиферации.
Пролиферация — репаративная стадия воспаления, это размножение клеток. Нейтрофилы погибают, макрофаги расчищают поле для регенерации.
Фибробласты — главные эффекторы репарации. Механизм — стимуляция пролиферации через синтез ДНК и митотическую активность.
Начинается с 1 стадии воспаления, а ее пик приходит к 3 стадии.
Источник
