Мононуклеарные клетки при хроническом воспалении
Содержание:
В 1885 году впервые среди острых лимфаденитов русским педиатром И. Ф. Филатовым было выделено инфекционное заболевание, описанное, как идиопатическое воспаление шейных желез. На протяжении длительного времени специалисты отказывались считать данную патологию отдельной нозологической формой, расценивая характерные для болезни изменения со стороны крови, как лейкемоидную реакцию. И только в 1964 году канадские ученые М.Э.Эпштейн и И.Барр открыли возбудителя инфекционного мононуклеоза, в честь которых он и был назван. Другие названия заболевания: моноцитарная ангина, железистая лихорадка, болезнь Пфейфера.
Инфекционный мононуклеоз – это острая антропонозная инфекция, вызываемая вирусом Эпштейна-Барра. Она характеризуется поражением лимфоидной ткани рото- и носоглотки, развитием лихорадочного состояния, лимфоаденопатией и гепатоспленомегалией, а также появлением в периферической крови атипичных мононуклеаров и гетерофильных антител.
Причины
Возбудителем инфекции является малоконтагиозный лимфотропный вирус Эпштейна-Барра (ВЭБ), относящийся к семейству герпетических вирусов. Он обладает оппортуническими и онкогенными свойствами, содержит 2 молекулы ДНК и способен так же, как и другие возбудители данной группы пожизненно персистировать в человеческом организме, выделяясь из ротоглотки во внешнюю среду на протяжении 18 месяцев после первичного инфицирования. У подавляющего большинства взрослых людей выявляются гетерофильные антитела к ВЭБ, что подтверждает хроническое инфицирование данным возбудителем.
Вирус проникает в организм вместе со слюной (именно поэтому в некоторых источниках инфекционный мононуклеоз называется «болезнью поцелуев»). Первичным местом самовоспроизведения вирусных частиц в организме хозяина является ротоглотка. После поражения лимфоидной ткани возбудитель внедряется в В-лимфоциты (главная функция этих кровяных клеток — выработка антител). Оказывая прямое и опосредованное влияние на иммунные реакции, примерно через сутки после внедрения антигены вируса обнаруживаются непосредственно в ядре инфицированной клетки. При острой форме заболевания специфические вирусные антигены обнаруживаются приблизительно в 20% В-лимфоцитов, циркулирующих в периферической крови. Обладая пролиферативным действием, вирус Эпштейна-Барра способствует активному размножению В-лимфоцитов, в свою очередь, стимулирующих интенсивный иммунный ответ со стороны CD8+ и CD3+ Т-лимфоцитов.
Пути передачи инфекции
Вирус Эпштейна-Барра – это повсеместно распространенный представитель семейства герпевирусов. Поэтому инфекционный мононуклеоз можно встретить практически во всех странах мира, как правило, виде спорадических случаев. Зачастую вспышки инфицирования регистрируются в осенне-весенний период. Болезнь может поражать пациентов любого возраста, однако чаще всего страдают от инфекционного мононуклеоза дети, девушки-подростки и юноши. Груднички болеют достаточно редко. После перенесенной болезни практически у всех групп пациентов вырабатывается стойкий иммунитет. Клиническая картина заболевания зависит от возраста, пола и от состояния иммунной системы.
Источниками инфекции являются вирусоносители, а также больные с типичными (манифестными) и стертыми (бессимптомными) формами заболевания. Вирус передается воздушно-капельным путем или посредством инфицированной слюны. В редких случаях возможно вертикальное заражение (от матери к плоду), инфицирование во время трансфузии и при половых контактах. Также существует предположение, что ВЭБ может передаваться через предметы домашнего обихода и алиментарным (водно-пищевым) путем.
Симптомы острого инфекционного мононуклеоза
В среднем длительность инкубационного периода составляет 7-10 дней (по сведениям различных авторов, от 5 до 50 дней).
В продромальном периоде пациенты жалуются на слабость, тошноту, быструю утомляемость, боли в горле. Постепенно негативные симптомы усиливаются, поднимается температура тела, появляются признаки ангины, затрудняется носовое дыхание, припухают шейные лимфатические узлы. Как правило, к концу первой недели острого периода болезни отмечается увеличение печени, селезенки и лимфоузлов на задней поверхности шеи, а также возникновение в периферической крови атипичных мононуклеаров.
У 3-15% больных инфекционным мононуклеозом наблюдается пастозность (припухлость) век, отек шейной клетчатки и кожные высыпания (пятнисто-папулезная сыпь).
Одним из наиболее характерных симптомов заболевания является поражение ротоглотки. Развитие воспалительного процесса сопровождается увеличением и отечностью небных и носоглоточной миндалин. Как следствие, затрудняется носовое дыхание, отмечается изменение тембра (сдавленность) голоса, больной дышит полуоткрытым ртом, издавая характерные «храпящие» звуки. Следует отметить, что при инфекционном мононуклеозе, не взирая на выраженную заложенность носа, в остром периоде заболевания не наблюдаются признаков ринореи (постоянных выделений носовой слизи). Такое состояние объясняется тем, что при развитии заболевания происходит поражение слизистой оболочки нижней носовой раковины (задний ринит). Вместе с тем для патологического состояния характерна отечность и гиперемия задней стенки глотки и наличие густой слизи.
У большинства инфицированных детей (порядка 85%) небные и носоглоточные миндалины покрываются налетами. В первые дни заболевания они сплошные, а затем приобретают вид полосок или островков. Возникновение налетов сопровождается ухудшением общего состояния и повышением температуры тела до 39-40°С.
Увеличение печени и селезенки (гепатоспленомегалия) – еще один характерный симптом, наблюдающийся в 97-98% случаев инфекционного мононуклеоза. Размеры печени начинают изменяться с самых первых дней заболевания, достигая максимальных показателей на 4-10 сутки. Также возможно развитие умеренной желтушности кожи и пожелтение склер. Как правило, желтуха развивается в разгар заболевания и постепенно исчезает вместе с другими клиническими проявлениями. К концу первого, началу второго месяца размеры печени полностью нормализуются, реже орган остается увеличенным на протяжении трех месяцев.
Селезенка, так же, как и печень, достигает своих максимальных размеров на 4-10 день болезни. К концу третьей недели у половины пациентов она уже не пальпируется.
Сыпь, появляющаяся в разгар заболевания, может быть уртикарной, геморрагической, кореподобной и скарлатинозной. Иногда на границе твердого и мягкого неба появляются петихиальные экзантемы (точечные кровоизлияния). Фото сыпи при инфекционном мононуклеозе вы видите справа.
Со стороны сердечно-сосудистой системы не наблюдается серьезных изменений. Возможно возникновение систолического шума, приглушенность сердечных тонов и тахикардия. По мере стихания воспалительного процесса негативные симптомы, как правило, исчезают.
Чаще всего все признаки заболевания проходят через 2-4 недели (иногда через 1,5 недели). В то же время нормализация размеров увеличенных органов может задержаться на 1,5-2 месяца. Также на протяжении длительного времени возможно обнаружение в общем анализе крови атипичных мононуклеаров.
В детском возрасте хронического или рецидивирующего мононуклеоза не бывает. Прогноз благоприятный.
Симптомы хронического мононуклеоза
Данная форма заболевания характерна только для взрослых пациентов с ослабленным иммунитетом. Причиной тому могут некоторые заболевания, длительный прием определенных медикаментозных препаратов, сильные или постоянные стрессы.
Клинические проявления хронического мононуклеоза могут быть достаточно разнообразными. У некоторых больных отмечается увеличение селезенки (менее выраженное, чем в период острой фазы болезни), увеличение лимфатических узлов, гепатит (воспаление печени). Температура тела, как правило, нормальная, или субфебрильная.
Пациенты жалуются на повышенную утомляемость, слабость, сонливость, или же нарушения сна (инсонмию), мышечные и головные боли. Изредка наблюдается болезненность в животе, эпизодическая тошнота и рвота. Зачастую вирус Эпштейна-Барра активизируется у лиц, инфицированных 1-2 типом герпевируса. В таких ситуациях заболевание протекает с периодическими болезненными высыпаниями на губах и наружных гениталиях. В некоторых случаях сыпь может распространяться на другие участки тела. Существует предположение, что возбудитель инфекционного мононуклеоза является одной из причин развития синдрома хронической усталости.
Осложнения
- Отек слизистой оболочки глотки и миндалин, приводящий к закупорке верхних дыхательных путей;
- Разрыв селезенки;
- Менингит с преобладанием в ликворе одноядерных клеток;
- Параличи;
- Поперечный миелит;
- Острый вялый паралич с белково-клеточной диссоциацией в ликворе (синдром Гийена-Баре);
- Психосенсорные расстройства;
- Интерстициальная пневмония;
- Гепатит;
- Миокардит;
- Гемолитическая и апластическая анемия;
- Тромбоцитопеническая пурпура.
Диагностика инфекционного мононуклеоза у взрослых
При постановке диагноза главную роль играют лабораторные исследования крови. В общеклиническом анализе выявляют умеренный лейкоцитоз, в лейкоцитарной формуле – широкоплазменные лимфоциты (атипичные мононуклеары). Чаще всего их обнаруживают в разгар заболевания. У детей данные клетки могут присутствовать в крови на протяжении 2-3 недель. Количество атипичных мононуклеаров, в зависимости от тяжести воспалительного процесса, колеблется от 5 до 50% (и более).
В ходе проведения серологической диагностики в сыворотке крови обнаруживаются гетерофильные антитела, относящиеся к иммуноглобулинам класса М.
С какими заболеваниями можно спутать?
Инфекционный мононуклеоз следует дифференцировать с:
- ОРВИ аденовирусной этиологии с выраженным мононуклеарным синдромом;
- дифтерией ротоглотки;
- вирусным гепатитом (желтушной формой);
- острым лейкозом.
Следует отметить, что наибольшие трудности возникают при дифференциальной диагностике инфекционного мононуклеоза и острой респираторно-вирусной инфекции аденовирусной этиологии, характеризующейся наличием выраженного мононуклеарного синдрома. В данной ситуации к отличительным признакам относят конъюнктивит, насморк, кашель и хрипы в легких, которые не характерны для железистой лихорадки. Печень и селезенка при ОРВИ также увеличивается достаточно редко, а атипичные мононуклеары могут определяться в незначительных количествах (до 5-10%) однократно.
В данной ситуации окончательная постановка диагноза осуществляется только после проведения серологических реакций.
Примечание: клиническая картина инфекционного мононуклеоза, развивающегося у детей первого года жизни, характеризуется некоторыми особенностями. На ранней стадии патологического процесса нередко наблюдается кашель и насморк, пастозность век, одутловатость лица, хрипящее дыхание, полиадения (воспаление лимфатических желез). Для первых трех дней характерно возникновение ангины с налетом на миндалинах, кожных высыпаний и повышение в лейкоцитарной формуле сегментоядерных и палочкоядерных нейтрофилов. При постановке серологических реакций положительные результаты бывают гораздо реже и в более низких титрах.
Лечение инфекционного мононуклеоза
Лечение пациентов с легкими и среднетяжелыми формами заболевания может проводиться на дому (больной должен быть изолирован). В более тяжелых случаях требуется госпитализация в стационар. При назначении постельного режима учитывается степень выраженности интоксикации. В том случае, если инфекционный мононуклеоз протекает на фоне воспаления печени, рекомендуется лечебная диета (стол №5).
На сегодняшний день специфического лечения заболевания не существует. Пациентам проводится симптоматическая терапия, назначается десенсибилизирующее, дезинтоксикационное и общеукрепляющее лечение. При отсутствии бактериальных осложнений прием антибиотиков противопоказан. В обязательном порядке следует выполнять полоскание ротоглотки антисептическими растворами. При гипертоксическом течении и при наличии признаков асфиксии, возникшей вследствие выраженного увеличения миндалин и отека ротоглотки, показан короткий курс лечения глюкокортикоидами.
При лечении затяжных и хронических форм инфекционного мононуклеоза используются иммунокорректоры (препараты, восстанавливающие функцию иммунной системы).
Специфической профилактики заболевания на сегодняшний день не разработано.
Источник
Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
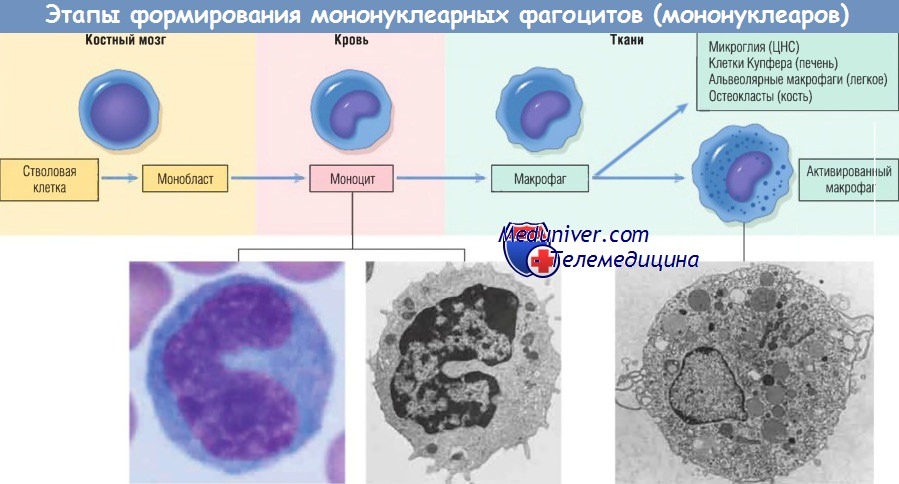
Макрофаг — главная клетка, участвующая в процессе хронического воспаления. Макрофаги являются частью системы мононуклеарных фагоцитов (иногда называемой ретикулоэндотелиальной системой), состоящей из клеток, близкородственных клеткам костного мозга, включая моноциты и тканевые макрофаги.
Тканевые макрофаги диффузно разбросаны по соединительной ткани или расположены в таких органах, как печень (клетки Купфера), селезенка и лимфатические узлы (гистиоциты синусов), легкие (альвеолярные макрофаги), а также в ЦНС (микроглия). Мононуклеарные фагоциты происходят из клеток-предшественников костного мозга, которые дифференцируются в моноциты. Из крови моноциты мигрируют в разные ткани и дифференцируются в макрофаги.
Период полужизни моноцитов длится около 1 дня, когда как период жизни тканевых макрофагов составляет несколько месяцев или лет. Превращение стволовой клетки костного мозга в тканевый макрофаг регулируется различными факторами роста и дифференцировки, цитокинами, молекулами адгезии и клеточными взаимодействиями.
Моноциты начинают мигрировать во внесосудистые ткани на ранних стадиях развития острого воспаления и в течение 48 час могут стать доминирующим типом клеток инфильтрата. Экстравазация моноцитов управляется теми же стимулами, которые участвуют в миграции нейтрофилов и представлены молекулами адгезии и химическими медиаторами с хемотаксическими и активирующими свойствами.
При попадании моноцита во внесосудистую ткань он подвергается трансформации в большую фагоцитарную клетку — макрофаг. Макрофаги активируются различными стимулами, включая микробные продукты, активирующие TLR и другие клеточные рецепторы, цитокины (например, IFN-y), секретированные сенсибилизированными Т-лимфоцитами и естественными клетками-киллерами, и другие химические медиаторы.
В результате активации макрофагов происходят элиминация таких повреждающих агентов, как микробы, и инициация процессов репарации, а также повреждение ткани (при хроническом воспалении).
Активация макрофагов приводит также к повышению уровней лизосомных ферментов и активных форм кислорода и азота, продукции цитокинов, факторов роста и других медиаторов воспаления. Некоторые из этих продуктов токсичны для микробов и организма (например, активные формы кислорода и азота) или ВКМ (протеазы); другие вызывают миграцию клеток (например, цитокины, хемотаксический стимул); третьи влияют на пролиферацию фибробластов, отложение коллагена и ангиогенез (например, факторы роста).
Разные популяции макрофагов выполняют различные функции: некоторые необходимы при киллинге микробов и воспалении, другие очень важны при репарации.
Впечатляющий арсенал медиаторов делает макрофаги мощным союзником организма в защите от непрошеных гостей, но в то же время при неправильной активации макрофаги могут вызывать значительное разрушение ткани, которое является одним из признаков хронического воспаления. Процесс разрушения ткани сам по себе может активировать каскад воспалительной реакции, поэтому одновременно могут присутствовать признаки и острого, и хронического воспаления.
При недолгом процессе воспаления, если стимул удален, макрофаги в итоге либо умирают, либо уходят в лимфатические сосуды и лимфоузлы. При хроническом воспалении происходит накопление макрофагов в результате их мобилизации из кровотока и местной пролиферации в очагах воспаления.
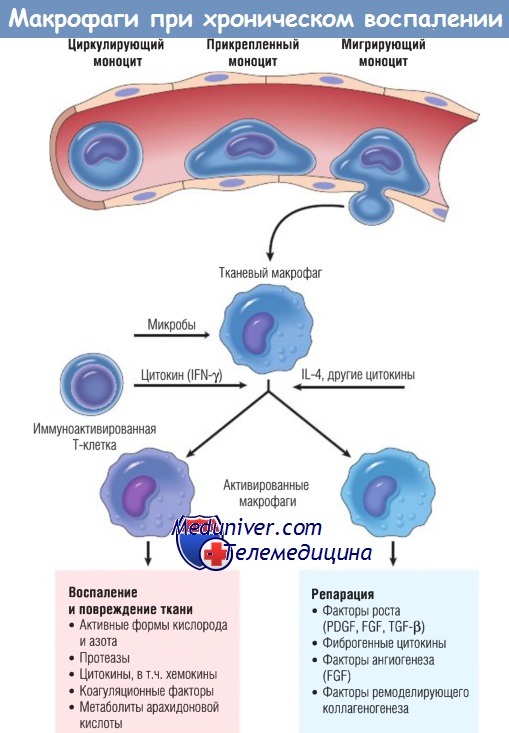
Роль активированных макрофагов при хроническом воспалении.
Макрофаги активируются неиммунными стимулами, например эндотоксином, или цитокинами из иммуноактивированных Т-клеток (особенно IFN-y).
Перечислена продукция активированных макрофагов.
FGF — фактор роста фибробластов; IFN — интерферон; IL — интерлейкин;
PDGF — тромбоцитарный фактор роста; TGF — трансформирующий фактор роста.
В развитии хронического воспаления участвуют и другие типы клеток: лимфоциты, клетки плазмы крови, эозинофилы и тучные клетки:
— лимфоциты мобилизуются в ходе как антителоопосредованных, так и клеточно-опосредованных иммунных реакций. Антиген-стимулированные лимфоциты (эффекторные клетки и клетки памяти) различных типов (Т- и В-клетки) используют разные пары адгезивных молекул (селектинов, интегринов и их лигандов) и хемокины для миграции в очаг воспаления. Цитокины активированных макрофагов, в основном TNF, IL-1 и хемокины, усиливают мобилизацию лейкоцитов, запуская стадию персистенции воспалительной реакции.
Лимфоциты и макрофаги взаимодействуют по реверсивному типу, что играет важную роль в развитии хронического воспаления. Макрофаги презентируют антигены Т-клеткам и продуцируют мембранные молекулы (костимуляторы) и цитокины (например, IL-12), которые стимулируют ответ Т-клеток. Активированные Т-клетки продуцируют цитокины, некоторые из которых мобилизуют моноциты из кровотока, и IFN-y — мощный активатор макрофагов. В результате этих взаимодействий Т-клеток и макрофагов в воспалительную реакцию вовлекается иммунная система, что делает реакцию хронической и тяжелой. Термин «иммунное воспаление» отражает наличие выраженного иммунного компонента в воспалительном процессе, например ответа Т- и В-клеток;
— клетки плазмы крови образуются из активированных В-клеток и продуцируют антитела, направленные либо против персистирующих чужеродных или собственных антигенов в очаге воспаления, либо против компонентов поврежденной ткани. При некоторых сильных воспалительных реакциях скопление лимфоцитов, антигенпрезентирующих клеток и клеток плазмы крови может напоминать морфологическое строение лимфоидного органа, особенно лимфоузла, содержащего хорошо сформированные герминативные центры.
Подобные очаги скопления лимфоцитов называют третичными лимфоидными органами. Такой тип лимфоидного органогенеза часто встречается в синовиальных оболочках у пациентов, длительно страдающих ревматоидным артритом;
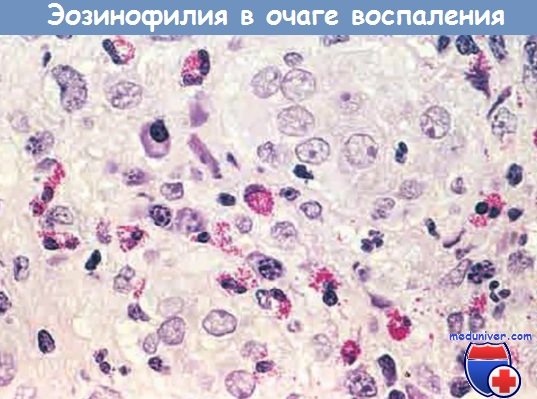
— эозинофилами изобилуют иммунные реакции, опосредованные IgE и паразитарными инфекциями. Особо важный хемокин для мобилизации эозинофилов — эотаксин. Эозинофилы содержат гранулы, имеющие главный основной белок (высокоактивный катионный белок), который токсичен для паразитов, но может вызвать лизис эпителиальных клеток млекопитающих. Таким образом, эозинофилы контролируют паразитарные инфекции, но также участвуют в повреждении ткани при иммунных реакциях, например аллергии;
— тучные клетки широко распространены в соединительных тканях по всему телу и могут участвовать как в острых, так и в хронических воспалительных реакциях. Тучные клетки экспрессируют на своей поверхности рецептор FceRI, связывающийся с Fc-фракцией антитела IgE. При реакции гиперчувствительности немедленного типа антитела IgE связываются с клеточными Fc-peцепторами, специфично распознающими антиген, клетка дегранулируется и высвобождает медиаторы — гистамин и простагландины. Этот тип ответа наблюдается при пищевой аллергии, укусах насекомых, лекарственной аллергии, иногда с ужасающими исходами (например, анафилактическим шоком).
Тучные клетки тоже присутствуют при реакциях хронического воспаления и секретируют множество цитокинов, т.е. они способны как усиливать, так и ограничивать воспалительную реакцию в разных ситуациях.
Как правило, присутствие нейтрофилов характерно для острого воспаления, но и при многих формах хронического воспаления, длящегося месяцами, выявляется большое количество нейтрофилов, индуцированных либо персистирующими микробами, либо медиаторами, продуцированными активированными макрофагами и Т-лимфоцитами. При хронических бактериальных инфекциях костей (остеомиелите) нейтрофильный экссудат может сохраняться многие месяцы. Нейтрофилы также важны при хроническом воспалении в легких, индуцированном курением или другим стимулом.
Помимо мононуклеарного характера клеточного инфильтрата при хроническом воспалении часто происходит пролиферация кровеносных и лимфатических сосудов. Этот процесс стимулируют факторы роста, продуцируемые макрофагами и эндотелиальными клетками.

Очаг воспаления с большим количеством эозинофилов (эозинофилия)
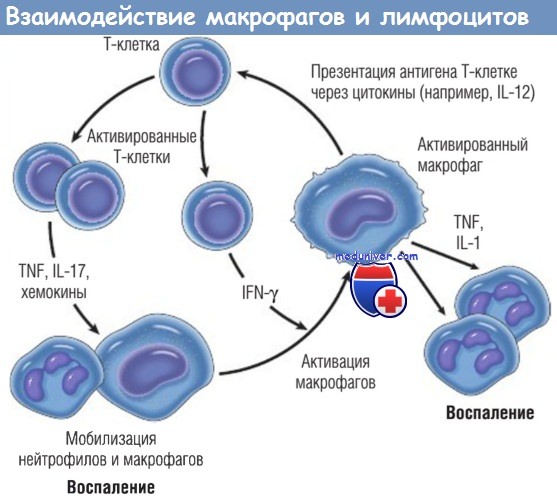
Взаимодействия макрофагов и лимфоцитов при хроническом воспалении.
Активированные Т-клетки продуцируют цитокины, которые мобилизуют макрофаги (TNF, IL-17, хемокины), и IFN-y, который является мощным активатором макрофагов.
Разные типы Т-клеток (Тh1 и Тh17) могут продуцировать различные типы цитокинов.
В свою очередь, активированные макрофаги стимулируют Т-клетки, презентируя им антигены через цитокины (например, IL-12).
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли.
— Рекомендуем ознакомиться со следующей статьей «Причины и механизмы гранулематозного воспаления. Что такое гранулема?»
Оглавление темы «Патофизиология»:
- Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей — репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Источник

