Модель воспаления у крыс
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Казаишвили Ю.Г.
1
Попов Н.С.
1
1 ГБОУ ВПО Тверская государственная медицинская академия Минздрава России
В эксперименте на 30 белых крысах в тесте «формалиновый отек» было показано, что новые производные тиадиазола достоверно уменьшали отек лап у крыс. Противоспалительная активность соединений ЛХТ 3-10 (50 мг/кг) и ЛХТ 10-10 (50 мг/кг), синтезированных во «Всероссийском научном центре безопасности биологически активных веществ», была близка с эффектами кетопрофена (50 мг/кг). В эксперименте на 30 белых крысах в тесте ульцерогенного действия было показано, что новые производные тиадиазола ЛХТ 3-10 и ЛХТ 10-10 не оказывают влияние на слизистую оболочку желудка.
Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ.
ульцерогенный эффект
«формалиновый отек»
противовоспалительная активность
тиадиазол
1. Валеева И. Х., Зиганшина Л. Е., Хазиахметова В. Н., Титаренко А. Ф. Димефосфон проявляет противовоспалительную и антиоксидантную активность на модели хронического аутоиммунного воспаления // Экспериментальная и клиническая фармакология. – 2011. – № 3. – С.13-16.
2. Европейская конвенция «О защите позвоночных животных, используемых для экспериментов или в иных научных целях». – 1986 [Электронный ресурс]. – URL: https://www.lawmix.ru/abro.php?id=11036 (дата обращения: 16.10.2011).
3. Зарудий Р. Ф., Мышкин В. А., Зарудий Ф. С. Противоязвенное действие дибунола (тонарола) // Экспериментальная и клиническая фармакология. – 1998. – Т. 61, № 5. – С. 21-23.
4. Об утверждении Правил лабораторной практики: Приказ Минздравсоцразвития РФ от 23 августа 2010 г. N 708н: зарегистр. в Минюсте Рос. Федерации 13 октября 2010 г. N 18713 // Рос. газ. – 2010. – 22 октября.
5. Прозоровский В. Б., Прозоровская М. П. Табличный метод определения ЕД50 (DL50) веществ с низкой биологической активностью //Фармакология и токсикология. – 1980. – № 6. – C. 733-735.
6. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей редакцией чл.-корр. РАМН проф. Р. У. Хабриева. – 2-изд., перераб. и доп. – М.: Медицина, 2005. – 832 с.
7. Сернов Л. Н. Элементы экспериментальной фармакологии / Л. Н. Сернов, В. В. Гацура. – М.: ВНЦ БАВ, 2000. – 352 с.
8. Судакова О. А., Демидова М. А. Исследование противовоспалительной активности новых производных гидрохинонсульфокислоты // Современные проблемы науки и образования. – 2012. – № 2.
Введение
Воспалительный процесс является ведущим патогенетическим звеном многих заболеваний, которые составляют около 80 % всей патологии в практике врача любой специальности. В настоящее время в комплексной терапии острых и хронических заболеваний для купирования боли и уменьшения выраженности воспалительной реакции применяют большое число лекарственных препаратов преимущественно из группы нестероидных противовоспалительных средств и глюкокортикостероидов. Однако наряду с благоприятным фармакологическим действием и достаточной степенью клинической эффективности, все они вызывают ряд нежелательных побочных реакций. В связи с этим остается актуальным поиск высокоэффективных лекарственных средств, подавляющих воспаление и обладающих минимальными побочными реакциями [3].
Известно, что в патогенезе воспаления значительную роль играют свободные радикалы, которые обладают высокой реактогенной способностью. Образование свободных радикалов является физиологической реакцией, но при чрезмерной активации и высоких концентрациях свободных радикалов происходит повреждение мембран клеток и субклеточных структур, что приводит к развитию заболеваний. Одним из подходов в лечении таких заболеваний, патогенетическим фактором которых является свободно-радикальная патология, является использование антиоксидантов.
Известно, что антиоксиданты различной химической структуры обладают противовоспалительными свойствами как при внутреннем, так и при наружном применении (мексидол, димефосфон, витамин Е и др.) [1]. В связи с этим перспективным направлением поиска лекарств является исследование новых противовоспалительных препаратов с антиоксидантной активностью при лечении воспалительных заболеваний широкого круга.
Целью настоящего исследования явилась оценка противовоспалительной активности новых производных тиадиазола на модели «формалиновый отёк лапы» у крыс.
Материалы и методы исследования
Изучение противовоспалительной активности новых производных тиадиазола проводили на модели «острый формалиновый отёк лапы» у крыс [7]. Эксперименты выполнены на 30 белых неинбредных крысах обоего пола массой 170,2±1,2 г. Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22–24; относительной влажности воздуха 40–50 %) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ [4], а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1986) [3]. Перед постановкой эксперимента животные проходили карантин в течение 10–14 дней [6, 7].
Противовоспалительную активность производных тиадиазолов оценивали в экспериментах на модели «формалинового» отека лапы. Острый воспалительный отек вызывали субплантарным введением (под подошвенный апоневроз) в заднюю правую лапу крысы 0,1 мл 2 % водного раствора формалина. Выраженность отека оценивали, измеряя толщину лапки подопытного животного с помощью инженерного электронного штангенциркуля Vorel 15240 (Польша) до и через 2, 4, 6 часов, а также в динамике через 24 и 48 часов после введения раствора формалина. Противовоспалительную активность исследуемых соединений выражали в процентах угнетения отека.
Исследовали действие двух новых производных тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10, синтезированных в ОАО «Всероссийский центр по изучению безопасности биологически активных веществ» (ВНЦ БАВ, Россия, Старая Купавна). Перед введением исследуемые вещества разводили в изотоническом растворе натрия хлорида и вводили внутрибрюшинно в терапевтической дозе равной 1/20 LD50 (50 мг/кг). Значение LD50 рассчитывали по данным токсикологических исследований. Оценку острой токсичности новых производных тиадиазола при их однократном внутрибрюшинном введении крысам проводили методом Прозоровского В. Б., Прозоровской М. П. (1980) [5].
Подопытные животные были разделены на 4 группы (по 7 крыс в каждой): 1) крысы, получавшие внутрибрюшинно ЛХТ 3-10 в дозе 50 мг/кг до введения формалина, 2) крысы, получавшие внутрибрюшинно ЛХТ 10-10 в дозе 50 мг/кг до введения формалина, 3) крысы, получавшие внутрибрюшинно кетопрофен в дозе 50 мг/кг до введения формалина, 4) крысы контрольной группы, получавшие внутрибрюшинно изотонический раствор натрия хлорида.
Результаты исследования обработаны статистически с применением стандартного пакета программ MicrosoftOfficeExcel 2003. Для ряда выборок вычисляли среднюю арифметическую и среднюю квадратическую ошибку. Определение нормальности распределения переменных проводили на основании гистограмм распределения, величины асимметрии и эксцесса. Для оценки достоверности различий выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента. За достоверное принимали различие при уровне вероятности 95 % и более (p <0,05).
Результаты и осуждение
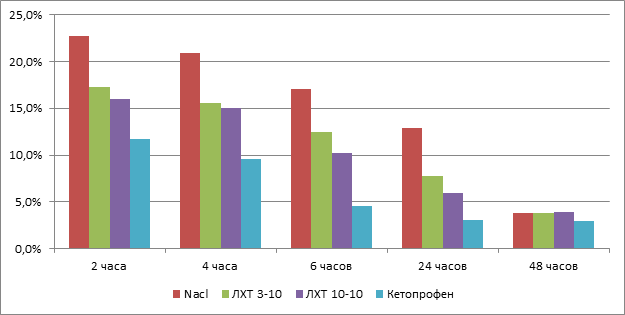
Было выявлено, что при субплантарном введении 0,1 мл 2 % раствора формалина у подопытных крыс развивается выраженный отек лапы, о чем свидетельствует достоверное увеличение ее объема. Отмечено, что максимальный отёк лапки (пик воспаления) развивался через 2 часа после введения формалина, при этом объем лапы у подопытных животных контрольной группы увеличивался в среднем на 29 % (р<0,05). Через 48 часов после введения формалина различий в выраженности отёка в опыте и контролем выявлено не было.
При внутрибрюшинном введении исследованных производных тиадиазола также как и в серии опытов с использованием кетопрофена отмечалось уменьшение выраженности «формалинового» отёка. Так, было выявлено, что уже через 2 часа после введения кетопрофена отек лапы был достоверно меньше на 12,5 %, а после введения производных тиадиазолов ЛХТ 3-10 и ЛХТ 10-10 в среднем на 8 % по сравнению с контролем. Достоверных отличий между самими производными тиадиазола ЛХТ 3–10 и ЛХТ 10–10 обнаружено не было.
При внутрибрюшинном введении кетопрофена (50 мгкг) выраженность отека лапы подопытных животных была в среднем меньше, чем в контроле.
Таблица 1. Изменение толщины лапы крыс под влиянием производных тиадиазола и кетопрофена на выраженность «формалинового» отека лапы у крыс при формалиновом отеке
Серия опыта | до | 2 часа | 4 часа | 6 часов | 24 часов | 48 часов |
Nacl | 3,77±0,09 | 4,88±0,09* | 4,77±0,09* | 4,55±0,09* | 4,30±0,09* | 3,83±0,09 |
ЛХТ 3-10 | 3,77±0,09 | 4,56±0,09* | 4,47±0,09* | 4,31±0,09* | 4,09±0,09* | 3,84±0,09 |
ЛХТ 10-10 | 3,77±0,09 | 4,49±0,09* | 4,44±0,09* | 4,20±0,09* | 4,01±0,09* | 3,85±0,09 |
Кетопрофен | 3,77±0,09 | 4,27±0,09* | 4,17±0,09* | 3,96±0,09* | 3,89±0,09 | 3,83±0,09 |
Примечание: * – различия с контролем (до опыта) достоверны (р<0,05).
Через 6 часов объем лапы у подопытных животных, получавших кетопрофен при «формалиновом отеке», достоверно не отличался от его значения до введения формалина.

Рис.1. Влияние кетопрофена и новых производных тиадиазола на выраженность формалинового отека лапы крыс
Исследование также показало, что соединение ЛХТ 3-10 и ЛХТ 10-10 проявляют антиэкссудативный эффект, который отмечен через 2, 4, 6 часов от начала эксперимента, а также через 24 часа после введения формалина и сопоставим по силе эффекта и скорости его развития таковой у препарата сравнения кетопрофена.
Введение подопытным животным вещества под лабораторным шифром ЛХТ 3-10 и ЛХТ 10-10 в дозе 50 мг/кг снижало прирост объёма отека на 10 % (p<0,05) по сравнению с животными контрольной группы.
Препарат сравнения кетопрофен также препятствовал развитию воспалительной реакции, уменьшая прирост отека на 29,7 % (p<0,05), что в среднем в 1,1 раза (p<0,05) меньше, чем в группе животных, получивших ЛХТ 3-10, ЛХТ 10-10.
Уменьшение признаков острого экссудативного воспаления в группе крыс, которые получали ЛХТ 3-10, ЛХТ 10-10 и кетопрофен, было отмечено через 4 часа после введения формалина.
Таким образом, результаты экспериментального исследования показали, что среди производных тиадиазола имеются соединения, обладающие противовоспалительной активностью. Возможно, что противовоспалительные свойства новых производных тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 связаны с их антиоксидантными свойствами, обусловленными наличием в их химической структуре пиколиновой и янтарной кислоты.
Полученные результаты позволяют рекомендовать исследуемые соединения с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 для расширенных доклинических испытаний потенциальных лекарственных средств с и противовоспалительной активностью.
Учитывая тот факт, что большинство НПВС обладает ульцерогенной активностью, на следующем этапе экспериментальных исследований оценивали изменения слизистой оболочки желудка у крыс, получавших внутрижелудочно производные тиадиазола.
Анализ результатов показал, что из исследованных 5 новых производных тиадиазола с лабораторными шифрами ЛХТ 1-10, ЛХТ 3-10, ЛХТ 10-10, ЛХТ 12-10, ЛХТ 14-10 низкая выраженность ульцерогенного эффекта наблюдалась у производных тиадиазола с шифрами ЛХТ 3-10 и ЛХТ 10-10. Производные тиадиазола (ЛХТ 1-10, ЛХТ 12-10, ЛХТ 14-10) наряду с препаратом сравнения индометацином вызывали значительные повреждения слизистой оболочки в виде язв, эрозий, кровоподтеков.
Таблица 2
Выраженность ульцерогенного действия новых производных тиадиазола и индометацина при внутрижелудочном введении у крыс
№ | Серия опыта | Доза мг/кг | Ульцерогенная активность (баллы) |
1. | 1-10 | 50 | 2±0,21 |
2. | 3-10 | 50 | 0,25±0,05* |
3. | 10-10 | 50 | 0,25±0,06* |
4. | 12-10 | 50 | 2,5±0,19 |
5. | 14-10 | 50 | 2,5±0,29 |
6. | индометацин | 50 | 2,5±0,15 |
Примечание: * – различия с контролем (до опыта) достоверны (р<0,05).
В последние годы сформировалась новая точка зрения на механизмы повреждения слизистой ЖКТ. Многие исследователи считают, что этот механизм комплексный и обусловлен не только торможением нестероидными противовоспалительными препаратами синтеза простогландинов и нарушением синтеза мукополисахаридов, но и снижением разности трансмукозного потенциала в желудке и повышением обратной диффузии ионов H+, а в кислой среде – проницаемости апикальных мембран слизистой желудка может быть только предпосылкой для формирования повреждений, но одного этого механизма недостаточно для развития повреждений, вызываемых ацетилсалициловой кислотой. В механизме ульцерогенного действия НПВП определенную роль играет и повышение интенсивности перекисного окисления липидов. Образующиеся в результате действия НПВП продукты свободно-радикального окисления принимают участие в поражении ЖКТ, а также могут участвовать в разрушении мукополисахаридов. Есть данные литературы, показывающие, что антиоксиданты уменьшают повреждающее действие НПВП (АСК, индометацина и др). Противоязвенный эффект витамина С, α-токоферола, метилурацила обьясняют именно антиоксидантным механизмом [3].
Следует отметить, что в структуру новых производных тиадиазола входят янтарная (ЛХТ 10-10) и пиколиновая (ЛХТ 3-10) кислоты, придающие соединениям антиоксидантные свойства, что, возможно, имеет значение для реализации их фармакологической активности.
Таким образом, результаты экспериментального исследования показали, что среди производных тиадиазола имеются соединения, обладающие противовоспалительной активностью. Возможно, что противовоспалительные свойства новых производных тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 связаны с их антиоксидантными свойствами, обусловленными наличием в их химической структуре пиколиновой и янтарной кислоты.
Полученные результаты позволяют рекомендовать исследуемые соединения с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 для расширенных доклинических испытаний потенциальных лекарственных средств с их противовоспалительной активностью.
Таким образом, результаты экспериментального исследования показали, что среди производных тиадиазола имеются вещества, обладающие анальгетической и противовоспалительной активностью.
Выводы
1. Среди производных тиадиазола имеются соединения с противовоспалительной активностью.
2. Новые производные тиадиазола с лабораторными шифрами ЛХТ 3-10 и ЛХТ 10-10 при внутрибрюшинном введении в дозе 50 мг/кг (1/20 LD50) уменьшают выраженность формалинового отека лапы у крыс на 8 %
3. Противовоспалительная активность кетопрофена была в среднем в 1,1 раза (р<0,05) выше, чем новых производных тиадиазола с шифрами ЛХТ 3-10 и ЛХТ 10-10.
4. Ульцерогенной активности у новых производных тиадиазола под шифрами ЛХТ 3-10 и ЛХТ 10-10 не наблюдалось.
Рецензенты:
Филлипова О. В., д-р мед. наук, профессор, профессор кафедры фармации последипломного образования БГОУ ВГУ, г. Воронеж.
Платонов И. А., д-р мед. наук, профессор кафедры фармакологии с курсом фармации ФПК и ППС Смоленской государственной медицинской академии, г. Смоленск.
Библиографическая ссылка
Казаишвили Ю.Г., Попов Н.С. ИССЛЕДОВАНИЕ ПРОТИВОСПАЛИТЕЛЬНОЙ АКТИВНОСТИ НОВЫХ ПРОИЗВОДНЫХ ТИАДИАЗОЛА ПРИ ФОРМАЛИНОВОМ ОТЕКЕ ЛАПЫ У КРЫС // Современные проблемы науки и образования. – 2013. – № 3.;
URL: https://science-education.ru/ru/article/view?id=9598 (дата обращения: 15.05.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Изобретение относится к экспериментальной медицине, а именно к моделированию артифициального флегмонозного воспаления мягких тканей. Для этого лабораторному животному (крысе) в одном шприце однократно вводят смесь, состоящую из человеческой слюны в количестве 0,3 мл, раствора дексаметазона 0,5 мг, суспензии гидрокортизона ацетата 2,5% в дозировке 20 мг на 100 г массы тела. Смесь вводят в мышцы бедра тазовой конечности крысы. Способ позволяет в 86% случаев моделировать воспаление в мягких тканях, приближенное по клиническому течению к артифициальному гнойно-воспалительному заболеванию мягких тканей у человека при простоте, доступности, экономичности методики, достижении результата в течение 3-х суток. 1 ил., 1 табл., 4 пр.
Способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии.
Изобретение относится к области экспериментальной медицины и может быть использовано для моделирования артифициального гнойно-воспалительного заболевания мягких тканей у крыс.
Актуальность. Гнойная инфекция в хирургии занимает особое место среди наиболее важных проблем клинической медицины и с течением времени ее актуальность приобретает все большую значимость в практической деятельности любого хирурга (Ерюхин Р.Б., 2003). Особое место среди гнойно-воспалительных заболеваний занимают артифициальные заболевания. Экономические затраты на обследование и консервативное лечение одного пациента с артифициальным заболеванием составляют около 32 тыс.долларов США в месяц, а при выполнении операции могут достигать 168 тыс.долларов США (Baktari J.В. at al., 1994). В России сводные данные на финансовые затраты по лечению данной категории больных отсутствуют.
Актуальным остается изучение клинико-микробиологических и морфологических характеристик артифициального гнойно-воспалительного заболевания мягких тканей, вызванного введением наиболее часто используемых инфицированных, нестерильных биологических жидкостей человека или нефтепродуктов.
Известны модели ран у лабораторных животных, где авторы используют изоляты штаммов либо микстинфекцию наиболее часто встречающихся патогенов внутригоспитальной антибиотикорезистентной флоры, вызывающих флегмоны на фоне иммуносупрессии. Данные способы имеют существенные недостатки, так как при инфицировании человеческой слюной вирулентный симбиоз микроорганизмов полости, а не одного или нескольких изолятов, приводит к образованию флегмоны с быстропрогрессирующим течением, как правило, анаэробной в более короткие сроки. Известен способ моделирования околочелюстной флегмоны у белых лабораторных крыс породы Wistar путем введения 2-кратно 2,5% эмульсии гидрокортизона ацетата в дозе 20 мг на 100 г массы тела животного. Затем двукратно вводят культуру золотистого стафилококка в дозе по 400 млн микробных тел под надкостницу нижней челюсти (Патент №2442224 РФ Маликова С.Г., 2012). Существенным недостатком в указанных методиках является использование открытых ран для инфицирования. При инъекции слюны в мягкие ткани наличие бескислородной среды способствует росту анаэробной флоры, содержащейся в полости рта. Все вышеуказанные способы формирования флегмоны не учитывали особенности повреждения мягких тканей при артифициальных гнойно-воспалительных заболеваниях мягких тканей, вызванных путем введения бактериально загрязненных жидкостей, например человеческая слюна, моча, кал. Для создания модели артифициальной флегмоны и достоверности сопоставления результатов с наиболее часто встречающимися клиническими наблюдениями целесообразно выполнять инфицирование мягких тканей путем инъекции человеческой слюны.
Для создания эффективной модели необходим фон иммунологической недостаточности, который, как известно, характерен для лиц призывного возраста, вызывающих артифициальные заболевания (Новоженов В.Г. и соавт., 1997; Покровский В.И., 1994). Нами предложена инъекция человеческой слюны в объеме 0,3 мл с глюкокортикоидами короткого и длительного действия в мышцы области бедра тазовой конечности лабораторной крысы, что позволяет эффективно снизить как местный, так и общий иммунный ответ и пролонгировать глюкортикоидный эффект без многократного повторного введения. Сила глюкокортикоидной активности дексаметазона превышает таковую гидрокортизона ацетата в 7 раз, а его максимальное действие наступает через 12 часов, за счет более медленного метаболизирования в организме и сохраняется на протяжении 3 суток («Регистр лекарственных средств России» 2000-2014 гг.). Использовали гидрокортизона ацетата 20 мг на 100 г массы тела животного, дозировка которого намного превышает терапевтическую, (Патент №2442224 РФ Маликова С.Г., 2012) в местной инъекции в сочетании со слюной в количестве 0,3 мл и дексаметазоном 0,5 мг — терапевтическая концентрация.
В эксперименте использовали крыс породы Wistar, самцов массой 180-220 грамм. Выбор крыс-самцов диктуется необходимостью получения стабильных результатов, исключая влияние циклических изменений, характерных для организма самок. Это позволяет стандартизировать условия проведения экспериментальных исследований. На основании данных ряда исследователей для создания модели артифициального гнойно-воспалительного заболевания мягких тканей на лабораторных животных решили использовать инъекцию человеческой слюны. Все вмешательства проводили в стерильных условиях под общим обезболиванием. На момент инъекции инфицирующего агента крыса на несколько секунд помещалась в фиксатор, в роли фиксатора использовали прозрачную пластиковую бутылку, «устройство для фиксации мелких лабораторных животных» (патент РФ №2461368).
Задача изобретения состоит в том, чтобы разработать способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии, вызванного путем введения нестерильной биологической жидкости — человеческой слюны.
Технический результат состоит в том, чтобы в короткие сроки, на 3-е сутки, добиться возникновения быстро прогрессирующей флегмоны мягких тканей у крыс путем введения нестерильной биологической жидкости — человеческой слюны на фоне искусственной иммуносупрессии.
Технический результат достигается тем, что в одном шприце животному — крысе — в мышечный массив области бедра тазовой конечности, что изображено на Фиг. 1, через предварительно деэпелированный и обработанный антисептиком участок кожи вводят смесь двух препаратов: 2,5% эмульсии гидрокортизона ацетата в дозе 20 мг на 100 г массы тела животного, раствор дексаметазона 0,5 мг и человеческой слюны в количестве 0,3 мл. На Фиг. 1 схематически представлена инъекция инфицирующей смеси с глюкокортикоидами в мышцы области бедра тазовой конечности крысы, на которой отмечены: 1 — инсулиновый шприц, содержащий инфицирующую смесь и глюкокортикоиды, 2 — тазовая конечность, 3 — область бедра, 4 — область голени. Слюна получена у студентов-добровольцев ГБОУ ВПО «Дальневосточного государственного медицинского университета» г. Хабаровск, призывного возраста. С целью увеличения титра микробных сообществ, специальной частью на тыльной стороне головки зубной щетки, вначале подметающими движениями — от корня к кончику — счищали налет, слизь на одной половине языка, затем другой и, очистив язык слюной, сплевывали в стерильную пробирку.
В течение всего времени с момента введения контролировалось состояние крыс. На 3-е сутки после введения слюны отмечали снижение двигательной активности, аппетита, появление обширной инфильтрации тканей бедра у места инъекции. На 5-е сутки снижение массы тела на 10%, загрязнение наружных покровов. На 6-е сутки сформировалась флегмона с распространением гнойного воспаления на соседние анатомические области. На 12-е сутки эксперимента 60% животных умерли, что детально продемонстрировано в примере 1, на 14-е сутки еще 20% умерли и у 20% воспалительный процесс привел к абсцессу.
По предлагаемому способу получена модель артифициального гнойно-воспалительного заболевания мягких тканей у 30 из 35 крыс, использовавшихся в эксперименте. Эксперимент проведен нами на белых крысах самцах массой 180-220 граммов, которые методом случайных чисел разделены на группы, по 35 крыс в каждой: опытная 1-я группа, группа сравнения 2-я группа и контрольная 3-я группа. В 1-й группе, как показано в примере 1, создан системный иммунодефицит и местное противовоспалительное действие одномоментным введением человеческой слюны 0,3 мл в мышечный массив тазовой конечности и смеси гидрокортизона ацетата 2,5% в дозе 20 мг на 100 г массы тела крысы и дексаметазона в дозе 0,5 мг. Во 2-й группе вводили только человеческую слюну в количестве 0,3 мл в мышечный массив тазовой конечности без индуцирования иммуносупрессии, что показано в примере 2. В 3-й группе крысам вводили физиологический раствор 0,9% NaCl в количестве 0,3 мл в мышечный массив тазовой конечности, что наглядно показано в примере 2. Данные исследования включены в таблицу 1.
В 1-й группе на 3-е сутки отмечались клинические проявления воспаления, наличие обширного инфильтрата мягких тканей в месте инъекции триггерной смеси. На 5-е сутки снижение массы тела на 10%, снижение двигательной активности, наружные покровы становились грязные, распространение гнойного воспаления на спинку. На 10-е сутки потеря в массе до 30%, резкое снижение двигательной активности, отказ от приема пищи. На 12-е сутки 26 крыс умерли на фоне разлитого гнойного воспаления мягких тканей тазовой конечности, на 14-е сутки умерли еще 4 крыс и у 5 оставшихся крыс сформировался абсцесс. При вскрытии умерших животных установлено, что флегмона распространялась на мягкие ткани всей тазовой конечности и прилежащие области. При разрезе из раны под давлением истекал жидкий коричневый гной с пузырьками газа и зловонным запахом. Пораженные серо-коричневые пропитанные гноем ткани имели дряблую консистенцию. Кроме того, на стороне поражения имелись признаки регионарного лимфаденита — увеличение и уплотнение лимфатических узлов.
Во 2-й группе клинические проявления местного воспаления начали проявляться на 6-е сутки, формирование абсцесса на 10-е сутки. Животные 2-й группы забиты, выведены из эксперимента на 12-е сутки, при вскрытии обнаружены скудные изменения в виде абсцесса с гнилостным запахом, инфильтрация прилежащих тканей, гиперплазия лимфатических узлов на стороне поражения. При посеве материала на питательную среду в 1-й и 2-й группах получен рост: Candida spp., Enterococcus faecalis, E. coli, S. aureus, что соответствует резидентной флоре полости рта и результатам посевов, полученных при клинических наблюдениях.
В 3-й группе клинических проявлений местного воспаления не наблюдали. При вскрытии: тазовая конечность — вариант нормы. В микробиологических посевах стерильно.
Преимущества способа моделирования артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии состоят в следующем:
1. Инфицирующий биологический материал не требует долгого и технически сложного процесса приготовления и титрования, затрат на текущий материал.
2. Инъекция человеческой слюны на фоне иммуносупрессии позволяет в эксперименте смоделировать воспалительный процесс, приближенный по клиническому течению к артифициальному гнойно-воспалительному заболеванию мягких тканей у человека.
3. Получение флегмонозного воспаления мягких тканей у крыс в короткие сроки, до 3 суток, что приближено к клинической картине течения артифициальной флегмоны.
4. Предложенный способ позволяет воспроизвести флегмонозное воспаления мягких тканей у крыс в 86% случаев, что в отличие от аналогов более эффективно.
Для иллюстрации положений предлагаются следующие примеры.
Пример 1
Самцу белой крысы, массой 186 г для индукции артифициального флегмонозного воспаления мягких тканей через предварительно деэпелированный и обработанный антисептиком участок кожи тазовой конечности в одном шприце было введено: 0,3 мл человеческой слюны, гидрокортизона ацетата в дозе 20 мг на 100 г веса (38 мг), дексаметазона 0,5 мг. На 3-е сутки после введения инфекта отмечали выраженную инфильтрацию тканей. На 6-е сутки распространение гнойного воспаления на спинку. На 12-е сутки — смертельный исход. Проведено гистологическое исследование тазовой конечности. При исследовании гистологических образцов: поперечнополосатая мышечная ткань с наличием очага некротической ткани в виде эозинофильных масс с базофильными включениями, вокруг которых скопления нейтрофильных лейкоцитов распадающихся и неизмененных с фагоцитированными кокками, палочками, за которыми следует слой грануляционной ткани с большим количеством эозинофильных лейкоцитов и новообразованных капилляров. Заключение: гнойно-некротическое воспаление мышечной ткани.
Пример 2
Самцу белой крысы, массой 200 г для индукции артифициального гнойно-воспалительного заболевания мягких тканей было введено через предварительно деэпелированный и обработанный антисептиком участок кожи тазовой конечности: 0,3 мл слюны. На 3-е сутки после введения инфекта отмечали невыраженную инфильтрацию тканей. На 6-е сутки формирование абсцесса в месте инъекции. На 12-е сутки без существенной динамики. На 18-е сутки некроз участка кожи над абсцессом. На 21-е сутки дренирование абсцесса наружу. Животное было умерщвлено под эфирным наркозом путем перерезки спинного мозга с соблюдением правил эвтаназии. Проведено гистологическое исследование тазовой конечности. При исследовании гистологических образцов: в пяти срезах поперечнополосатая мышечная ткань с наличием хронического гранулирующего воспаления с большим количеством лимфоцитов, плазматических клеток, макрофагов, с примесью гранулоцитов, пролиферацией сосудов, с очаговыми скоплениями гемосидерофагов, наличие очага некротической ткани. Заключение: хроническое воспаление, гнойно-некротическое воспаление мышечной ткани.
Пример 3
Самцу белой крысы массой 190 г деэпелировали и обработали антисептиком участок кожи задней конечности и ввели 0,3 мл 0,9% NaCl. За время наблюдения 21 день — без признаков воспаления. Животное было умерщвлено под эфирным наркозом путем перерезки спинного мозга с соблюдением правил эвтаназии. Проведено гистологическое исследование задней конечности. При исследовании гистологических образцов: в пяти срезах поперечнополосатая мышечная. Заключение: вариант нормы.
Пример 4
Самцу белой крысы, массой 210 г для индукции артифициального флегмонозного воспаления мягких тканей введено в одном шприце через предварительно деэпелированный и обработанный антисептиком участок кожи задней конечности: 0,3 мл человеческой слюны, гидрокортизона ацетата в дозе 20 мг на 100 г веса (40 мг), дексаметазона 0,5 мг. На 3-е сутки отмечали при контакте болезненность в месте инъекции. На 5-е сутки плотный инфильтрат. На 8-е сутки формирование абсцесса в месте инъекции. На 12-е сутки без существенной динамики. На 18-е сутки некроз участка кожи над абсцессом. На 20-е сутки дренирование абсцесса наружу. Животное было умерщвлено под эфирным наркозом путем перерезки спинного мозга с соблюдением правил эвтаназии. Проведено гистологическое исследование тазовой конечности. При исследовании гистологических образцов: в пяти срезах поперечнополосатая мышечная ткань с наличием хронического гранулирующего воспаления с большим количеством лимфоцитов, макрофагов, с примесью гранулоцитов, пролиферацией сосудов наличие очага некротической ткани. Заключение: хроническое воспаление, гнойно-некротическое воспаление мышечной ткани.

Способ получения лабораторной модели артифициального флегмонозного воспаления мягких тканей у крыс на фоне искусственной иммуносупрессии, включающий инъекцию гидрокортизона ацетата 2,5% в дозе 20 мг на 100 г массы тела, отличающийся тем, что гидрокортизона ацетат одновременно набирают в шприц с дексаметазоном в дозе 0,5 мг и в этот же шприц добирают человеческую слюну в количестве 0,3 мл, предварительно забранную в стерильную пробирку, затем вводят в мышцы бедра тазовой конечности крысы.
Источник
