Миграция клеток при воспалении
Хемотаксис и миграция клеток Ключевой момент миграции клеток — это их прилипание (распластывание, адгезия) к сосудистому эндотелию воспаленных тканей в результате взаимодействия особых молекул на поверхности лейкоцитов и активированных эндотелиальных клеток рис. 1.16). Проникнув в ткани, клетки мигрируют в направлении очага инфекции под влиянием химического притяжения, называемого хемотаксисом. [c.13]
Для разных стадий жизненного цикла лимфоцитов характерны различные пути миграции. Например, неактивированные Т-клетки имеют тенденцию проникать через ВЭВ во вторичные лимфоидные ткани, тогда как активированные мигрируют в очаги воспаления. К тому же наблюдается избирательная миграция в определенные участки организма лимфоциты, выделенные из [c.85]
Онтогенетическое развитие, воспаление, заживление ран, регенерация тканей связаны с миграцией клеток. Межклеточный матрикс с его переплетением макромолекул создает препятствие для миграции клеток. Это препятствие преодолевается путем локального разрушения матрикса ферментами, секретируемыми клетками или связанными с мембраной клеток. [c.447]
Предсуществующие антигенспецифические Тн1-клетки взаимодействуют с иммуногенным комплексом на поверхности макрофага — ключевое событие для последующего развития всей реакции ГЗТ. После прошедшего взаимодействия Т-клетки воспаления начинают секрецию целого набора цитокинов фактора, подавляющего миграцию макрофагов (макрофагингибирующего фактора — МИФ), макрофагального хемотаксического фактора [c.363]
При действии аллергенов клеточный иммунитет осуществляют Т-лимфоциты, ответственные за ГЗТ, с помощью ряда гуморальных факторов. Так, они способны выделять относительно термостабильный кожно-реак-тивный фактор, имеющий относительную молекулярную массу 35 000—85 000 и разрушаемый ферментами трипсином, пепсином и папаином. С этим фактором связывают развитие гиперергического воспаления в коже при действии контактных химических аллергенов. Учитывая обязательную для этого воспаления клеточную инфильтрацию, можно предполагать, что данная субпопуляция Т-лимфоцитов выделяет также фактор, тормозящий миграцию клеток. Кроме того, Т-клетки, ответственные за ГЗТ, выделяют термолабильный, относительно низкомолекулярный 10 ООО) фактор, получивший название фактора переноса. Такое название было дано в связи с тем, что с его помощью можно пассивно передать ГЗТ. [c.13]
Процесс миграции лейкоцитов в очаг воспаления делится на четыре этапа. На первом этапе под влиянием ФНО-а происходит экспрессия Р- и Е-селектинов на эпителиальных клетках сосудов. Селектины распознают углеводные радикалы на гликопротеино-вых рецепторах циркулирующих в Iqювeнo нoм русле лейкоцитов. Однако такое распознавание проходит при низкой аффинности. Лейкоциты, проходя мимо эпителиальных клеток с Р- и Е-селек-тинами, лишь замедляют движение, но не образуют прочных кон-стактных связей. [c.326]
Миграция лимфоцитов позволяет каждой горстке лимфоцитов, специфичных к какому-либо отдельному антигену, встретиться именно с ним. Пути оттока лимфы и перемещения клеток обеспечивают встречу лимфоцитов, АПК и поступающего из инфицированных и воспаленных тканей антигена в лимфатических узлах антигены, проникшие в кровоток, задерживаются селезенкой. Во вторичных лимфоидных тканях происходит первоначальная клональная экспансия антигенспецифичных лимфоцитов, после чего они поступают в циркуляцию через выносящие лимфатические сосуды (рис. 5.2). Дальнейшая миграция их из кровотока зависит от экспрессии на клетках эндотелия молекул адгезии например, при появлении таких молекул на эндотелии в [c.83]
Клетки, прибывшие в очаг воспаления первыми, способны в результате активации вызвать следующую волну лейкоцитарной миграции. Так, активированные моноциты выделяют ИЛ-8, который может вызвать хемотаксис нейтрофилов и базофилов. Подобно этому, активация макрофагов приводит к метаболизированию арахидоновой кислоты с образованием и выделением лейкотриена В4. [c.93]
Цитокины Подобно другим медиаторам, цитокины служат для межоеточной сигнализации при развитии воспалительного процесса. На его начальных стадиях местные тканевые оетки могут выделять такие цитокины, как ИЛ-1 и ИЛ-6. Как только в очаге воспаления появляются лимфоциты и мононуклеарные фагоциты, они могут, активируясь под действием антигена, выделять свои собственные цитокины (ИЛ-1, ФНО, ИЛ-4, ИФу), которые, воздействуя на эндотелий местных сосудов, дополнительно усиливают клеточную миграцию. Другие цитокины, например ИЛ-8, могут оказывать хемотаксическое или активирующее действие на прибывающие клетки. [c.95]
Д. П. Линднер и Э. М. Коган (1976), П. И. Александров и соавт. (1976) особое внимание обращают на антагонистические функции секретируемых тучными клетками веществ (функциональную двойственность), поэтому они могут рассматриваться как регуляторы тканевого гомеостаза малого радиуса действия или тактические регуляторы в отличие от нервной или эндокринной системы. Популяция тучных клеток регулирует кровоснабжение и проницаемость, влияет на размножение, миграцию, обмен и функцию других клеток микрорайона. Вероятно, на уровне популяции имеются какие-то механизмы, регулирующие антагонистические функции, т. е. обеспечивающие преимущественную секрецию одного или другого вещества. Так, при воспалении, вызванном иммунными факторами, важнейшую роль играет связывание поверхности тучных клеток IgE, что ведет к немедленному выбросу гистамина. Такое связывание обеспечивается наличием на поверхности тучных клеток специфических рецептрров для IgE. Важнейшую роль в секреции медиаторов тучными клетками в ответ на иммунные и неиммунные стимулы играют цАМФ и ионы кальция. [c.72]
Клетки — носители медиаторов являются обязательными компонентами воспаления, хотя соотношение их на поле воспаления может быть разным. Структурно-функциональные особенности этих клеток определяют специфику работы каждой из них в сложном клеточном ансамбле при воспалении. Пожалуй, главенствующая роль в нем принадлежит ПЯЛ, которые способны усиливать инициальное повреждение, повышать сосудистую проницаемость, осуществлять миграцию, эмиграцию и фагоцитоз, а также контакты с плазменными системами. Особая роль в реализации главных функций принадлежит медиаторам (лейкокины), ферментам, биологически активным веществам, содержащимся в гранулах лейкоцитов. Одни гранулы (азурофильные) идентичны лизосомам, содержат кислые гидролизы. Кроме того, большое значение придают нейтральным протеазам (коллагеназа, эластаза), особенно в случаях дефицита их ингибиторов [Goldstein J. М., 1974]. Другие гранулы ПЯЛ (специфические) содержат щелочную фоефатазу и бактерицидные катионные белки, обладающие выраженным медиа-торным действием в экссудате (активация сосудистой проницаемости, выделение гистамина, стимуляция хемотаксиса и др.). [c.232]
Основные проявления биологической активности TNF-a избирательная цитотоксичность в отношении некоторых опухолевых клеток, угнетение синтеза ключевого фермента липогенеза — ли-попротеинкиназы, участие в регуляции иммунного ответа и воспаления. Этот цитокин входит в группу провоспалительных цитокинов и выполняет важнейшие функции в период запуска воспаления активирует эндотелий, способствует адгезии лейкоцитов к эндотелию за счет индукции экспрессии на эндотелиальных клетках адгезионных молекул и последующей трансэндотелиальной миграции лейкоцитов в очаг воспаления, активирует лейкоциты (гранулоциты, моноциты, лимфоциты), индуцирует продукцию других провоспалительных цитокинов IL-1, IL-6, IFN-P, GM- SF, обладающих синергичным с TNF-a действием [159]. [c.28]
Через MSR идет эндоцитоз модифицированных липопротеинов при превращении макрофага в пенистую клетку. Через те же MSR могут фагоцитироваться большинство бактерий как грамположительных, так и грамотрицательных. Однако влияние бактериального липополисахарида (ЛПС) на макрофаги опосредовано специальным рецептором D 14. Экспрессия этого рецептора повышается на макрофагах при воспалении и иммунном ответе. Лигандом для D 14 служит также липоарабиноманнан микобактерий. Возможно участие D 14 в процессе адгезии моноцитов к эндотелиальным клеткам, хотя обратимая адгезия моноцитов к эндотелию при трансэндотелиальной миграции связана с другим компонентом мембраны — D31 [19]. [c.149]
Источник
Вследствие высвобождения доиммунных цитокинов и продукции хемоаттрактантов фагоциты активируются и направляются в очаг инфекции. В спокойном состоянии нейтрофилы покоятся в пристеночном слое плазмы. При активации они начинают катиться вдоль стенки сосуда по направлению к воспалительному очагу. При этом поверхностные молекулы адгезии, экспрессия которых в активированных клетках резко возрастает, постоянно «сканируют» эндотелиоциты с целью идентификации зоны функционально активного эндотелия, соответствующей проекции воспалительного очага. В таких зонах созданы благоприятные условия для экстравазации фагоцита путем диапедеза (трансэндотелиальной миграции) — протискивания между эндотелиоцитами и фибриллами базальной мембраны за счет динамического изменения формы клетки. Речь вдет о наличии адгезионных молекул (селектинов, интегринов), останавливающих качение нейтрофила, и о повышенной сосудистой проницаемости, способствующей выходу клетки за пределы сосуда в воспалительный очаг.
Миграция лейкоцитов из плазмы крови в очаг пребывания патогена является одним из ключевых процессов при воспалении. В ходе миграции выделяют два этапа:
- Этап трансэндотелиальной миграции, состоящий в фиксации лейкоцитов на эндотелии и последующем протискивании между клетками сосуда во внесосудистое пространство.
- Этап миграции по внеклеточному матриксу внесосудистого пространства.
Трансэндотелиальная миграция
На миграцию лейкоцитов через эндотелий сосудов влияет по крайней мере 3 основных фактора:
- Величина поверхностного заряда взаимодействующих клеток. Чем ниже такой заряд, тем эффективнее миграция, так как менее выражено электростатическое отталкивание одноименно заряженных клеток
- Сила гемодинамического смыва в сосуде, которая определяется объемной скоростью кровотока. При этом чем больше сила гемодинамического смыва, тем менее эффективна миграция клеток.
- Экспрессия комплементарных молекул адгезии на мигрирующих лейкоцитах и эндотелии.
Исходя из этих требований, наиболее удобными для миграции являются посткапиллярные венулы, где поверхностный заряд эндотелиоцитов низок, сила гемодинамического смыва невысока, а степень экспрессии адгезионных молекул достаточна.
Рассмотрим механизм миграции лейкоцитов при воспалении на примере наиболее мобильной клетки — нейтрофила. Миграцию нейтрофилов опосредуют адгезионные молекулы двух типов — селектины (на ранних стадиях) и интегрины (на более поздних). Движущей силой миграции нейтрофилов, как и других лейкоцитов, является продукция клетками очага воспаления хемоаттрактантов, воздействующих непосредственно на мигрирующие клетки, и доиммунных цитокинов, обеспечивающих повышенную экспрессию адгезионных молекул на эндотелии венул очага (формирование зоны так называемого функционально активного эндотелия).
Краевое стояние
Первая стадия трансэндотелиальной миграции нейтрофилов называется краевым стоянием. При этом мигрирующая клетка начинает катиться по поверхности эндотелиоцитов венулы. Качение обеспечивается взаимодействием селектинов с углеводными молекулами. Нейтрофилы и эндотелиоциты экспрессируют оба типа адгезионных молекул, поэтому подобное взаимодействие является перекрестным. Каждое связывание селектина с остатками углеводов замедляет скорость качения нейтрофила, поэтому в центре функционально активного эндотелия венулы, где экспрессия адгезионных молекул наиболее высока, нейтрофил останавливается.
Активация нейтрофилов
Второй стадией трансэндотелиальной миграции является активация неподвижного нейтрофила под действием хемоаттрактантов (ЛтВ4, C5b и др. ), хемокинов (ИЛ-8, RANTES и др.), компонентов поверхности эндотелиоцитов. Суть активации состоит во включении генетической программы миграции нейтрофила.
Диапедез лейкоцитов
Затем происходит собственно акт миграции, которому способствует взаимодействие β-интегринов нейтрофила (CRIII, CR1V, LFA-1 и др.) и адгезионных молекул эндотелия (ICAM-1). Если речь идет об эозинофилах и базофилах, то со стороны эндотелия в качестве адгезионных молекул выступают VCAM-I. Протискивание нейтрофила между эндотелиоцитами завершается продукцией гидролитических ферментов, вызывающих локальное повреждение базальной мембраны (стадия лизиса). Материал с сайта https://wiki-med.com
Механизм диапедеза фагоцитов (протискивания между эндотелиоцитами) состоит в следующем. Эндотелиоциты сосудистой стенки фиксированы друг с другом боковыми поверхностями за счет специфических адгезионных молекул (CD31). На цитолемме псевдоподии фагоцита, пытающегося совершить диапедез, появляются точно такие же молекулы, т.е. по специфике поверхностных структур он идентифицируется эндотелиоцитами как родственная клетка и принимается в состав эндотелиального слоя. Затем цитоплазма и ядро фагоцита перетекают по вмонтированной псевдоподии в экстравазальное пространство. Когда этот процесс завершается, на псевдоподии прекращается экспрессия указанных молекул, силы взаимодействия с соседними эндотелиоцитами ослабевают и фагоцит изымает цитоплазматический отросток из стенки сосуда, перемещаясь в экстравазальное пространство. Дальнейшее перемещение клетки обусловлено как растворимыми хемоаттрактантами, так и мембранными адгезионными молекулами, которые появляются на клетках поврежденной ткани и указывают путь перемещения мигрирующим фагоцитам.
Этап миграции во внеклеточном матриксе
Покинув сосуд, нейтрофил продолжает миграцию в межклеточном матриксе поврежденной ткани. Для приспособления к новым условиям перемещения изменяется набор поверхностных молекул нейтрофила. При этом на его поверхности появляются так называемые очень поздние антигены (англ. very late antigem, VLA). VLA (β-интегрины) обеспечивают прикрепление к элементам межклеточного матрикса (фибронектину, коллагену и др.). Они получили свое название в связи с поздним временем экспрессии (в завершающей фазе миграции).
 На этой странице материал по темам:
На этой странице материал по темам:
диапедез нейтрофилов
механизмы диапедеза фагоцитов в ткани
лизис коллагена базальных мембран и миграция нейтрофила
диапидез краткий доклад
миграция+лейкоцитов
Источник
Важная функция воспалительной реакции заключается в накоплении в очаге повреждения лейкоцитов и их активации для элиминации повреждающих агентов. Лейкоциты при типичных воспалительных реакциях отвечают за фагоцитоз и представлены ней-трофилами и макрофагами, которые поглощают бактерии и другие микробы и элиминируют некротическую ткань и инородные субстанции. Цена этого защитного потенциала лейкоцитов высока.
При излишней активации лейкоциты, разрушающие бактерии и некротические ткани, могут повредить и нормальную ткань, вызвать ее вторичное повреждение и продлить воспаление.
Участие лейкоцитов в воспалительном процессе осуществляется в следующей последовательности:
(1) выход из кровотока через стенку сосуда в окружающую ткань;
(2) распознавание микробов и некротической ткани;
(3) фагоцитоз и удаление повреждающего агента.
Мобилизация лейкоцитов из просвета сосуда через его стенку в интерстициальную ткань (экстравазация) может быть разделена на несколько последовательных этапов:
— маргинация, роллинг и адгезия лейкоцитов к эндотелию в просвете сосуда. В норме сосудистый эндотелий в неактивном состоянии не адгезирует клетки из кровотока и не препятствует их проходу. При воспалении лейкоциты приклеиваются к эндотелию перед выходом из просвета сосуда через стенку;
— миграция лейкоцитов через слой эндотелия и стенку сосуда;
— миграция лейкоцитов в ткани под действием хемотаксической активации.

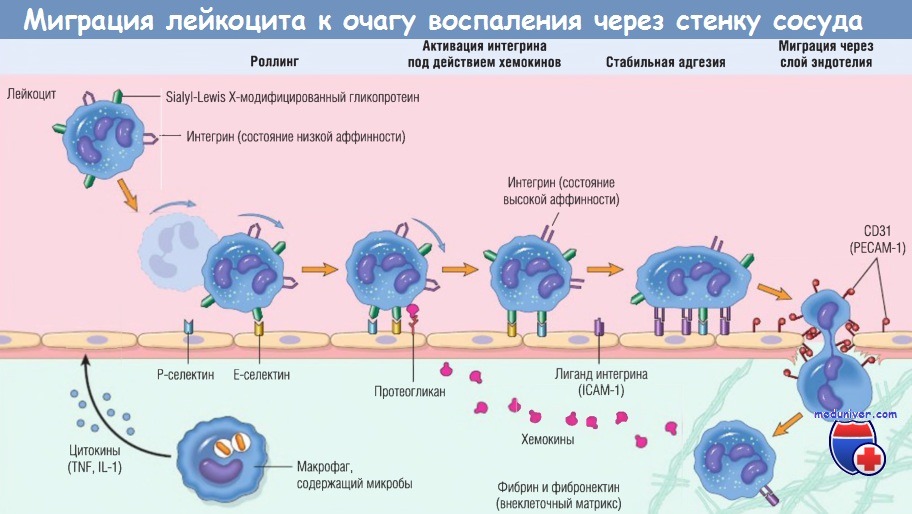
Многоступенчатый процесс миграции лейкоцита через стенку сосуда на примере нейтрофила.
Сначала лейкоцит перекатывается по поверхности эндотелия, потом становится активированным и адгезируется к эндотелию, затем проходит сквозь него,
проникает через базальную мембрану и мигрирует в участок повреждения ткани под действием хемоаттрактантов.
На разных этапах этого процесса работают разные основные молекулы:
селектины — при роллинге, хемокины (обычно представленные в связанном виде с протеогликанами) — при активации нейтрофилов для повышения сродства интегринов,
интегрины — для стойкой адгезии, CD31 (РЕСАМ-1) — для трансмиграции. Нейтрофилы экспрессируют низкие уровни L-селектина;
они связываются с эндотелием преимущественно через Р- и Е-селектины.
ICAM-1 — молекула межклеточной адгезии 1; IL — интерлейкин; РЕСАМ-1 — тромбоцитарная молекула адгезии эндотелиальных клеток 1; TNF — фактор некроза опухоли.
а) Маргинация, роллинг и адгезия лейкоцитов к эндотелию в просвете сосуда. При нормальном венозном кровотоке эритроциты движутся в центре потока крови, оттесняя лейкоциты к стенке сосуда. Поскольку уже на ранних стадиях воспаления кровоток замедляется (стаз) и меняются гемодинамические условия (падает напряжение сосудистой стенки), то все большее количество лейкоцитов занимает периферическую позицию в кровотоке вдоль поверхности эндотелия.
Этот процесс перераспределения лейкоцитов называют маргинацией. Далее отдельные лейкоциты или их скопления ненадолго прилипают к эндотелию, отделяются и опять прилипают, как бы перекатываясь по стенке сосуда. Такое перемещение лейкоцитов вдоль сосудистой стенки называют роллингом. В некоторой точке клетка останавливается и в этот момент плотно прилипает к эндотелию (происходит адгезия).
Адгезия лейкоцитов к эндотелиальным клеткам опосредована молекулами адгезии, экспрессию которых на обоих типах клеток усиливают секретирован-ные белки — цитокины. Цитокины секретиру-ются клетками тканей в ответ на появление микробов или других повреждающих агентов, тем самым обеспечивая миграцию лейкоцитов в места присутствия этих агентов.
Начальные роллинговые взаимодействия опосредованы семейством белков селектинов. Существует три типа селектинов: один экспрессируется на лейкоцитах (L-селектин), другой — на эндотелии (Е-селектин), а третий — на тромбоцитах и эндотелии (Р-селектин). Лиганды к селектинам — это сиалированные олигосахариды, связанные с муциноподобными гликопротеиновыми структурами. Экспрессия селектинов и их лигандов регулируется цито-кинами, продуцируемыми в ответ на инфекционное повреждение.
Тканевые макрофаги, тучные клетки и эндотелиальные клетки первыми взаимодействуют с микробами и некротической тканью и реагируют, секретируя несколько цитокинов, в т.ч. TNF, интерлейкин-1 (IL-1) и хемокины (хемотак-сические цитокины, хемоаттрактанты). TNF и IL-1, выявляемые на эндотелиальных клетках посткапиллярных венул, соседствующих с инфекцией, индуцируют скоординированную экспрессию множества молекул адгезии. В течение 1-2 час эндотелиальные клетки начинают экспрессировать Е-селектин и лиганды к L-селектину.
Другие медиаторы, такие как гистамин, тромбин и фактор активации тромбоцитов, описанные далее, стимулируют перераспределение Р-селектина из его обычного внутриклеточного депо в гранулах эндотелиоцитов (названных тельцами Вейбеля-Паладе) на поверхность клетки. Лейкоциты экспрессируют L-селектин, а также лиганды к Е- и Р-селектинам, все они связываются с молекулами на эндотелиальных клетках. Эти низкоаффинные связи легко разрушаются под действием сил кровотока. В результате связанные лейкоциты прилипают, отделяются, опять прилипают, таким образом перемещаясь по поверхности эндотелия.
Слабые роллинговые связи позволяют лейкоцитам замедлить ход и связаться с эндотелием более прочно. Плотность адгезии опосредована семейством лейкоцитарных поверхностных гетеродимерных белков интегринов. TNF и IL-1 индуцируют экспрессию эндотелиальными клетками лигандов к интегринам, в основном к молекулам адгезии сосудистого эндотелия 1 (VCAM-1) (для интегрина VLA-4) и к молекулам межклеточной адгезии 1 (ICAM-1) (для интегринов LFA-1 и Мас-1). В норме лейкоциты экспрессируют интегрины с низкой аффинностью.
Тем временем хемокины, образованные в месте повреждения, попадают в просвет сосуда, прикрепляются к протеогликанам эндотелиальных клеток и концентрируются на поверхности эндотелия. Эти хемокины связываются и активируют роллинговые лейкоциты. В результате лейкоцитарные интегрины VLA-4 и LFA-1 превращаются в высокоаффинные. Комбинация цитокин-индуцированной экспрессии лигандов интегринов на эндотелии и активация лейкоцитарных интегринов приводит к плотному интегрин-опосредованному сцеплению лейкоцитов с эндотелием в очаге воспаления. Лейкоциты перестают перемещаться, их цитоскелет реорганизуется, и они распределяются по эндотелиальной поверхности.
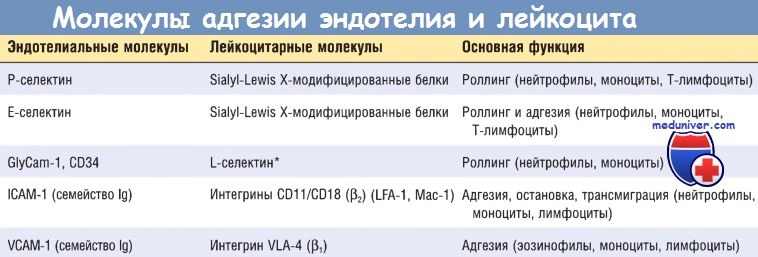
* Нейтрофилы слабо экспрессируют L-селектин, который участвует в адгезии циркулирующих Т-лимфоцитов в венуле с высоким эндотелием лимфатических узлов и лимфоидной ткани слизистых оболочек, а затем в хоуминге лимфоцитов.
ICAM-1 — молекулы межклеточной адгезии 1; lg — иммуноглобулин; VCAM-1 — молекулы адгезии сосудистого эндотелия 1.
б) Миграция лейкоцитов через слой эндотелия и стенку сосуда. Следующий этап в процессе мобилизации лейкоцитов — трансмиграция, или диапедез (миграция лейкоцитов через слой эндотелия). Трансмиграция происходит преимущественно в посткапиллярных венулах. На адгезированные лейкоциты действуют хемокины, стимулируя выход лейкоцитов через межэндотелиальные пространства в соответствии с градиентом концентрации хемокинов и перемещение к месту раны или инфекции, где хемокины были образованы. В процессе миграции лейкоцитов участвуют несколько молекул, располагающихся в межклеточных соединениях между эндотелиальными клетками.
Эти молекулы включают тромбоцитарную молекулу адгезии эндотелиальных клеток 1 (РЕСАМ-1), или CD31, из суперсемейства Ig и несколько молекул адгезии. После прохождения через эндотелий лейкоциты просачиваются через базальную мембрану (возможно, за счет выделения коллагеназ) в окружающую сосуды ткань. Затем клетки мигрируют по градиенту концентрации хемокинов и накапливаются вне сосуда. В соединительной ткани лейкоциты адгезируются к ВКМ за счет способности интегринов и CD44 связываться с белками матрикса. Таким образом лейкоциты попадают в нужное место.
Наиболее яркое доказательство важности лейкоцитарных молекул адгезии — существование генетических дефектов этих молекул, приводящих к интеркур-рентным бактериальным инфекциям, развивающимся вследствие нарушения адгезии лейкоцитов и недостаточной воспалительной реакции. Индивиды с дефицитом адгезии типа I имеют нарушения биосинтеза b2-цепи, общей для интегринов LFA-1 и Мас-1. Дефицит адгезии типа II вызывается отсутствием sialyl-Lewis X (фукозосодержащего лиганда к Е- и Р-селектинам) в результате дефекта фукозилтрансферазы — фермента, присоединяющего части фукозы к белковым каркасам.
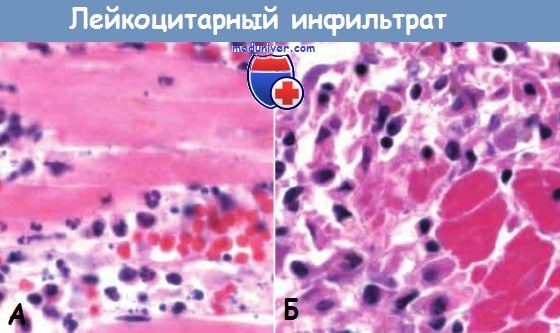
Лейкоцитарный инфильтрат при воспалительных реакциях.
Ранняя (нейтрофильная) (А) и поздняя (мононуклеарная)
(Б) фазы образования инфильтрата в зоне демаркационного воспаления при инфаркте миокарда.
в) Миграция лейкоцитов в ткани под действием хемотаксической активации. После выхода из просвета сосуда лейкоциты направляются в очаг повреждения. Этот процесс называют хемотаксисом. Хемоаттрактантами могут быть и экзогенные, и эндогенные субстанции. Самые распространенные экзогенные агенты — продукты бактерий, в т.ч. пептиды, которые имеют в своем составе концевую аминокислоту N-формилметионин и некоторые липиды. Эндогенные хемоаттрактанты включают следующие химические медиаторы воспаления:
(1) цитокины, особенно семейства хемокинов (например, IL-8);
(2) компоненты системы комплемента, особенно С5а;
(3) метаболиты арахидоновой кислоты, в основном лейкотриен В4.
Все эти хемотаксические агенты связываются со специфическими 7-трансмембранными G-белок-связанными рецепторами на поверхности лейкоцитов. Сигналы, передающиеся через эти рецепторы, активируют вторичные мессенджеры, повышающие уровень кальция в цитозоле и, в свою очередь, активирующие малые гуанозинтрифосфатазы семейства Rac/Rho/cdc42 и множество киназ. Эти сигналы вызывают полимеризацию актина, приводящую к увеличению его количества в передней части клетки и оттеснению миозиновых филаментов назад.
Лейкоцит передвигается, образуя свои филоподии, которые тянут заднюю часть клетки в направлении движения, как автомобиль с передним приводом. В конечном итоге лейкоцит мигрирует к агенту воспаления в соответствии с градиентом концентрации локально продуцируемых хемоаттрактантов.
Природа лейкоцитарного инфильтрата варьирует в зависимости от длительности воспаления и типа его агента. При большинстве форм острого воспаления в воспалительном инфильтрате в первые 6-24 час доминируют нейтрофилы, через 24-48 час они заменяются моноцитами. Есть несколько причин для раннего появления нейтрофилов: они самые многочисленные в крови; быстрее реагируют на хемокины и могут более плотно прикрепляться к адгезивным молекулам, таким как Р- и Е-селектины. Нейтрофилы имеют короткий период жизни: после выхода в ткани подвергаются апоптозу и исчезают в течение 24-48 час. Моноциты могут не только дольше сохраняться в тканях, но и делиться посредством митоза, становясь доминирующей популяцией клеток при хроническом воспалении.
Однако есть исключения. При определенных инфекциях, например синегнойной, клеточный инфильтрат представлен преимущественно нейтрофилами, при вирусных инфекциях первыми клетками, появляющимися в воспалительном инфильтрате, могут быть лимфоциты, а при некоторых реакциях гиперчувствительности основными клетками инфильтрата могут быть эозинофилы.
Понимание молекулярных механизмов мобилизации и миграции лейкоцитов привело к открытию большого количества потенциальных мишеней для лечения и контроля воспаления. Вещества, блокирующие TNF (один из основных цитокинов при мобилизации лейкоцитов), являются наиболее эффективными лекарственными средствами, когда-либо разработанными для лечения хронических воспалительных заболеваний. Антагонисты лейкоцитарных интегринов (например, VLA-4), селектинов и хемокинов одобрены для лечения воспалительных заболеваний или находятся в стадии клинических исследований. Предположительно эти антагонисты смогут не только эффективно контролировать воспаление, но и нарушать у пролеченных больных защитные антимикробные механизмы — физиологическую функцию воспалительного ответа.
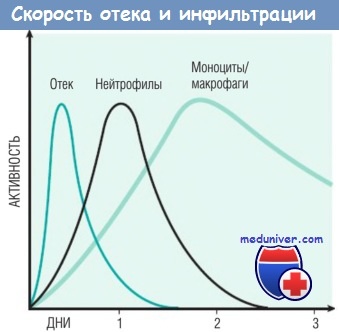
Кинетика отека и клеточной инфильтрации
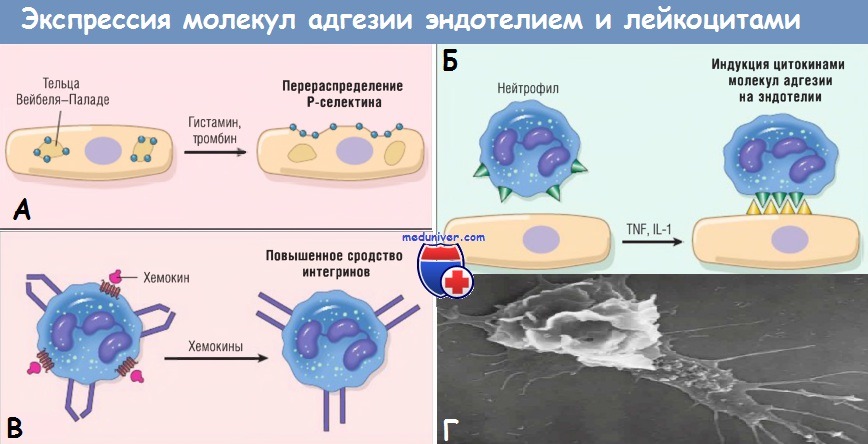
Регуляция экспрессии молекул адгезии эндотелиальными клетками и лейкоцитами.
(А) Перераспределение Р-селектина из внутриклеточных запасов на поверхность клетки.
(Б) Повышенная экспрессия на поверхности клетки селектинов и лигандов к интегринам при цитокиновой активации эндотелия.
(В) Повышение сродства интегринов, индуцированное хемокинами. Кластеризация интегринов участвует в повышении их сродства (не показано).
IL — интерлейкин; TNF — фактор некроза опухоли.
(Г) На электронограмме двигающегося лейкоцита в клеточной культуре видны его филоподии (снизу справа) и тянущийся хвост.
— Рекомендуем ознакомиться со следующей статьей «Рецепторы лейкоцитов для выявления микробов и поврежденных тканей»
Оглавление темы «Патофизиология»:
- Механизмы накопления пигментов в клетке
- Дистрофическая кальцификация аорты как патологическая
- Причины, механизмы метастатической кальцификации тканей и органов
- Механизмы старения клетки и ее этапы
- Определение воспаления и его характеристика
- История изучения воспаления
- Причины острого воспаления
- Изменения сосудов в очаге воспаления: образование транссудата и экссудата
- Реакция лейкоцитов на воспаление — миграция и накопление
- Рецепторы лейкоцитов для выявления микробов и поврежденных тканей
Источник
