Метаболиты арахидоновой кислоты в воспалении

Метаболиты арахидоновой кислоты в патогенезе воспаления легких и бронхов.Участие метаболитов арахидоновой кислоты в патогенезе воспалительных заболеваний легких и бронхов в последние годы привлекает все большее внимание исследователей. Арахидоновая кислота (АК) находится в фосфолипидах клеточных мембран и составляет около 1 % свободных жирных кислот плазмы, циркулируя в виде комплекса с альбумином. При активации клетки стимулом, изменяющим типы и геометрическую ориентацию фосфолипидов и активирующим фосфолипазу А2, происходит освобождение арахидоновой кислоты с последующим метаболизмом по циклооксигеназному или липоксигеназному пути. В нормально функционирующих клетках таким стимулом могут служить продукты свободнорадикального окисления липидов. Образование простагландинов (ПГ) и тромбоксанов (Тх) по циклооксигеназному пути проходит через нестабильные, биологически неактивные ПГа2 и ПГН2 (табл. 1). В дальнейшем синтез циклооксигеназных метаболитов происходит в различных клетках по-разному, в соответствии с тем ферментом, который преобладает в этих клетках. Циклооксигеназный фермент ПГН-синтетаза — имеет две изоформы, названные циклооксигеназа 1 (ЦО-1) и циклооксигеназа 2 (ЦО-2), обладающие на 61% однотипной последовательностью аминокислот. ЦО-1 и ЦО-2 опосредуют физиологические и воспалительные процессы, соответственно, и реагируют на различные стимулы образованием простаноидов. ЦО-1 присутствует в тромбоцитах, эндотелиальных клетках, слизистой желудка, почках и т.д. ЦО-2 синтезируется de novo, главным образом, в макрофагах, но также в легких, сердце, сосудах, селезенке и ответственна за массивное, неконтролируемое образование простаноидов при стимуляции клеток бактериальными эндотоксинами или цитокинами.
Липоксигеназный путь метаболизма АК ведет к образованию различных лейкотриенов (ЛТ), моногидроксиэйкозатетраеновых кислот (ГЭТЕ) и липоксинов (LX), синтез которых, как и в случае циклооксигеназных продуктов, зависит от преобладающего в клетках фермента. Липоксины (А и В) — это тригидрокси-кислоты, полученные из арахидоновой кислоты в результате последовательного действия двух липоксигеназ (ЛО)-15-ЛО и 5-ЛО. Фермент 5-липоксигеназа найден только в клетках миелоидного ростка. Клетки, обладающие полным ферментативным составом (эозинофилы, тучные клетки и базофилы), способны генерировать значительные количества сульфидопептидных лейкотриенов (ЛТС4, ЛТД4, ЛТЕ4). Тромбоциты обладают ферментом ЛТС4-синтетаза, но не имеют 5-ЛО. В связи с этим тромбоциты способны генерировать ЛТС4 только из ЛТА4, образованного нейтрофилами, благодаря механизму трансклеточного метаболизма. Подобный механизм существует между нейтрофилами и сосудистыми эндотелиальными клетками. Для биосинтеза ЛТ необходим также трансмембранный протеин, известный как 5-ЛО-активирующий протеин, который играет роль в связывании 5-ЛО с фосфолипидами клеточных мембран для инициирования катализа. В нормально функционирующих клетках гидролиз мембранных липидов с высвобождением АК происходит на довольно низком уровне, что обеспечивает небольшой уровень синтеза эйкозаноидов. В физиологических условиях существуют системы, ингибирующие синтез эйкозаноидов. Тормозящее действие оказывает, в частности, липокортин — высокополярный протеин, представленный в различных клетках, включая моноциты и нейтрофилы. Образование липоксщтина регулируется уровнем циркулирующих в организме кортикостероидов, которые индуцируют его образование. Действие липокортина связано с ингибированием активности фосфолипазы А,, в связи с чем тормозится высвобождение АК из фосфолипидов и, таким образом, блокируется образование простагландинов, лейкотриенов и фактора активации тромбоцитов (ФАТ). Активность циклооксигеназы и липоксигеназы регулируется гидроперекисями жирных кислот, которые даже в небольших количествах активируют эти ферменты. При этом патологический сигнал нарастает по механизму «порочного круга». Механизм возвращения функционирования системы к физиологическому уровню, по-видимому, связан с аутокатализом и аутоингибированием ферментов, для воспроизводства которых требуется определенное время. — Также рекомендуем «Легочный контроль за образованием и инактивацией эйкозаноидов.» Оглавление темы «Регуляция бронхиальной проходимости.»: |
Источник
Рис.1.Метаболизм арахидоновой кислоты.
а) являются медиаторами воспалительной реакции: они накапливаются в очаге воспаления и вызывают локальное расширение сосудов, отёк, экссудацию, миграцию лейкоцитов и другие эффекты (в основном ПГ-Е2 и ПГ-I2);
б) сенсибилизируют рецепторы к медиаторам боли (гистамину, брадикинину) и механическим воздействиям, понижая порог чувствительности;
в) повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (интерлейкина-1 и др.), образующихся в организме под влиянием микробов, вирусов, токсинов (главным образом ПГ-Е2);
г) играют важную физиологическую роль в защите слизистой оболочки желудочно-кишечного тракта (увеличение секреции слизи и щёлочи; сохранение целостности эндотелиальных клеток внутри микрососудов слизистой оболочки, способствующее поддержанию кровотока в слизистой; сохранение целостности гранулоцитов и, таким образом, сохранение структурной целостности слизистой оболочки);
д) влияют на функцию почек: вызывают вазодилатацию, поддерживают почечный кровоток и скорость клубочковой фильтрации, повышают высвобождение ренина, выделение натрия и воды, участвуют в гомеостазе калия.
Существует, как минимум, два изофермента циклооксигеназы, которые ингибируются НПВС (рис. 2). Первый изофермент — ЦОГ-1 — контролирует выработку ПГ, регулирующих целостность слизистой оболочки желудочно-кишечного тракта, функцию тромбоцитов и почечный кровоток, а второй изофермент — ЦОГ-2 — участвует в синтезе ПГ при воспалении. Причём ЦОГ-2 в нормальных условиях отсутствует, а образуется под действием некоторых тканевых факторов, инициирующих воспалительную реакцию (цитокины и другие). В связи с этим предполагается, что противовоспалительное действие НПВС обусловлено ингибированием ЦОГ-2, а их нежелательные реакции — ингибированием ЦОГ-1.
В последнее время проведены дополнительные исследования ЦОГ-2 и установлено, что провоспалительная активность может быть присуща ЦОГ-2, а противовоспалительные свойства – третьему изомеру ЦОГ-ЦОГ-3. Подобно другим ферментам ЦОГ, ЦОГ-3 тоже участвует в синтезе простагландинов и играет роль в развитии боли и лихорадки. Однако, в отличие от ЦОГ-1 и ЦОГ-2, ЦОГ-3 не принимает участие в развитии воспаления. Активность ЦОГ-3 ингибируется парацетамолом, который оказывает слабое влияние на ЦОГ-1 и ЦОГ-2. Однако следует заметить, что ЦОГ-3 обнаружен в тканях экспериментальных животных и существование данной изоформы ЦОГ в организме человека требует доказательства, как и требует дальнейшего изучения и доказательства, связанной с ингибированием ЦОГ-3 механизм действия парацетамола.
Соотношение активности НПВС в плане блокирования ЦОГ-1/ЦОГ-2 позволяет судить об их потенциальной токсичности. Чем меньше эта величина, тем более селективно лекарственное средство в отношении ЦОГ-2 и, тем самым, менее токсично. Например, для мелоксикама она составляет 0,33, диклофенака — 2,2, теноксикама — 15, пироксикама — 33, индометацина — 107.
Данные свидетельствуют о том, что НПВС не только угнетают циклооксигеназный метаболизм, но и активно влияют на синтез ПГ, связанный с мобилизацией Са++ в гладких мышцах. Так, бутадион, ингибирует превращения циклических эндоперекисей в простагландины Е2 и F2λ , а фенаматы кроме этого могут блокировать рецепцию этих веществ в тканях.
Важную роль в противовоспалительном действии НПВС играет их влияние на метаболизм и биоэффекты кининов. В терапевтических дозах индометацин, ортофен, напроксен, ибупрофен, ацетилсалициловая кислота (АСК) на 70-80% снижают образование брадикинина. В основе данного эффекта лежит способность НПВС оказывать неспецифическое ингибирование взаимодействия калликреина с высокомолекулярным кининогеном. НПВС вызывают химическую модификацию компонентов реакции кининогенеза, в результате чего из-за стерических препятствий нарушается комплементарное взаимодействие белковых молекул и не происходит эффективного гидролиза высокомолекулярного кининогена калликреином. Снижение образования брадикинина приводит к торможению активации λ-фосфорилазы, что ведет к уменьшению синтеза арахидоновой кислоты и, как следствие проявлению эффектов продуктов ее метаболизма.
Важной является способность НПВС блокировать взаимодействие брадикинина с тканевыми рецепторами, что приводит к восстановлению нарушенной микроциркуляции, уменьшению перерастяжения капилляров, снижению выхода жидкой части плазмы, ее белков, провоспалительных факторов и форменных элементов, что опосредованно влияет на развитие других фаз воспалительного процесса. Поскольку калликреин-кининовая система играет наиболее важную роль в развитии острых воспалительных реакций, то и наибольшая эффективность НПВС отмечается в ранних стадиях воспаления, при наличии выраженного экссудативного компонента.
Определенное значение в механизме противовоспалительного действия НПВС имеют ингибирование освобождения гистамина и серотонина, блокада тканевых реакций на эти биогенные амины, которые играют существенную роль в воспалительном процессе. Внутримолекулярное расстояние между реакционными центрами в молекуле антифлогистиков (соединений типа бутадиона) приближается к таковым в молекуле медиаторов воспаления (гистамина, серотонина). Это дает основание предположить возможность конкурентного взаимодействия упомянутых НПВС с рецепторами или ферментными системами, участвующими в процессах синтеза, высвобождения и превращения указанных веществ.
Как уже указывалось выше, НПВС обладают мембраностабилизирующим действием. Связываясь с G-белком в клеточной мембране, антифлогистики влияют на передачу через нее мембранных сигналов, подавляют транспорт анионов, влияют на биологические процессы, зависимые от общей подвижности мембранных липидов. Свое мембраностабилизирующее действие они реализуют путем повышения микровязкости мембран. Проникая через цитоплазматическую мембрану внутрь клетки, НПВС воздействуют также на функциональное состояние мембран клеточных структур, в частности лизосом и препятствуют провоспалительному эффекту гидролаз. Получены данные о количественных и качественных особенностях сродства отдельных препаратов к белковым и липидным компонентам биологических мембран, что может объяснить их мембранный эффект.
Одним из механизмов повреждения клеточных мембран является свободнорадикальное окисление. Свободные радикалы, образующиеся при перекисном окислении липидов (ПОЛ), играют важную роль в развитии воспаления. Поэтому угнетение НПВС перекисного окисления в мембранах можно рассматривать, как проявление их противовоспалительного действия. Одним из основных источников генерации свободных радикалов являются реакции метаболизма арахидоновой кислоты. Отдельные метаболиты её каскада вызывают накопление в очаге воспаления полиморфноядерных нейтрофилов и макрофагов, активация которых также сопровождается образованием свободных радикалов. НПВС, функционируя в качестве ловушек этих соединений, открывают возможность нового подхода к профилактике и терапии повреждений тканей, вызываемых свободными радикалами.
В последние годы значительное развитие получили исследования влияния НПВС на клеточные механизмы воспалительной реакции. НПВС уменьшают миграцию клеток в очаг воспаления и снижают их флогогенную активность, причем влияние на полиморфноядерные нейтрофилы коррелирует с угнетением липооксигеназного пути окисления арахидоновой кислоты. Этот альтернативный путь превращения арахидоновой кислоты ведет к образованию лейкотриенов (ЛТ), которые соответствуют всем критериям медиаторов воспаления. Беноксапрофен обладает способностью влиять на 5-липооксигеназу и блокировать синтез ЛТ.
Менее изучено влияние НПВС на клеточные элементы поздней стадии воспаления — мононуклеарные клетки. Некоторые НПВС уменьшают миграцию моноцитов, продуцирующих свободные радикалы и вызывающих тканевую деструкцию. Хотя важная роль клеточных элементов в развитии воспалительной реакции и лечебном эффекте противовоспалительных средств несомненна, механизм действия НПВС на миграцию и функцию этих клеток ждет выяснения.
Существует предположение об освобождении НПВС естественных противовоспалительных веществ из комплекса с белками плазмы, которое исходит из способности этих лекарственных средств вытеснять лизин из связи с альбумином.
Источник
Арахидоновая кислота может поступать в организм человека с пищей или образовываться из линолевой кислоты, также поступающей с пищей (рис.1).

Рис. 1. Схема образования арахидоновой кислоты из линолевой кислоты.
Арахидоновая кислота входит в состав глицерофосфолипидов мембран. Под действием ассоциированной с мембраной фосфолипазы А2 эйкозатетраеновая кислота отщепляется от глицерофосфолипида и используется для синтеза эйкозаноидов [1].
Так фосфолипаза А2 отщепляет одну ацильную группу, ею осуществляется гидролиз связи B (рис.2), что приводит к высвобождению арахидоновой кислоты (R’ — соответствующий арахидоновой кислоте радикал).

Рис. 2. Молекула фосфотидилхолина.
Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: гормонов, гистамина, цитокинов, механического воздействия [2].
После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеются 3 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, липоксигеназный, заканчивающийся образованием лейкотриенов, липоксинов и цитохромный (монооксигеназный), приводящий к образованию эйкозатретраеновых кислот.
Циклооксигеназы катализируют реакцию превращения арахидоновой кислоты в простагландин Н2 (PG H2, предшественник остальных простагландинов, простациклина и тромбоксана А2). Фермент содержит два активных центра: циклооксигеназный сайт, превращаюший арахидоновую кислоту в простагландин G2 (реакция по сути представляет из себя циклизацию линейной арахидоновой кислоты с присоединением молекул кислорода) и гем, обладающий пероксидазной активностью, превращаюший простагландин G2 в простагландин Н2.
Простагландины обозначают символами, например PG А, где PG обозначает слово «простагландин», а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида.
PG I — простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое — с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (PG I2, PG I3).
Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG Е2.
В организме имеются 3 типа циклооксигеназ: циклооксигеназа-1 (COX-1, ЦОГ-1), циклооксигеназа-2 (COX-2, ЦОГ-2) и циклооксигеназа-3 (COX-3, ЦОГ-3).

Рис. 3. Простогландинсинтаза как совокупность циклооксигеназ и пероксидазы
Первые два типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое PG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием PG Н2. До образования PG Н2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения PG Н2специфичны для каждого типа клеток.

Рис. 4. Циклооксигеназный путь превращения арахидоновой кислоты.
Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов — гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены или липоксины (Рис.4) [3].

Рис. 5. Липоксигеназный путь превращения арахидоновой кислоты.
Синтез липоксинов начинается с действия на арахидоновую кислоту 15-липоксигеназы, затем происходит ряд реакций, приводящих к образованию липоксина А4. В Р450-монооксигеназном пути арахидоновая кислота окисляется до 19-гидрокси или 20-гидрокси-эйкозатетраеновых кислот (19-НЕТЕ и 20-НЕТЕ), а также эпоксиэйкозатетраеновой кислоты (ОЕТЕ) [4].

Рис. 7 Общая схема метаболизма арахидоновой кислоты (упрощенная).
Источник
Когда клетки активируются различными стимулами, например продуктами микробов и разными медиаторами воспаления, арахидоновая кислота, содержащаяся в мембране, под действием ферментов образует простагландины и лейкотриены. Эти биологически активные липидные медиаторы передают внутриклеточные и внеклеточные сигналы к запуску различных биологических процессов, включая воспаление и гемостаз.
Арахидоновая кислота является 20-углеродной полиненасыщенной жирной кислотой (5,8,11,14-эйкозатетраеновая кислота), которая содержится в пищевых продуктах или преобразуется из незаменимой жирной кислоты — линолевой. Арахидоновая кислота не находится в клетке в свободном состоянии, а обычно этерифицирована в фосфолипиды мембран. Механические, химические и физические стимулы (например, С5а) высвобождают арахидоновую кислоту из фосфолипидов мембран под действием клеточных фосфолипаз, в основном фосфолипазы А2.
Биохимические сигналы участвуют в активации фосфолипазы А2, включая повышение содержания цитоплазматического Са2+ и активацию различных киназ в ответ на внешний стимул. Эйкозаноиды (метаболиты арахидоновой кислоты) синтезируются двумя основными классами ферментов: циклооксигеназами (СОХ) (продуцируют простагландины) и липоксигеназами (продуцируют лейкотриены и липоксины). Эйкозаноиды связываются с G-белок-связанными рецепторами на клетках различных типов и могут фактически опосредовать каждую фазу воспалительной реакции.

а) Простагландины. Простагландины (PG) продуцируются тучными клетками, макрофагами, эндотелиальными клетками и многими другими типами клеток и вовлекаются в местные и системные воспалительные реакции. Простагландины образуются под действием двух СОХ: конститутивно экспрессированной СОХ-1 и индуцибельного фермента СОХ-2. Простагландины распределены на группы в соответствии со структурными свойствами и кодируются буквой (PGD, PGE, PGF, PGG, PGH и др.) и подстрочным номером (например, 1, 2), который указывает на двойные связи в их структуре.
Самые важные среди них при воспалительных реакциях — PGE2, PGD2, PGF2a, PGI2 и тромбоксан А2, каждый из которых образуется при действии специфического фермента на предшественник во время передачи сигнала. Некоторые из этих ферментов ограничивают распространение ткани. Например, тромбоциты содержат фермент тромбоксансинтетазу и основной продукт этих клеток — тромбоксан А2, потенциальный агент агрегации тромбоцитов и вазоконстриктор. Тромбоксан А2 нестабилен и быстро преобразуется в неактивную форму — тромбоксан В2.
В сосудистом эндотелии тромбоксансинтетаза отсутствует, но присутствует простациклинсинтетаза, которая приводит к образованию PGI2 (простациклина) и его стабильного конечного продукта PGFla. PGI2 — это вазодилататор и потенциальный ингибитор агрегации тромбоцитов, который еще и заметно увеличивает проницаемость и хемотаксические эффекты других медиаторов. Дисбаланс тромбоксана и PGI2 наблюдается на ранних стадиях тромбообразования в коронарных и церебральных кровеносных сосудах. PGD2 — главный простагландин тучных клеток.
Вместе с широко распространенным PGE2 он вызывает вазодилатацию и повышает проницаемость посткапиллярных венул, таким образом усиливая формирование отека. PGF2ot стимулирует сокращение гладких мышц матки, бронхиального дерева и мелких артериол. PGD2 является хемоаттрактантом для нейтрофилов.
Простагландины оказывают местное действие, а также участвуют в патогенезе боли и лихорадки при воспалении. PGE2 обладает гипералгезическим эффектом и делает кожу гиперчувствительной к боли, например при внутрикожных инъекциях квазиопти-мальных концентраций гистамина и брадикинина. При инфекциях он участвует в развитии цитокин-индуцированной лихорадки.
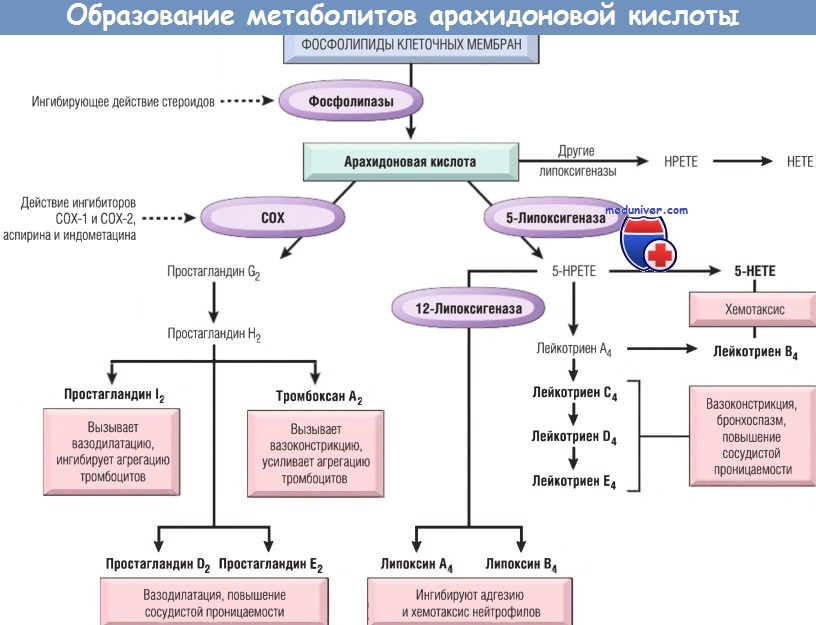
б) Лейкотриены. За продукцию лейкотриенов, которые в основном секретируются лейкоцитами, являются хемоаттрактантами и оказывают влияние на сосуды, отвечают липоксигеназные ферменты. Существуетри разные липоксигеназы. Одна из них — 5-липокси-геназа — является основной для нейтрофилов. Этот фермент превращает арахидоновую кислоту в 5-гидроксиэйкозатетраеновую кислоту, которая хемотаксична для нейтрофилов и является предшественником лейкотриенов.
Лейкотриен В4 — потенциальный хемотаксический агент и активатор нейтрофилов, вызывающий агрегацию и адгезию клеток на эндотелии венул, генерацию АФК и высвобождение лизосомных ферментов. Содержащие цистеинил лейкотриены С4, D4, Е4 вызывают вазоконстрикцию, бронхоспазм (важно при астме) и повышают сосудистую проницаемость, которая, как при действии гистамина, ограничена в венулах. Лейкотриены обладают большим потенциалом, чем гистамин, в увеличении сосудистой проницаемости и вызове бронхоспазма.
в) Липоксины. Липоксины образуются тоже из арахидоновой кислоты через липоксигеназный путь, но, в отличие от простагландинов и лейкотриенов, являются ингибиторами воспаления. Липоксины почти не встречаются в клетках, которые участвуют в синтезе простагландинов и лейкотриенов. При синтезе липоксинов лейкоцит продуцирует предшественники, которые потом путем взаимодействия лейкоцита с тромбоцитом превращаются в липоксины. Основная функция липоксинов — ингибирование мобилизации лейкоцитов и клеточных компонентов воспаления. Липоксины ингибируют хемотаксис нейтрофилов и их адгезию к эндотелию. Имеется обратная зависимость между продукцией липоксинов и лейкотриенов, предполагающая, что липоксины могут быть эндогенными негативными регуляторами лейкотриенов и таким образом принимать участие в разрешении воспаления.
Синтез эйкозаноидов ингибируют многие противовоспалительные лекарственные средства:
— ингибиторы циклооксигеназ (аспирин и другие нестероидные противовоспалительные средства, например индометацин). Они ингибируют обе циклооксигеназы — СОХ-1 и СОХ-2 и тем самым подавляют синтез простагландинов. Аспирин осуществляет этот эффект через необратимое ацетилирование и инактивирование СОХ. Селективные ингибиторы СОХ-2 — новый класс лекарственных средств. Поскольку СОХ-2 индуцируется различными воспалительными стимулами и в норме отсутствует в большинстве тканей, она вызывает научный интерес. СОХ-1, наоборот, продуцируется в ответ на действие стимула воспалительного процесса и в норме экспрессируется в большинстве тканей.
Это различие позволяет предположить, что СОХ-1 отвечает за продукцию простагландинов, которые вовлечены и в воспалительный ответ, и в функции гомеостаза (например, жидкостный и электролитный баланс в почках, защиту клеток в ЖКТ), тогда как СОХ-2 генерирует простагландины, которые вовлечены только в воспалительную реакцию. Если эта концепция верна, то селективные ингибиторы СОХ-2 не должны оказывать токсического действия, присущего неселективным ингибиторам: например, при использовании СОХ-2 не должны развиваться язвы желудка. Однако эти различия не абсолютны, поскольку, по-видимому, СОХ-2 участвует в формировании нормального гомеостаза.
Клинические исследования выявили, что селективные ингибиторы СОХ-2 могут повысить риск возникновения осложнений со стороны сердечнососудистой системы и сосудов головного мозга, что послужило причиной изъятия с рынка США нескольких препаратов.
Повышение риска развития артериального тромбоза при приеме селективных ингибиторов СОХ-2, вероятно, связано с их способностью снижать синтез эндотелиальными клетками PGI2 (вазодилататора и ингибитора агрегации тромбоцитов), не нарушая СОХ-1-опосредованную продукцию тромбоцитами тромбоксана А2 (важного индуктора агрегации тромбоцитов и вазоконстриктора). В соответствии с этой гипотезой, селективное ингибирование СОХ-2 нарушает баланс продукции тромбоксана и вызывает тромбоз сосудов, особенно у лиц, имеющих и другие факторы риска развития тромбоза;
— ингибиторы липоксигеназ. Нестероидные противовоспалительные средства не действуют на 5-липоксигеназу, поэтому были разработаны другие ингибиторы этого ферментного пути. Фармакологические средства, ингибирующие продукцию лейкотриенов (например, зилеутон) или блокирующие лейкотриеновые рецепторы (например, монтелукаст), очень эффективны при лечении астмы;
— кортикостероиды. Эти мощные противовоспалительные средства могут действовать через редуцирование транскрипции генов, которые кодируют СОХ-2, фосфолипазу А2, провоспалительные цитокины (например, IL-1 и TNF) и iNOS.
Другой подход к контролю воспалительного ответа заключается в модификации захвата и уровня липидов посредством повышения потребления с пищей рыбьего жира. Эффективность этого подхода объясняется наличием в рыбьем жире полиненасыщенных жирных кислот, которые являются скудными субстратами для преобразования активных метаболитов и циклооксигеназным, и липоксигеназным путями, но отличными субстратами для образования противовоспалительных липидных продуктов резолвинов и протектинов.

— Рекомендуем ознакомиться со следующей статьей «Образование и функции фактора активации тромбоцитов (PAF)»
Оглавление темы «Патофизиология воспаления»:
- Механизмы удаления микробов и мертвых клеток из очага воспаления
- Механизмы повреждения лейкоцитами здоровых клеток
- Виды нарушений функции лейкоцитов и их причины
- Механизмы завершения воспаления (терминальная фаза воспаления)
- Медиаторы воспаления и их источники, эффекты
- Гистамин и серотонин как клеточные медиаторы воспаления
- Образование метаболитов арахидоновой кислоты (простагландинов, лейкотриенов и липоксинов)
- Образование и функции фактора активации тромбоцитов (PAF)
- Образование и функции активных форм кислорода (АФК)
- Образование и функции оксида азота (NO)
Источник