Механизмы хронизации острого воспаления

Рассматривая механизмы хронизации следует прежде всего остановиться на особенностях течения гнойного воспаления и тех процессах которые могут привести к затяжному течению острого воспалительного процесса
Ведущая роль в хронизации воспаления отводится нарушениям процессов элиминации повреждающего фактора и поврежденного клеточного
материала. Учитывая это, на первое место выступает несостоятельность
системы неспецифического иммунитета, а именно иейтрофильных лейкоцитов и макрофагов.
Прогрессирование гнойного воспаления сопровождается нарастанием
количества микробных антигенов. В крови накапливаются антитела и Т-эффекторные клетки против антигенов. Иммунные комплексы оседают в
самом очаге повреждения, на стенках сосудов прилежащих отделов микроциркуляторного русла, способствуя усилению лейкоцитарной реакции и
дальнейшему повреждению тканей.
При остром гнойном воспалении главными эффекторными клетками
элиминации возбудителя из очага воспаления являются нейтрофильные
лейкоциты. Срок жизни этих клеток очень недолог (несколько часов) и для
полноценной реакции неспецифической защиты необходимо постоянное
поступление новых клеток в очаг воспаления. При длительно текущем воспалении главными эффекторными клетками становятся макрофаги. Они
имеют преимущество перед нейтрофилами: их продолжительность жизни
несравненно больше. Макрофаги выполняют фагоцитарную функцию, участвуя в неспецифическом иммунном ответе; презентируют микробные антигены Т-хелперам, тем самым давая начало специфическому иммунному
ответу (гуморальному и клеточному); способствуют активации и хемотаксису нейтрофилов и лимфоцитов в очаг воспаления (выделяя цитокины
ИЛ-1, ИЛ-6, ИЛ-8, лейкотриен В4, фрагменты комплемента С5); а также
стимулируют рост соединительной ткани вокруг очага воспаления для создания барьера вокруг инфекционного агента и ускорения заживления поврежденной ткани.
При длительно текущем воспалительном процессе в очаге повреждения возникает инфильтрат, который состоит преимущественно из клеток
макрофагальной системы и лимфоцитов. При этом значительно уменьшается содержание макрофагов эффекторов, т.е. макрофагов, элиминирующих чужеродный антиген, что прежде всего связано с особенностями самого антигена. Вследствие этого резко замедляются процессы очищения ткани от продуктов распада и иммунных комплексов. Ослабевают медиаторные межклеточные взаимодействия, они становятся достаточно однотипными. Длительно отсутствует динамика клеточных реакций, нарушается взаимодействие макрофагов с фибробластамн и эндотелием
Все это приводит к торможению фазы пролиферации. Формируется
неполноценная грануляционная ткань (с малым количеством фибробластов и сосудов, с резким отеком межуточного вещества), быстро подвергающаяся процессам деструкции.
Продукты распада образовавшейся ткани и персистирующий повреждающий фактор вызывают сенсибилизацию с формированием реакций
Гиперчувствительности, проявляющихся в фибриноидном некрозе стенок
сосудов и тканей.
Воспаление приобретает характер хронического. В его формировании
и прогрессировании значительная роль принадлежит реакциям гиперчувствительности замедленного типа. Активированные в ходе иммунных реакций лимфоциты и макрофаги стимулируют фибробласты к усиленной
продукции коллагена. Чередование неполноценного склероза, повторного
некроза резко меняют структуру грануляционной ткани, в которой исчезают вертикальные сосуды (рис. 1).
Нарушаются корреляционные взаимоотношения клеток соединительной ткани и эпителия с развитием его воспалительных разрастаний Замыкается порочный круг патологического процесса
Хроническое воспаление при наличии персистенции антигена и сенсибилизации к нему имеет склонность к самопрогрессированию и непрерывному течению с периодами обострения и ремиссии.
В генезе обострений хронического воспаления ведущую роль играют
процессы нарастания титра персистирующего в тканях антигена. Такое
становится возможным при снижении общей иммунной резистентности
организма в результате целого ряда экзогенных воздействий (охлаждение.
перегревание, инфекционные заболевания, стресс и т.п.) или при возникновении эндогенных нарушений эндокринного и иммунного гомеостаза
организма.
Необходимо подчеркнуть, что хроническое воспаление может возникать как исход острого процесса, так и развиваться самостоятельно, при исходно имеющейся в организме больного патологии элиминации повреждающих факторов. Все описанные выше общие закономерности развития и
прогрессирования воспаления, его исходы находят свое прямое отражение
в течения периодонтитов.
Рис.1. Схема грануляционной ткани при нормальной репаративной регенерации (А) и при хронизации воспалительного процесса (Б). Цифрами обозначены слои:
1. Некроза, инфильтрации макрофагами и нейтрофилами
2. Зоны аркадных сосудов.
3. Зоны прямых сосудов.
4. Рыхлой волокнистой соединительной ткани.
5. Грубой волокнистой соединительной ткани.
6. Гиалинизированной соединительной ткани.
7. Костной ткани.
Дата добавления: 2016-11-23; просмотров: 656 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Источник
Механизмы превращения острого воспаления в хроническое сложны и полностью не изучены. Известно, что морфологически острое воспаление характеризуется полиморфоядерной, а хроническое — мононуклеарной инфильтрацией.
Полагают, что острое воспаление развивается в случае, когда раздражитель, продукты его распада, поврежденные клеточные элементы подвергаются деградации фагоцитами, гной удаляется, а возникший экссудат рассасывается.
Это во многом определяется состоянием специфической (иммунопатологической) и неспецифической (клеточной и гуморальной) защиты.
Формированию хронического воспаления, которое, как правило, носит пролиферативный характер, способствует наличие раздражителя в очаге воспаления, образование эндогенных антигенов и наличие эндогенных факторов, которые изменяют тип клеток и их функцию в очаге воспаления.
Действительно, если раздражитель устойчив к действию фагоцитов (возбудители туберкулеза, лепры, сифилиса, сыпного и брюшного тифа, частицы асбеста, угольной пыли, инородные тела) или фагоцитоз ослаблен за счет формирования врожденного или приобретенного иммунодефицита (голодание, сахарный диабет, избыток глюкокортикоидов, потеря белка, действие ионизирующих излучений) наблюдается тенденция к хронизации процесса.
Важной причиной формирования хронического воспаления является образование эндогенных антигенов при аутоиммунных процессах (системной красной волчанке, гломерулонефрите, тиреоидите Хашимито, склеродермии и др.).
Среди эндогенных факторов (лимфокинов), обеспечивающих хронизацию воспаления называют митогенетические факторы, которые образуются в очаге воспаления и стимулируют деление моно- нуклеарных клеток.
Это положение базируется на предположении, что выход ПМЯ- лейкоцитов и мононуклеаров в очаг воспаления обусловлен различными факторами очага воспаления (для ПМЯ-лейкоцитов это комплемент и продукты его превращения, а для моноцитов, макрофагов — митогенный миграцию ингибирующий фактор).
Среди других эндогенных факторов необходимо, вероятно, назвать активацию ингибитора хемотаксиса, которые наблюдаются при гломерулонефрите, циррозе печени, в результате чего тормозится выход в очаг воспаления фагоцитов, а воспаление приобретает хронический характер.
При хроническом воспалении, как правило, вместо альтератив- ных и экссудативных изменений в очаге воспаления на первый план выступают пролиферативные. При этом образуются очаговые или диффузные инфильтраты: полиморфно-клеточные, лимфоцитарно- моноцитарные, макрофагальные, плазмоклеточные, эпителиоклеточ- ные, гигантоклеточные. Такое воспаление получило название пролиферативного или продуктивного воспаления. Оно может развиваться в любом органе и в зависимости от характера классифицируется на интерстициальное (межуточное), гранулематозное и воспаление в виде полипов и кондилом.
Интерстициальное воспаление характеризуется образованием в строме миокарда, печени, почек, легких инфильтрата, состоящего из гистиоцитов, моноцитов, лимфоцитов, плазматических клеток, единичных нейтрофилов и завершается образованием соединительной ткани — соединительнотканным рубцом.
Гранулематозное воспаление наблюдается при туберкулезе, лепре, сифилисе, сыпном и брюшном тифе, бруцеллезе, склероме, а также при пневмокониозах (силикоз, асбестоз). Отличительной особенностью грануляционного воспаления является образование гранулемы (бугорка). В классическом виде, например при туберкулезе, она состоит из лимфоцитов, эпителиоидных, гигантских клеток Пирого- ва-Ланганса с центром казеозного некроза и окружена фиброзной капсулой. Исходом гранулемы, как правило, является некроз с последующим замещением соединительной тканью, т.е. склерозом.
При хроническом воспалении слизистых носа, желудка, кишечника, матки за счет раздражения эпителия и стромы возникает разрастание железистого эпителия и соединительной ткани, что приводит к образованию сосочков, называемых полипами (полипозное воспаление). Если постоянно раздражается плоский эпителий и строма, то возникающие сосочковые образования с острым концом получили название кондилом (кондиломатозное воспаление). Наиболее часто они образуются при гонорее и сифилисе.
Еще по теме Хроническое воспаление:
- Неиммунное хроническое воспаление. Хлопковая гранулема
- Модели иммунного острого воспаления . Локальная реакция Шварцмана — местное воспаление кожи
- Тромбоциты и воспаление
- Часть 3 Воспаление
- Накопление клеток и воспаление
- ВОСПАЛЕНИЕ
- ВОСПАЛЕНИЕ ПРИДАТКОВ
- ВОСПАЛЕНИЕ ПРИДАТКОВ МАТКИ.
- Роль эйкозаноидов в воспалении
- Воспаление
- Воспаление
- Часть 1. Клетки, участвующие в воспалении
- Накопление клеток и воспаление П. К. Уилкинсон (Р. С. Wilkinson)
- Действие на медиаторы воспаления
- Уровни подавления воспаления глюкокортикоидами
- Накопление мононуклеарных фагоцитов в местах воспаления
- Повреждения слизистых оболочек и внутренние воспаления
Источник
Исходами воспаления может быть полное
структурное восстановление; клиническое
выздоровление с частичным восстановлением
ткани и образованием рубцовой ткани,
переход острого воспаления в
хроническое.
2.1.4. Механизмы хронизации воспаления.
Рассматривая механизмы хронизации
следует прежде всего остановиться на
особенностях течения гнойного воспаления
и тех процессах которые могут привести
к затяжному течению острого воспалительного
процесса
Ведущая роль в хронизации воспаления
отводится нарушениям процессов элиминации
повреждающего фактора и поврежденного
клеточного
материала. Учитывая это, на первое место
выступает несостоятельность
системы неспецифического иммунитета,
а именно иейтрофильных лейкоцитов и
макрофагов.
Прогрессирование гнойного воспаления
сопровождается нарастанием
количества микробных антигенов. В крови
накапливаются антитела и Т-эффекторные
клетки против антигенов. Иммунные
комплексы оседают в
самом очаге повреждения, на стенках
сосудов прилежащих отделов
микроциркуляторного русла, способствуя
усилению лейкоцитарной реакции и
дальнейшему повреждению тканей.
При остром гнойном воспалении главными
эффекторными клетками
элиминации возбудителя из очага
воспаления являются нейтрофильные
лейкоциты. Срок жизни этих клеток очень
недолог (несколько часов) и для
полноценной реакции неспецифической
защиты необходимо постоянное
поступление новых клеток в очаг
воспаления. При длительно текущем
воспалении главными эффекторными
клетками становятся макрофаги. Они
имеют преимущество перед нейтрофилами:
их продолжительность жизни
несравненно больше. Макрофаги выполняют
фагоцитарную функцию, участвуя в
неспецифическом иммунном ответе;
презентируют микробные антигены
Т-хелперам, тем самым давая начало
специфическому иммунному
ответу (гуморальному и клеточному);
способствуют активации и хемотаксису
нейтрофилов и лимфоцитов в очаг воспаления
(выделяя цитокины
ИЛ-1, ИЛ-6, ИЛ-8, лейкотриен В4, фрагменты
комплемента С5); а также
стимулируют рост соединительной ткани
вокруг очага воспаления для создания
барьера вокруг инфекционного агента и
ускорения заживления поврежденной
ткани.
При длительно текущем воспалительном
процессе в очаге повреждения возникает
инфильтрат, который состоит преимущественно
из клеток
макрофагальной системы и лимфоцитов.
При этом значительно уменьшается
содержание макрофагов эффекторов, т.е.
макрофагов, элиминирующих чужеродный
антиген, что прежде всего связано с
особенностями самого антигена. Вследствие
этого резко замедляются процессы
очищения ткани от продуктов распада и
иммунных комплексов. Ослабевают
медиаторные межклеточные взаимодействия,
они становятся достаточно однотипными.
Длительно отсутствует динамика клеточных
реакций, нарушается взаимодействие
макрофагов с фибробластамн и эндотелием
Все это приводит к торможению фазы
пролиферации. Формируется
неполноценная грануляционная ткань (с
малым количеством фибробластов и
сосудов, с резким отеком межуточного
вещества), быстро подвергающаяся
процессам деструкции.
Продукты распада образовавшейся ткани
и персистирующий повреждающий фактор
вызывают сенсибилизацию с формированием
реакций
Гиперчувствительности, проявляющихся
в фибриноидном некрозе стенок
сосудов и тканей.
Воспаление приобретает характер
хронического. В его формировании
и прогрессировании значительная роль
принадлежит реакциям гиперчувствительности
замедленного типа. Активированные в
ходе иммунных реакций лимфоциты и
макрофаги стимулируют фибробласты к
усиленной
продукции коллагена. Чередование
неполноценного склероза, повторного
некроза резко меняют структуру
грануляционной ткани, в которой исчезают
вертикальные сосуды (рис. 1).
Нарушаются корреляционные взаимоотношения
клеток соединительной ткани и эпителия
с развитием его воспалительных разрастаний
Замыкается порочный круг патологического
процесса
Хроническое воспаление при наличии
персистенции антигена и сенсибилизации
к нему имеет склонность к самопрогрессированию
и непрерывному течению с периодами
обострения и ремиссии.
В генезе обострений хронического
воспаления ведущую роль играют
процессы нарастания титра персистирующего
в тканях антигена. Такое
становится возможным при снижении общей
иммунной резистентности
организма в результате целого ряда
экзогенных воздействий (охлаждение.
перегревание, инфекционные заболевания,
стресс и т.п.) или при возникновении
эндогенных нарушений эндокринного и
иммунного гомеостаза
организма.
Необходимо подчеркнуть, что хроническое
воспаление может возникать как исход
острого процесса, так и развиваться
самостоятельно, при исходно имеющейся
в организме больного патологии элиминации
повреждающих факторов. Все описанные
выше общие закономерности развития и
прогрессирования воспаления, его исходы
находят свое прямое отражение
в течения периодонтитов.
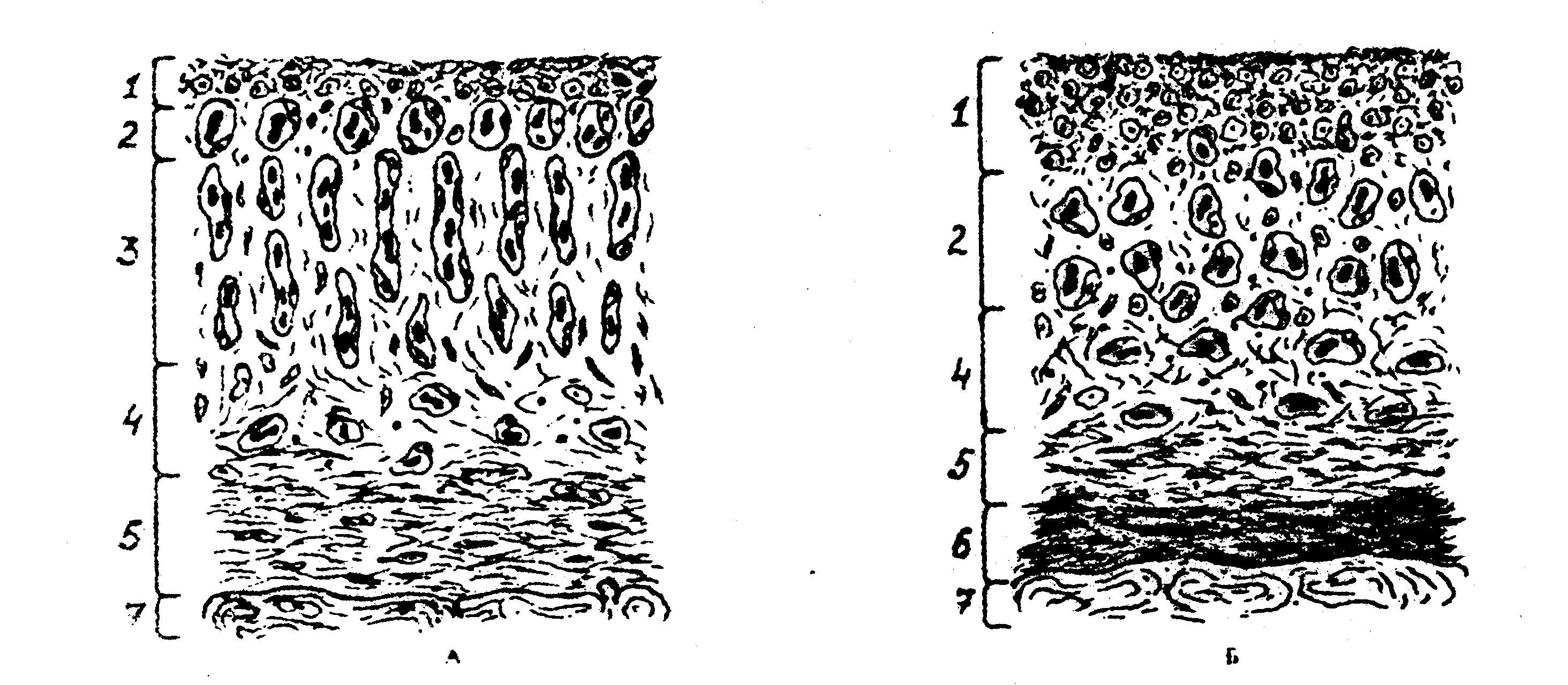
Рис.1. Схема грануляционной ткани при
нормальной репаративной регенерации
(А) и при хронизации воспалительного
процесса (Б). Цифрами обозначены слои:
Некроза, инфильтрации макрофагами и
нейтрофилами
2. Зоны аркадных сосудов.
3. Зоны прямых сосудов.
4. Рыхлой волокнистой соединительной
ткани.
5. Грубой волокнистой соединительной
ткани.
6. Гиалинизированной соединительной
ткани.
7. Костной ткани.
Источник
Исходами воспаления может быть полное структурное восстановление; клиническое выздоровление с частичным восстановлением ткани и образованием рубцовой ткани, переход острого воспаления в хроническое.
Рассматривая механизмы хронизации следует, прежде всего, остановиться на особенностях течения гнойного воспаления и тех процессах, которые могут привести к затяжному течению острого воспалительного процесса.
Ведущая роль в хронизации воспаления отводится нарушениям процессов элиминации повреждающего фактора и поврежденного клеточного материала. Учитывая это, на первое место выступает несостоятельность системы неспецифического иммунитета, а именно иейтрофильных лейкоцитов и макрофагов.
Прогрессирование гнойного воспаления сопровождается нарастанием количества микробных антигенов. В крови накапливаются антитела и Т-эффекторные клетки против антигенов. Иммунные комплексы оседают в самом очаге повреждения, на стенках сосудов прилежащих отделов микроциркуляторного русла, способствуя усилению лейкоцитарной реакции и дальнейшему повреждению тканей.
При остром гнойном воспалении главными эффекторными клетками элиминации возбудителя из очага воспаления являются нейтрофильные лейкоциты. Срок жизни этих клеток очень недолог (несколько часов) и для полноценной реакции неспецифической защиты необходимо постоянное поступление новых клеток в очаг воспаления. При длительно текущем воспалении главными эффекторными клетками становятся макрофаги. Они имеют преимущество перед нейтрофилами: их продолжительность жизни несравненно больше. Макрофаги выполняют фагоцитарную функцию, участвуя в неспецифическом иммунном ответе; презентируют микробные антигены Т-хелперам, тем самым давая начало специфическому иммунному ответу (гуморальному и клеточному); способствуют активации и хемотаксису нейтрофилов и лимфоцитов в очаг воспаления (выделяя цитокины ИЛ-1, ИЛ-6, ИЛ-8, лейкотриен В4, фрагменты комплемента С5); а также стимулируют рост соединительной ткани вокруг очага воспаления для создания барьера вокруг инфекционного агента и ускорения заживления поврежденной ткани.
При длительно текущем воспалительном процессе в очаге повреждения возникает инфильтрат, который состоит преимущественно из клеток макрофагальной системы и лимфоцитов. При этом значительно уменьшается содержание макрофагов эффекторов, т.е. макрофагов, элиминирующих чужеродный антиген, что, прежде всего, связано с особенностями самого антигена. Вследствие этого резко замедляются процессы очищения ткани от продуктов распада и иммунных комплексов. Ослабевают медиаторные межклеточные взаимодействия, они становятся достаточно однотипными. Длительно отсутствует динамика клеточных реакций, нарушается взаимодействие макрофагов с фибробластамн и эндотелием.
Все это приводит к торможению фазы пролиферации. Формируется неполноценная грануляционная ткань (с малым количеством фибробластов и сосудов, с резким отеком межуточного вещества), быстро подвергающаяся процессам деструкции.
Продукты распада образовавшейся ткани и персистирующий повреждающий фактор вызывают сенсибилизацию с формированием реакций гиперчувствительности, проявляющихся в фибриноидном некрозе стенок сосудов и тканей.
Воспаление приобретает характер хронического. В его формировании и прогрессировании значительная роль принадлежит реакциям гиперчувствительности замедленного типа. Активированные в ходе иммунных реакций лимфоциты и макрофаги стимулируют фибробласты к усиленной продукции коллагена. Чередование неполноценного склероза, повторного некроза резко меняют структуру грануляционной ткани, в которой исчезают вертикальные сосуды (рис. 1).
Нарушаются корреляционные взаимоотношения клеток соединительной ткани и эпителия с развитием его воспалительных разрастаний. Замыкается порочный круг патологического процесса
Хроническое воспаление при наличии персистенции антигена и сенсибилизации к нему имеет склонность к самопрогрессированию и непрерывному течению с периодами обострения и ремиссии.
В генезе обострений хронического воспаления ведущую роль играют процессы нарастания титра персистирующего в тканях антигена. Такое становится возможным при снижении общей иммунной резистентности организма в результате целого ряда экзогенных воздействий (охлаждение, перегревание, инфекционные заболевания, стресс и т.п.) или при возникновении эндогенных нарушений эндокринного и иммунного гомеостаза организма.
Необходимо подчеркнуть, что хроническое воспаление может возникать как исход острого процесса, так и развиваться самостоятельно, при исходно имеющейся в организме больного патологии элиминации повреждающих факторов. Все описанные выше общие закономерности развития и прогрессирования воспаления, его исходы находят свое прямое отражение в течения периодонтитов.

Рис. 1. Схема грануляционной ткани при нормальной репаративной регенерации (А) и при хронизации воспалительного процесса (Б). Цифрами обозначены слои:
- 1. Некроза, инфильтрации макрофагами и нейтрофилами
- 2. Зоны аркадных сосудов
- 3. Зоны прямых сосудов
- 4. Рыхлой волокнистой соединительной ткани
- 5. Грубой волокнистой соединительной ткани
- 6. Гиалинизированной соединительной ткани
- 7. Костной ткани
Источник

