Медиаторы иммунного ответа и воспаления
Антигены тканевой совместимости и система комплимента.
Как мы уже знаем, в основе процессов отторжения пересаженных тканей лежат иммунные реакции. В настоящее время установлено, что причиной отторжения является генетическое несоответствие клеток донора и реципиента. Обнаружены специальные участки генома, контролирующие этот процесс. Общее число их достигает нескольких десятков, но только один из них, называемый главным комплексом гистосовместимости, определяет быстрое отторжение. Продукты главного комплекса гистосовместимости, вызывающие реакцию отторжения и участвующие в иммунологическом узнавании, экспрессированы на поверхности клеток и называются антигенами гистосовместимости. В 1980 г. работа трех ученых, внесших решающий вклад в развитие представлений об антигенных главных комплексах гистосовместимости,- Ж. Доссе (Франция), Дж. Д. Снелл (США) и Б. Бенасерраф (США),- была отмечена Нобелевской премией. Принято различать антигены гистосовместимости I, II и III классов. Наиболее изучены антигены гистосовместимости I класса — основные трансплантационные антигены, по которым Т-киллеры изучают чужеродные клетки. Антигены гистосовместимости I класса есть на всех ядерных клетках организма. Они состоят из двух нековалентно связанных субъединиц: интегрального мембранного гликопротеина с молекулярной массой 45 000 (тяжелой субъединицы), имеющего три надмембранных домена (альфа- а3), и бета2-микроглобулина бета2М — неполиморфного полипептида с молекулярной массой 12000 (рис. 7).
Только тяжелая субъединица кодируется главным комплексом гистосовместимости, в то время как ген бета2-микроглобулина находится на другой хромосоме (второй у мыши и пятнадцатой у человека). Тяжелая цепь содержит ковалентно связанные олигосахариды и определяет антигенную специфичность молекулы.
Белки комплемента. Это набор общих белков, которые сотрудничают с иммуноглобулинами и обеспечивают эффективную иммунную реакцию. Используя различные типы взаимодействия, такие белки присоединяются к комплексу антиген-антитело и помогают клеткам иммунной системы всасывать и обрабатывать антиген. Группы антигенов с антителами также отвечают за выделение гистамина.
Необходимым условием для предотвращения разрушительного действия комплемента на собственный организм является наличие эффективных механизмов обратной регуляции. Существует два основных механизма такой регуляции. Первый — за счет действия ряда ингибиторных белков, которые связываются с активированными компонентами комплемента и блокируют их дальнейшее действие. Такие ингибиторы имеются, например, для С1 и СЗЬ. Второй механизм основан на нестабильности некоторых компонентов каскада, в частности С4.
В настоящее время практически все белки системы комплемента выделены в чистом виде и охарактеризованы, установлена полная первичная структура многих из них. Впервые работы по изучению структуры компонентов комплемента были проведены лабораториями Р. Портера (Великобритания) и Г. Фэя (США).. Молекула Clq содержит в своем составе большое число остатков гидроксилизина и гидрокси-пролина, а также углеводы (глюкозу и галактозу).
Нативная молекула Clq, имеющая молекулярную массу около 400 000, состоит из трех таких димеров, связанных нековалентными взаимодействиями между коллагеновыми частями цепей. Внешне такая молекула напоминает букет тюльпанов.
Необычная структура Clq-компонента комплемента объясняется характером выполняемых им функций. Глобулярные области ответственны за связывание с Fc-фрагментами иммуноглобулинов, причем для активации каскада необходимо, чтобы произошло связывание с участием как минимум двух «головок». Структурное разнообразие и полифункциональность характерны и для других компонентов комплемента.
Естественно, что активация комплемента может представлять известную угрозу и для организма хозяина. Однако в норме антитело фиксирует комплемент только на чужеродных клетках.
Цитокины. Эти белки во многом управляют иммунной реакцией организма. Они создаются лимфоцитами и моноцитами, поэтому называются, как лимфокины и монокины соответственно. Для управления иммунной реакцией цитокины используют различные методы. Некоторые увеличивают силу реакции, другие ускоряют деление клеток, а некоторые и тормозят иммунный ответ. Благодаря цитокинам иммунная система работает настолько эффективно, насколько это надо, поскольку чрезмерная активность иммунной системы может только навредить.
Медиаторы иммунного ответа
Интерфероны. В середине 30-х годов было установлено, что заражение животного каким-либо вирусом защищает его от последующего заражения другим вирусом; это явление получило название вирусной интерференции. Однако потребовалась почти четверть века, прежде чем был выделен в индивидуальном состоянии агент, ответственный за это явление. В 1957 г. английские ученые А. Айзеке и Д. Линденман впервые обнаружили белок, продуцируемый зараженными вирусом клетками, и назвали этот белок интерфероном.
Интерфероны — противовирусные агенты универсального действия. Они активны против любых вирусов, но, как правило, обладают видовой специфичностью — каждому виду животных свойствен свой интерферон. Как сейчас установлено, Интерфероны — это семейство белков, каждый со специфическим спектром действия. Существуют лейкоцитарные, или а-интерфероны, фибробластные, или бета-интерфероны, и, наконец, иммунные, или -гамма-интерфероны.
Структура интерферонов была установлена в конце 70-х — начале 80-х годов. Из природных источников эти белки выделяются в весьма небольших количествах, что затрудняло определение их аминокислотных последовательностей традиционными методами белковой химии. Оказалось, что интерфероны представляют собой небольшие белки с молекулярной массой около 17 500. Существенного прогресса удалось добиться на основе анализа соответствующих генов и сравнения полученных результатов с данными по частичной структуре белков. Определение структуры гена белка, для которого не было данных об аминокислотной последовательности, потребовало разработки специального подхода. Эта задача была успешно решена японским ученым Т. Танигучи на примере бета-ин-терферона. Позднее в лаборатории Ч. Вайсмана (Швейцария) была выяснена структура гена а-интерферона, а структура самого белка впервые определена Дж. Шайвели (США). На рисунке 10 приведена последовательность гена альфа-интерферона человека и выведенная из нее структура белка, содержащего 166 аминокислотных остатков.
Следует отметить, что у каждого вида животных имеется несколько альфа-интерферонов (в частности, у человека найдено 14 различных генов альфа-интерферонов), один или несколько бета-интерферонов и всегда один гамма-интерферон. Большинство интерферонов альфа-типа имеют негликозилированные пептидные цепи, тогда как бета и гамма-интерфероны являются гликопротеинами. Как следует из нуклеотидной последовательности, на начальном этапе синтезируется предшественник интерферона, содержащий сигнальный пептид из 23 аминокислотных остатков; последний отщепляется в результате процессинга при секреции белка. (бета- и альфа-интерфероны также синтезируются в виде предшественников (у человека бета-интерферон содержит 166 аминокислотных остатков, а гамма-интерферон — 143 остатка)
альфа- и бета-интерфероны представляют собой типичные глобулярные белки (содержание альфа-спиральных структур составляет 40-75%). В альфа-интерферонах обнаружены две дисульфидные связи.
Механизм биологического действия интерферона в общих чертах выяснен. Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам.
Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2/,5/-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК. являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2′,5′-олигоаденилаты (из АТР), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке, а затем ее лизис. Доказано, что существуют и альтернативные механизмы действия интерферонов (инактивация тРНК, вмешательство в процессы метилирования и т. п.).
Интерфероны — мощные противовирусные агенты. Они во все возрастающем масштабе используются в медицинской практике для лечения вирусных заболеваний, таких, как гепатит, энцефалит, бешенство, герпес и т. п. Имеются достаточно обоснованные данные об эффективности ряда интерферонов против некоторых форм рака. Интерфероны действуют в весьма небольших дозах при местном или внутримышечном применении; при этом в ряде случаев у пациентов отмечается некоторое повышение температуры. В мировой практике в настоящее время накапливается все больший опыт использования интерферонов при самых различных заболеваниях, в том числе при эпидемиях гриппа, аденовирусных инфекциях и т. п. Примечательно, что описаны случаи эффективного использования интерферонов для борьбы с вирусами не только сельскохозяйственных животных, но и многих культурных растений.
В процессе развития защитной реакции организма активированные лимфоциты секретируют набор белков, регулирующих пролиферацию и дифференцировку клеток иммунной системы; для таких белков часто используется термин интерлейкин.
Открытый в 1976 г. в лаборатории Р. Галло (США) интерлейкин 2 (IL2, ранее называвшийся клеточным ростовым фактором) вызывает пролиферацию активированных Т-лимфоцитов и занимает центральное место в каскаде интерлейкинов (или лимфокинов); он продуцируется зрелыми Т-лимфоцитами (Т-хелперами) в результате их стимуляции антигенами.
Он представляет собой сравнительно небольшой гидрофобный белок, содержащий 133 аминокислотных остатка (рис. 12). Аминокислотная последовательность интерлейкина 2 человека определена по структуре соответствующего гена (Т. Танигучи, 1983) и затем подтверждена анализом самого белка.
По характеру биологического действия интерлейкин 2 напоминает гормоны: он продуцируется клетками в весьма малых количествах, активен в концентрациях порядка нескольких пикомолей (на 1 мл), действует на клетку-мишень через соответствующий рецептор на ее поверхности (Kd = 3 — 5х10~12М). «Период полужизни» интерлейкина 2 в кровотоке измеряется минутами.
Интерлейкин 2, получаемый в настоящее время в промышленном масштабе на основе методов генетической инженерии, используется при лечении вирусных заболеваний, иммуно-дефицитов, некоторых форм рака.
Интерлейкины 1 человека представляют собой белки, состоящие из 159 (IL la) и 153 (IL 1р) аминокислотных остатков. В ходе биосинтеза они получаются из высокомолекулярных белков-предшественников (271 и 269 аминокислотных остатков соответственно) .
К группе белков, продуцируемых активированными клетками иммунной системы и родственных интерлейкинам, следует отнести лимфотоксин и фактор некроза опухолей.
Лимфотоксин (LT) был впервые описан в конце 60-х годов как продукт активированных лимфоцитов, обладающий цитостатиче-ской активностью. Действие лимфотоксина на опухолевые клетки заметно усиливается в присутствии гамма-интерферона. Лимфотоксин человека является гликопротеином (171 аминокислотный остаток); углеводная цепь связана N-гликозидной связью с Asn-62 (рис. 130). Фактор некроза опухолей (TNF). TNF вызывает лизис некоторых типов опухолевых клеток. Он вырабатывается активированными макрофагами. Строение TNF человека, проявляющего заметную гомологию с лимфотоксинами, установлено на основе анализа нуклеотиднои последовательности соответствующего гена. Пептидная цепь его состоит из 157 аминокислотных остатков и синтезируется в виде предшественника (233 остатка). Оба цито-токсических фактора реагируют с одним и тем же рецептором поверхности опухолевой клетки (рис.13).
Следует отметить, что лимфотоксин и фактор некроза опухолей рассматриваются в настоящее время как весьма перспективные противораковые препараты и в настоящее время производятся и испытываются биотехнологическими фирмами и центрами в ряде стран мира, включая Россию.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Источник
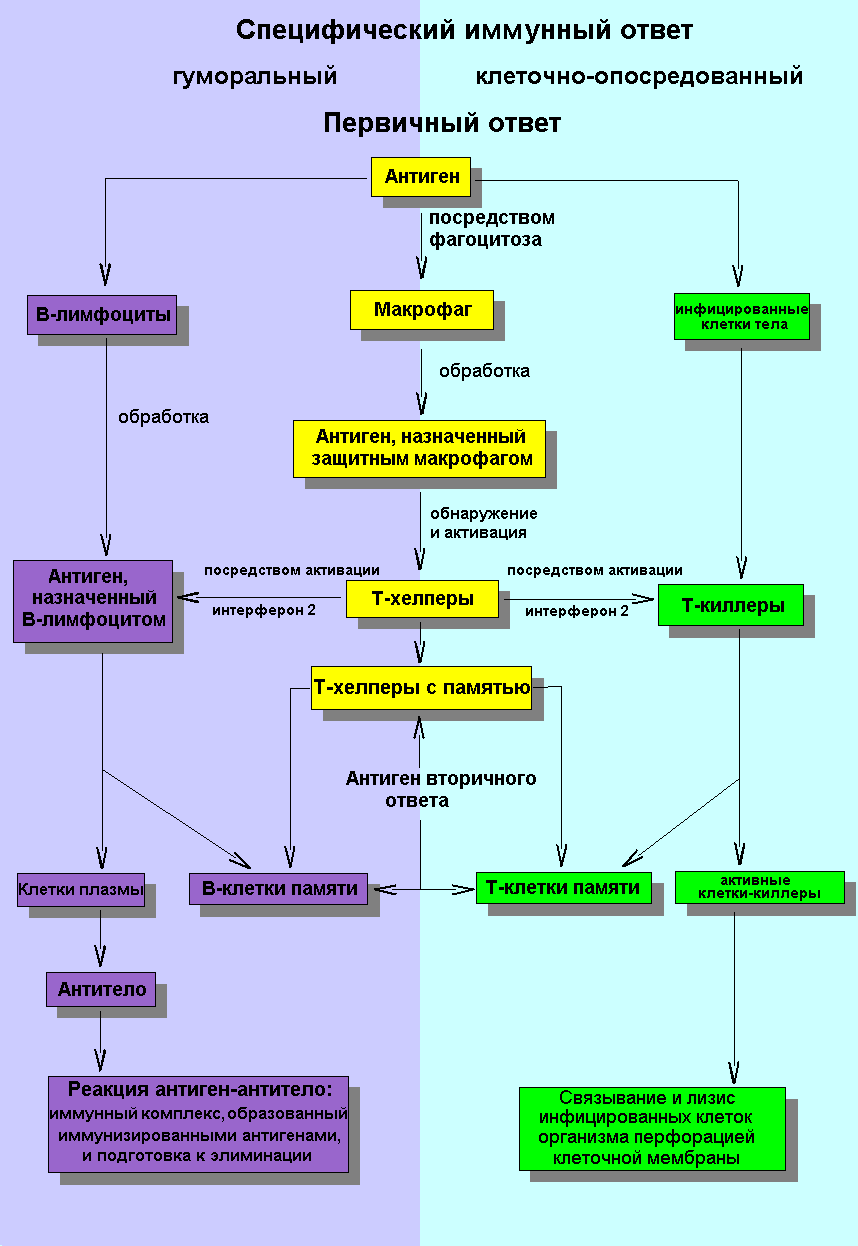
Схематическое представление первичной и вторичной иммунной реакции
Иммунный ответ — это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном, уже распознанным как чужеродный, и направленная на его элиминацию. Явление иммунного ответа лежит в основе иммунитета. Иммунный ответ зависит от:
- антигена — свойства, состав, молекулярная масса, доза, кратность попадания, длительность контакта;
- состояния организма (иммунологическая реактивность);
- условий внешней среды.
Иммунный ответ различается врождённый и приобретённый (или адаптивный). Врождённый — это распознавание чужеродных раздражителей благодаря унаследованным механизмам, в то время как приобретённый иммунный ответ использует для распознавания рецепторы, число которых почти ничем не ограничено и они формируются в организме каждого человека. Приобретённый иммунный ответ может гибко реагировать на чужеродный раздражитель: если тот будет сочтён не опасным, то данный раздражитель в будущем больше не будет вызвать реакции (иммунологическая толерантность). Если же раздражитель классифицирован как опасный, последует продуктивный иммунный ответ, и чужеродные цели-раздражители будут устранены.
Иммунный ответ действует на вторжение болезнетворных микроорганизмов в организм (бактерии, вирусы, грибки, паразиты) либо патологически изменённые клетки собственного тела (злокачественная опухоль). Иммунный ответ против нормальных клеток организма может возникать, когда собственные вещества организма ошибочно воспринимаются как чужеродные (аутоиммунные заболевания). Кроме этого, безвредные вещества из окружающей среды также ошибочно могут быть классифицированы как опасные и вызывать реакцию (аллергия). С другой стороны, если патогенам удаётся избежать иммунного ответа, то это приводит к ускользанию от иммунного ответа (нем. Immunevasion).
Механизмы, которые вызывают устранение вторгнувшихся в организм патогенов в ходе иммунного ответа, чрезвычайно разнообразны. Система комплемента состоит из самоорганизующихся белковых комплексов, которые помечают агента или могут напрямую убить его. Микробицидные вещества высвобождаются клетками вне иммунной системы, также могут быть активированы разнообразные макрофаги и клетки-киллеры, а антитела начнут связываться с высокоспецифичными чужеродными структурами. Обычно несколько таких эффекторных механизмов действуют одновременно с тем, чтобы обеспечить полное удаление патогенов из организма. Тем не менее, чрезмерная реакция иммунной системы должна предотвращаться, так как это может привести к серьёзным повреждениям или даже некрозу тканей, а также летальному исходу (анафилактический или септический шок, гиперцитокинемия). Кроме того, значительная реакция против собственного тела также должна быть исключена, чтобы предотвратить аутоиммунные заболевания. Таким образом, в иммунной системе присутствует множество регуляторных механизмов для того, чтобы соблюдался баланс между защитным и вредным иммунным ответом.
Врождённый иммунный ответ[править | править код]
Во врождённом иммунном ответе участвует большое разнообразие типов клеток и переменных факторов, что в совокупности образует тесно связанную и скоординированную форму защитной системы. Это обусловлено характеристиками возбудителей иммунной реакции, которые распознаются врождёнными рецепторами — отсюда термин «врождённая иммунная реакция». Такой иммунный ответ происходит быстро и эффективно: через считанные минуты после проникновения в организм большинство болезнетворных микроорганизмов обнаруживаются и обезвреживаются, а спустя несколько часов они полностью устранены.
Приобретённый иммунный ответ[править | править код]
Посредством фагоцитоза активированные вирусом макрофаги затем «назначаются» иммунной системой для специфического или адаптивного приобретённого иммунного ответа. В свою очередь он различается на 2 вида: гуморальный и клеточный иммунный ответ.
Гуморальный иммунный ответ[править | править код]
Гуморальный иммунный ответ организма представляет собой антитела против патогенов, в основном находящихся в жидкости крови и лимфы, а также в бесклеточной плазме или в сыворотке крови. Специфические антитела, также называемые иммуноглобулинами, — это белковые молекулы, которые продуцируются и высвобождаются плазматическими клетками и действуют в кровяном и лимфатическом потоках.
Плазматические клетки являются потомками активированных B-лимфоцитов. Активация B-лимфоцита происходит путём связывания соответствующего антигена с распознающим антигены B-клеточным рецептором. Это специфические иммуноглобулины, закреплённые в клеточной мембране B-клетки.
Гиперчувствительность и аллергия[править | править код]
Гиперчувствительность (создаваемая антителами анафилаксия и клеточно-опосредованная аллергия) является приобретённым иммунным ответом с «памятью». Такой иммунный ответ может наступать в качестве контактного дерматита против химически чистых веществ после первичного или нескольких повторных контактов с аллергеном. Клеточно-опосредованным иммунным ответом может являться отторжение экзогенных трансплантированных органов.
Литература[править | править код]
- Jörg Hacker, Jürgen Heesemann. Molekulare Infektionsbiologie. — 1-е издание. — Heidelberg, Berlin: Spektrum Akademischer Verlag, 2000. — ISBN 3-86025-368-9.
- Michael T. Madigan, John M. Martinko. Brock Biology of Microorganisms. — 11-е международное издание. — Upper Saddle River, NJ., USA: Pearson Prentice Hall, 2006. — 992 с. — ISBN 978-0131443297.
- Peter F. Zipfel, Peter Kraiczy, Jens Hellwage: Das tägliche Versteckspiel: Wie Mikroorganismen der Immunabwehr entgehen. Biologie in unserer Zeit 32(6), S. 371 — 379 (2002), ISSN 0045-205X
- Diethard Baron, Jürgen Braun, Andreas Erdmann: Grüne Reihe. Genetik. Materialien S II. (Lernmaterialien)
- Charles A. Janeway, Paul Travers, Mark Walport: Immunobiology. B&T; 6. Auflage (2005) ISBN 0815341016.
Источник
Медиаторы иммунной системы – макромолекулярные вещества, вырабатываемые иммунной системой и участвующие в реализации реакций клеточного и гуморального иммунитета. К ним относятся цитокины (интерлейкины), интерфероны.
Интерлейкины (ИЛ) обеспечивают взаимосвязь отдельных видов лейкоцитов в иммунном ответе. Они представляют собой малые белковые молекулы с молекулярной массой 15000-30000.
ИЛ-1 – соединение выделяемое при антигенной стимуляции моноцитами, макрофагами и другими антигенпрезентирующими клетками. Его действие направлено в основном на Т-хелперы и макрофаги-эффекторы. ИЛ-1 стимулирует гепатоциты, благодаря чему в крови возрастает концентрация белков, получивыших название реактантов острой фазы, т.к. их содержание всегда увеличивается в острую фазу воспаления. К таким белкам относятся фибриноген, С-реактивный белок, а1-антитрипсин и др. Эти белки играют важную роль в репарации тканей, связывают протеолитические ферменты, регулируют клеточный и гуморальный иммунитет.
ИЛ-1 усиливает фагоцитоз, а также ускоряет рост кровеносных сосудов в зонах повреждения.
ИЛ-2 выделяется Т-хелперами под воздействием ИЛ-1 и АГ; является стимулятором роста для всех видов Т-лимфоцитов и активатором НК-клеток.
ИЛ-3 выделяется стимулированными Т-хелперами, моноцитами и макрофагами. Его действие направлено на рост и развитие тучных клеток и базофилов, а также предшественников Т- и В-лимфоцитов.
ИЛ-4 продуцируется стимулированными Т-хелперами, способствует росту и дифференцировке В-лимфоцитов, активирует макрофаги, Т-лимфоциты и тучные клетки, индуцирует продукцию иммуноглобулинов.
ИЛ-5 выделяется стимулированными Т-хелперами и является фактором пролиферации и дифференцировки эозинофилов, а также В-лимфоцитов.
ИЛ-6 продуцируется стимулированными моноцитами, макрофагами, эндотелием, Т-хелперами и фибробластами; вместе с ИЛ-4 способствует росту и дифференцировке В-лимфоцитов, обеспечивая их переход в антителопродуценты, т.е. плазматические клетки.
ИЛ-7 усиливает рост и пролиферацию Т- и В-лимфоцитов, а также влияет на развитие тимоцитов в тимусе.
ИЛ-8 образуется стимулированными моноцитами и макрофагами. Его назначение сводится к усилению хемотаксиса и фагоцитарной активности нейтрофилов.
ИЛ-9 продуцируется Т-лимфоцитами и тучными клетками. Усиливает рост Т-лимфоцитов, стимулирует развитие эритроидных колоний в костном мозге.
ИЛ-10 образуется макрофагами и усиливает пролиферацию зрелых и незрелых тимоцитов, а также способствует дифференцировке Т-киллеров.
ИЛ-11 продуцируется стромальными клетками костного мозга. Играет важную роль в гемопоэзе, особенно тромбоцитопоэзе.
ИЛ-12 усиливает цитотоксичность Т-киллеров и НК-клеток.
Интерфероны — общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемых клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу.
Интерфероны человека подразделяют на три антигенных типа: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и иммунный (γ-интерферон). Лейкоцитарный И. продуцируется лейкоцитами, фибробластный — фибробластами, иммунный — Т-лимфоцитами.
Источник

