Маркеры воспаления сердечная недостаточность
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Белякова И.С.
1
Тарасочкина Д.С.
1
Полунина О.С.
1
Воронина Л.П.
1
Полунина Е.А.
1
1 ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России
Воспаление является одним из ведущих механизмов развития и прогрессирования сердечно-сосудистых заболеваний, в том числе хронической сердечной недостаточности. Исследование и поиск высоко прогностических маркеров воспаления у больных хронической сердечной недостаточностью одна из первостепенных задач современной медицины. В статье приведены данные анализа уровня сывороточных маркеров воспаления (неоптерина, фракталкина, С-реактивного белка). Анализ уровня маркеров воспаления проводился у больных хронической сердечной недостаточностью, разделенных на группы в зависимости от фракции выбросаи в группе контроля (соматически здоровые лица). Сывороточный уровень маркеров воспаления определялся с помощью иммуноферментного анализа. Было выявлено, что значение медианы и интерпроцентильных размахов уровнейсывороточных маркеров воспалениястатистически значимо выше у всех групп больных хронической сердечной недостаточностью по сравнению с группой контроля. В группе больных с низкой фракцией выброса уровнисывороточных маркеров воспаления были статистически значимо выше, чем у больных с сохранной фракцией выброса. Установлено наличие положительной корреляционнойзависимости между уровнем маркеров воспаления и тяжестью клинических проявлений у всех больных хронической сердечной недостаточностью. Полученные результаты свидетельствуют о прогностической роли изученных маркеров воспаления при прогрессировании хронической сердечной недостаточности.
С-реактивный белок
фракталкин
неоптерин
воспаление
хроническая сердечная недостаточность
1. Клинические рекомендации. Хроническая сердечная недостаточность (ХСН). Журнал Сердечная Недостаточность / В.Ю. Мареев [и др.] // Журнал Сердечная Недостаточность. – 2017. – Т. 18, № 1. – С. 3-40. DOI: 10.18087/rhfj.2017.1.2346
2. Шварц Ю.Г. Анализ изменений белого вещества головного мозга и когнитивных расстройств у пациентов с хронической сердечной недостаточностью и ишемической болезнью сердца / Ю.Г. Шварц, Н.С. Акимова, Т.В. Мартынович // Саратовский научно-медицинский журнал. — 2013. — Т. 9, № 1. — С. 78-82.
3. Михайловская Н.С. Клинико-патогенетическая роль иммуновоспалительной активации и эндотелиальной дисфункции у больных ишемической болезнью сердца, ассоциированной с гипотиреозом, по результатам когнитивного моделирования / Н.С. Михайловская, Т.В. Олейник // Запорожский медицинский журнал. – 2017. – Т. 19, № 1(100). – C. 4-8.
4. Kalogeropoulos A. Inflammatory markers and incident heart failure risk in older adults: the Health ABC (Health, Aging, and Body Composition) study / A. Kalogeropoulos, V. Georgiopoulou, B.M. Psaty // J. Am. Coll. Cardiol. — 2010. -Vol. 55 (19). — P. 2129-2137.
5. Lecour S. When are pro-inflammatory cytokines SAFE in heart failure? / S. Lecour, R.W. James // Eur. Heart J. — 2011. — № 32 (6). — P. 680–685.
6. Алиева М.Г. Иммуномаркеры при остром коронарном синдроме при поступлении и при исходе в инфаркт миокарда / М.Г. Алиева // Юг России: экология, развитие. — 2017. — № 4. — С.211-218.
7. Дегтярев О.В. Динамика концентрации сывороточного неоптерина и СРБ, в зависимости от степени развития осложнений у больных острым коронарным синдромом/ О.В. Дегтярев // Young Scientist. – 2016. — № 11 (38). – C. 74-77.
8. Цой Л.Г. Цитокины и хроническая сердечная недостаточность/ Л.Г. Цой // Вестник Кыргызско-Российского Славянского университета. – 2017. –Т. 17, № 7. – С. 72-75.
9. Взаимосвязь повышения уровня фракталкина и дисфункции сосудистого эндотелия при хронической сердечной недостаточности / Е.А. Полунина [и др.] // Астраханский медицинский журнал. — 2014. — Т. 9, № 2. — С. 69-74.
10. Кручинкина Е.В. Иммунный ответ при декомпенсации ишемической хронической сердечной недостаточности / Е.В. Кручинкина, В.В. Рябов // Российский кардиологический журнал. – 2018. — № 1. – С. 72-77. DOI: 10.15829/1560-4071-2018-1-72-77.
11. Фактор некроза опухоли а — маркер системного воспаления у пациентов с сердечной недостаточностью / Е.В. Хазова [и др.] // Практическая медицина. – 2017. — № 2 (103). – С. 24-27.
12. Гипертоническая болезнь и хроническая сердечная недостаточность с сохраненной сократительной способностью левого желудочка: фокус на гендер-специфические особенности провоспалительного статуса / А.В. Барсуков [и др.] // Артериальная гипертензия. – 2017. — № 23 (5). – С. 457-467. DOI: 10.18705/1607-419X-2016-22-5-457-467.
13. Драпкина О.М. Новые акценты в изучении патогенеза хронической сердечной недостаточности с сохраненной фракцией выброса: фокус на маркеры воспаления / О.М. Драпкина, Л.О. Палаткина // Рациональная фармакотерапия в кардиологии. – 2014. — № 3, Т. 10. – С. 317-321.
В настоящее время по данным ведущих эпидемиологических исследований наблюдается неуклонный, ежегодный рост числа больных хронической сердечной недостаточностью (ХСН), которая является исходом большинства сердечно-сосудистых заболеваний. Несмотря на достигнутые результаты совершенствования методов диагностики и лечения ХСН, к сожалению, сохраняется высокий процент инвалидизации и летальности среди больных ХСН. Распространенность ХСН в РФ составляет около 5,6%, что в 7 раз выше, чем в Европе, а уровень смертности колеблется в пределах от 15 до 50% [1, 2].
В независимости от этиологии ХСН у всех больных увеличивается количество медиаторов воспаления, что способствует прогрессированию заболевания.Установлено, что медиаторы воспаления являются пусковым механизмом для ряда патологических изменений: гипертрофия кардиомиоцитов, нарушение функции сосудистого эндотелия, усиление апоптоза, нарушение процессов коллагенообразования и др. [3-7].
Особое значение в последние десятилетие уделяют изучению цитокинов как высокопрогностических маркеров развития и прогрессирования ХСН, а также изучению белков острой фазы воспаления [8]. Установлено, что увеличение уровня цитокинов имеет корреляционную зависимость с клиническими проявлениями и риском развития летального исхода у больных ХСН. Также, определение их уровня имеет прогностическое значение для выявления ремоделирования миокарда, развития кардиофиброза и других патологических процессов, способствующих прогрессированию ХСН [9-13].
При этом патогенез активации, взаимодействия и влияния на формирование патологических изменений в организме данных медиаторов воспаления до сих пор окончательно не определен. Данный факт свидетельствует об актуальности изучения уровня маркеров воспаления у больных ХСН.
Цель: изучить и проанализировать уровень сывороточных маркеров воспаления –неоптерина, фракталкина, С-реактивного белка у больных хронической сердечной недостаточностью (ишемического генеза) в зависимости от фракции выброса.
Материалы и методы: В данное исследование вошли больные с диагнозом хроническая сердечная недостаточность. Все пациенты были разделены на группы в зависимости от фракции выброса (ФВ) (табл. 1) [7-10].
Таблица 1
Характеристика больных ХСН
Показатель | С сохранной ФВ (50% иболее) n=148 человек | С низкой ФВ (менее 40%) n=132 человек |
Этиология ХСН | Стабильная стенокардия напряжения 2-3 функционального класса, постинфарктный кардиосклероз, фибрилляция предсердий и артериальная гипертония 2-3 степени | |
Возраст, лет | 53 (47; 57) | 56 (53; 58) |
Пол: муж.- жен. — | 50 чел. 98 чел. | 64 чел. 68 чел. |
Тест с 6′ ходьбой, м | 299 (137;532) | 259 (78;527) |
Баллы по ШОКС (шкала оценки клинического состояния при ХСН) | 7 (2;17) | 8 (4;16) |
Длительность симптомов ХСН, лет | 6 (2; 12) | 8 (3; 18) |
Курение | 26 чел. (17,6%) | 34 чел. (25,8%) |
Критерии исключения из исследования | Возраст старше 60 лет, индекс массы тела более 30 кг/ м2, перенесенный инфаркт миокарда в течение последних 6 месяцев, любое острое заболевание | |
Критерии включения | ХСН II-IV функциональный класс с декомпенсацией (одышка или положение ортопное, влажные хрипы, периферические отеки, увеличение пульсации яремных вен, данные на рентгенограмме органов грудной клетки, демонстрирующая признаки застоя по малому кругу кровообращения, содержание в плазме BNP> 150 пгмл или NT-proBNP> 450 пгмл) | |
Примечание: различия между показателями в группах больных, как с сохранной, так и с низкой фракцией выброса, для чистоты анализа сывороточных маркеров воспаления были статистически незначимы.
В качестве группы контроля было обследовано 60 соматически здоровых лиц, среди которых было 38 чел. женского пола и 22 чел. мужского пола, медиана возраста обследуемых составила 51 (45;53) года.
Эхокардиографию (ЭхоКГ) выполняли одним исследователем на ультразвуковом сканере «Vivid 7» (GE DingedUltrasound AS, Норвегия).
Был проанализирован уровень следующих сывороточных маркеров воспаления у больных ХСН:
· Неоптерин (НП), суперсемействохемокинов, цитокин. Определение уровня НП проводилось с помощью иммуноферментного набора для количественного определения НПв плазме крови («Innovation Beyond Limits International», Германия).
· Фракталкин / СХ3СL1 (ФКН), суперсемействохемокинов, цитокин. Определение уровня ФКН в образцах плазмы осуществлялось с помощью иммуноферментного набора для количественного определения в биологических жидкостях («RayBioHumanFractalkine», фирмы «RayBiotech, Inc.», США).
· С-реактивный белок (С-PБ), белок острой фазы воспаления. Определение уровня С-РБ производили с применением диагностического набора «CRP (HS) WideRange HTI» («HighTechnologyInc.», США).
Статистическая обработка полученных данных проводиласьна персональном компьютере с помощью STATISTICA 11.0, (StatSoft, Inc., США). Результаты обработки представлены как Ме[5%-95%](медиана;5-95процентили). Отличия были статистически значимы при значении p<0,05.
Результаты исследования и их обсуждение
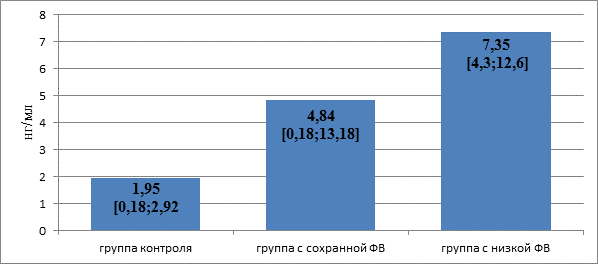
По результатам исследования уровней сывороточных маркеров воспаления в зависимости от ФВ, было установлено, что значение Ме и [5%;95%] уровня НП в группе больных с сохранной ФВ были статистически значимо выше, чем в группе контроля (p=0,002) (рис. 1).

Рис. 1. Уровень неоптерина у больных ХСН в зависимости от фракции выброса
В группе больных с низкой ФВ значение Ме и [5%;95%] уровня НП, было статистически значимо выше по сравнению с группой контроля (p<0,001) и группой больных с сохранной ФВ (p<0,001). При статистической обработке данных обнаружено, что значение 95% в группе больныхс низкой ФВ было статистически незначимо ниже (p=0,072), чем у группы больных с сохранной ФВ.
Полученные результатысвидетельствуют остатистически значимом (p<0,001) увеличении уровня НПу больных с сохранной ФВпо сравнению с группой больных ХСН с низкой ФВ. Это указывает на ассоциацию активации клеточного иммунитета с развитием ХСН, а также отражают роль иммунного воспаления в процессах ремоделирования и снижения сократительной функции миокарда.
Значение Ме и [5%;95%] уровня ФКН в группе больных с сохранной ФВ были статистически значимо выше, чем в группе контроля (p<0,001). В группе больных с низкой ФВ значение Меи [5%;95%] уровня ФКН были статистически значимо выше по сравнению с группой контроля (p<0,001) и группой больных с сохранной ФВ (p=0,038) (рис.2).
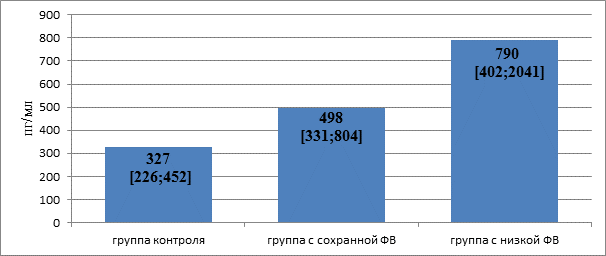
Рис. 2. Уровень фракталкина у больных ХСН в зависимости от фракции выброса
При этом, значение 95% в группе больных с низкой ФВ в 2,5 раза превышало аналогичный показатель в группе больных с сохранной ФВ, что, возможно, и послужило одним из ведущих факторов прогрессирования ХСН.Таким образом, у больных ХСНнаблюдалось статистически значимое увеличение уровня ФКН относительно группы соматически здоровых лиц.Данная тенденция носила более выраженный характер в группе больных с низкой ФВ. Поскольку ФКН является не только провоспалительным, но и хемотаксическим цитокином, увеличение его уровня при ХСН может запускать повреждение миокарда привлеченными лейкоцитами. Этот факт отражает возможность определения уровняФКН не только в качестве высоко прогностического маркера воспалительной активации, но и в качестве терапевтической мишени при разработке лекарственных схем.
Значение Ме и [5%;95%] уровня С-РБ в группе с сохранной ФВ были статистически значимо выше, чем в группе контроля (p<0,001). В группе с низкой ФВ значение Меи [5%;95%] уровня С-РБ были статистически значимо выше по сравнению с группой контроля и группой с сохранной ФВ (p<0,001, p<0,001) (рис.3).
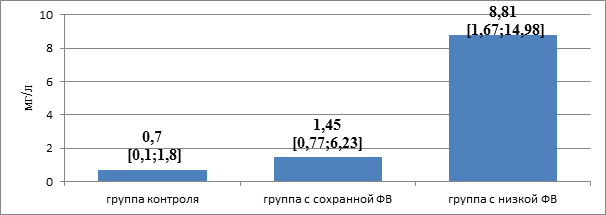
Рис. 3. Уровень С-реактивного белка у больных ХСН в зависимости от фракции выброса
Увеличение уровня классического воспалительного маркера – СРБ – у больных ХСН указывает на роль системной воспалительной активации в развитии ХСН, и позволяет выделить пациентов с высоким сердечно-сосудистым риском, более выраженным в группе больных ХСН с низкой ФВ.
На завершающем этапе исследования мы провели корреляционный анализ между уровнем сывороточных маркеров воспаления и значением ШОКСв исследуемых группах больных ХСН.Было выявленоналичие положительной корреляционнойзависимости между уровнем НП, ФКН и С-РБ и тяжестью клинических проявлений у всех групп больных ХСН, с тенденцией увеличения силы данных связей у больных с низкой ФВ (табл.2).
Таблица 2
Коэффициент корреляции между сывороточными маркерами воспаления и значением ШОКС
Маркервоспаления | Группа с сохранной ФВ | Группа с низкой ФВ |
Неоптерин | r=0,50* | r=0,62* |
Фракталкин | r=0,46* | r=0,60* |
С-РБ | r=0,47* | r=0,56* |
Примечание: * p<0,001
Вывод
По результатам анализа уровня неоптерина, фракталкина и С-реактивного белка у больных ХСНбыло выявлено:
- увеличение значения медианы и интерпроцентильных размахов уровня сывороточных маркеров воспаления (неоптерина, фракталкина и С-реактивного белка)у всех больных ХСН относительно группы контроля;
- увеличение значения медианы и интерпроцентильных размахов уровня сывороточных маркеров воспаления (неоптерина, фракталкина и С-реактивного белка)носило более выраженный характер у больных ХСН с низкой фракцией выброса;
- наличие положительнойкорреляционнойзависимости между уровнем маркеров воспаления и тяжестью клинических проявлений у всех больных ХСН. Сила корреляционнойзависимости была более выражена в группе больных ХСН с низкой фракцией выброса
Полученные данные свидетельствуют о возможности использования определения уровня неоптерина, фракталкина и С-реактивного белка в качестве прогностических маркеров развития и прогресс при хронической сердечной недостаточности)ивозможности использования их в качестве терапевтической мишени с учетом фенотипических особенностей больных ХСН.
Исследование выполнено в рамках реализации гранта Президента РФ по государственной поддержке молодых ученых за проект «Персонализированная диагностика и прогнозирование течения сердечно – сосудистых заболеваний» (МК-6200.2018.7).
Библиографическая ссылка
Белякова И.С., Тарасочкина Д.С., Полунина О.С., Воронина Л.П., Полунина Е.А. СЫВОРОТОЧНЫЕ МАРКЕРЫ ВОСПАЛЕНИЯ ПРИ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ // Современные проблемы науки и образования. – 2018. – № 2.;
URL: https://science-education.ru/ru/article/view?id=27563 (дата обращения: 31.05.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Проведено сравнительное исследование по оценке содержания провоспалительных цитокинов, биомаркеров воспалительного процесса, биохимических индикаторов сердечной недостаточности (СН) и гемодинамических параметров у больных с хронической сердечной недостаточностью (ХСН) на фоне алкогольной кардиомиопатии (АКМП) и ишемической болезни сердца (ИБС). Всего обследованы 62 пациента мужского пола с клинической картиной ХСН III—IV функциональных классов (ФК) по NYHA, из них 45 — с АКМП и 17 — с ИБС. Отмечены значительное снижение величины фракции выброса (ФВ), дилатация всех камер сердца, а также повышение индекса массы миокарда левого желудочка (ЛЖ) в обеих группах больных. При этом относительная толщина стенки (ОТС) ЛЖ не выходит за пределы нормы, а у больных АКМП достоверно ниже, чем в группе ИБС, что соответствует эксцентрическому типу гипертрофии миокарда. Повышение класса NYHA сочетается с дальнейшим снижением ФВ и повышением конечного диастолического и конечного систолического размеров ЛЖ, а также размером правого желудочка у больных АКМП, а у больных ИБС существенно (на 30%) увеличивается размер предсердий. В плазме крови у больных ИБС выявляется существенное количество эндотоксина в соответствии с представлением о повышенной проницаемости кишечника при хронической СН. Злоупотребление алкоголем усиливает всасывание эндотоксина, о чем свидетельствует увеличение его концентрации у больных АКМП в 3 раза по сравнению с таковой у больных ИБС. Концентрация в крови таких провоспалительных цитокинов, как интерлейкин (IL) 6, IL-8, IL-12, α-фактор некроза опухоли (TNF-α) и его растворимого рецептора (s-TNF-R) существенно повышена при АКМП. При этом в 2 раза увеличивается концентрация фактора острой фазы воспаления — С-реактивного белка. У больных АКМП также многократно возрастает содержание в крови маркера СН — натрийуретического пептида (НУП). В плазме крови больных ИБС выявлено увеличение концентрации провоспалительных цитокинов IL-6, IL-8 и IL-12, но она в 1,5—2,0 раза ниже, чем в группе АКМП, а содержание в крови TNF-α и s-TNF-R не отличается от нормы. Разделение больных АКМП на подгруппы по классу NYHA позволило выявить более высокий прирост концентрации IL-6, IL-8, TNF-α и мозгового НУП, а также эндотоксина с увеличением тяжести СН. В обеих группах больных содержание IL-12, s-TNF-R, трансформирующего β1-фактора роста (TGF-β1) и факторов острой фазы воспаления не отражает тяжесть проявлений СН. У больных ИБС функциональную недостаточность миокарда в наибольшей степени характеризует содержание в крови IL-6, а у больных АКМП — НУП.
Сердце является одной из основных мишеней для токсического действия алкоголя. Обследование 251 пациента с диагнозом «алкогольная зависимость II—III стадии» выявило симптомы патологии сердца у 70%, а диагнозу «алкогольной кардиомиопатии» (АКМП) соответствовали 25% пациентов [1]. Признаки алкогольного поражения сердца обнаруживают у 10—35% лиц, умерших внезапной смертью. Классическая АКМП относится к категории дилатационных и сопровождается пароксизмальной или постоянной фибрилляцией предсердий с признаками недостаточности кровообращения. Прогрессирование АКМП приводит к хронической сердечной недостаточности (ХСН).
Согласно современным представлениям ХСН прогрессирует в результате активации нейрогормонов и выделения цитокинов в ответ на первичное повреждение миокарда [2]. Наиболее важными для развития ХСН считают провоспалительные цитокины: α-фактор некроза опухоли (TNF-α), интерлейкин (IL) 1, IL-6. Они секретируются главным образом мононуклеарными фагоцитами, однако могут вырабатываться и клетками миокарда. Предложена гипотеза, согласно которой отек стенки кишечника при ХСН способствует перемещению бактериального эндотоксина в сосуды слизистой оболочки, что приводит к усилению продукции моноцитами провоспалительных цитокинов в общем кровотоке и различных тканях [3]. Злоупотребление алкоголем является дополнительным фактором, повышающим проницаемость стенки кишечника для бактериальных токсинов, включая липополисахариды. Показано усиление продукции IL-6 в периферических тканях на фоне сердечной недостаточности (СН) при сравнении его концентрации в артериальной и венозной крови [4]. У больных с ХСН в крови может возрастать содержание растворимого СD14 — маркера взаимодействия между клетками и эндотоксином [3].
В крови больных с ХСН со периферическими отеками концентрация эндотоксина повышена, но снижается при терапии диуретиками [5]. Эндотоксин является одним из наиболее мощных стимуляторов продукции TNF-α и других провоспалительных медиаторов. TNF-α в свою очередь считают одним из наиболее важных факторов дисфункции и ремоделирования левого желудочка (ЛЖ), усиленного апоптоза кардиомиоцитов, анорексии и кахексии, снижения кровотока в ткани скелетной мускулатуры и дисфункции эндотелия, а также резистентности к инсулину при СН [1, 6]. Системное введение крысам TNF-α в концентрациях, сопоставимых с теми, что обнаруживают у больных с ХСН, приводит к изменениям в ткани сердца, которые имеют признаки кардиомиопатии при СН [7]. При этом гиперэкспрессия TNF-α в кардиомиоцитах способствует развитию фенотипа сердца, имитирующего отдельные аспекты ХСН, такие как гипертрофия, дилатация желудочков, фиброз, дисфункция клеток [8]. IL-6, концентрация которого возрастает у больных с ХСН, может вызывать гипертрофию миоцитов, дисфункцию миокарда и атрофию скелетных мышц [9]. У генно-модифицированных мышей показана связь IL-6 и его рецепторной субъединицы gp130 с СН [10]. Системное введение крысам IL-6 приводит к концентрической гипертрофии ЛЖ, накоплению коллагена в интерстициальной ткани сердца и повышенной упругости миокарда [11]. Кроме того, в эксперименте показано, что IL-18 повышает экспрессию и образование остеопонтина, который стимулирует фиброз интерстициальной ткани миокарда, а также трансформирующего β1-фактора роста (TGF-β1), усиливающего синтез коллагена и угнетающего активность матриксных металлопротеиназ [12]. Повышенный синтез и пониженная деградация коллагена, а также увеличение активности лизилоксидазы-1, вызывающей образование межмолекулярных сшивок и формирование нерастворимой коллагеновой сети, могут со временем привести к диастолической дисфункции сердца.
В ткани миокарда больных с идиопатической дилатационной кардиомиопатией выявляется IL-1. Кардиотропные эффекты IL-1 включают угнетение сократимости миокарда, стимуляцию апоптоза и гипертрофии миокарда, а также аритмогенный эффект.

Провоспалительные цитокины могут изменять функции миокарда посредством ряда механизмов, включающих стимуляцию гипертрофии и фиброза при прямом действии на кардиомиоциты и фибробласты, угнетения сократимости миокарда за счет влияний на внутриклеточный транспорт Са2+ и передачу сигнала через β-адренорецепторы, индукцию апоптоза и стимуляцию генов, участвующих в ремоделировании миокарда [13]. Непрямой эффект провоспалительных медиаторов в патогенезе ХСН может состоять в угнетении костномозгового кроветворения с развитием анемии, неадекватной активации эндотелия и угнетения сократимости скелетной мускулатуры.
Классический маркер острого воспаления и ответа острой фазы — С-реактивный белок (СРБ) — исследовали у 188 пациентов с идиопатической дилатационной кардиомиопатией [14]. У всех из них фракция выброса (ФВ) ЛЖ была снижена на 40% или больше. Ряд пациентов умерли в течение 5-летнего периода наблюдения, причем в этой группе концентр…
- Axelrod A.S., Gilyarov M.Y., Ivankov N.I. et al. Alcoholic cardiomyopathy: what is real in cardiology practice? Cardiology and cardiovascular Heer 2011;5:46—50. Russian (Аксельрод А.С., Гиляров М.Ю., Иванкова Н.И. и др. Алкогольная кардиомиопатия: что реально в кардиологической практике? Кардиол и сердечно-сосудистая хир 2011;5:46—50).
- Mann D.L. Inflammatory mediators and the failing heart: past, present, and the foreseeable future. Circ Res 2002;91:988—998.
- Anker S.D., Egerer K.R., Volk H.D. et al. Elevated soluble CD14 receptors and altered cytokines in chronic heart failure. Am J Cardiol 1997;79:1426—1430.
- Tsutamoto T., Hisanaga T., Wada A. et al. Interlukin-6 spillover in the peripheral circulation increases with the severity of heart failure, and the high plasma level of interleukin-6 is an important prognostic predictor in patients with congestive heart failure. J Am Coll Cardiol 1998;31:391—398.
- Niebauer J., Volk H.D., Kemp M. et al. Endotoxin and immune activation in chronic: a prospective cohort study. Lancet 1999;353:1838—1842.
- Von Hehling S., Jankowska E.A., Anker S.D. Tumor necrosis factor-alpha and the failing heart: pathophysiology and therapeutic implications. Basic Res Cardiol 2004;99:1479—1486.
- Bozkurt B., Kribbs S.B., Clubb F.J. et al. Pathophysiologically relevant concentrations of tumor necrosis factor-alpha promote progressive dysfunction and remodeling in rats. Circulation 1998;97:1382—1391.
- Kubota T., McTernan C.F., Fye C.S. et al. Dilated cardiomyopathy in transgenic mice with cardiac-specific overexpression of tumor necrosis factor-alpha. Circ Res 1997;81:627—635.
- Seta Y., Shan K., Bozkurt B. et al. Basic mechanisms in heart failure: the cytokine hypothesis. J Card Fail 1996;2:243—249.
- Fischer P., Hilfiker-Kleiner D. Role of gp130-mediated signaling pathways in the heart and its impact on potential therapeutic aspects. Br J Pharmacol 2008;153:414—427.
- Melendez G.C., McLarty J.L., Levick S.P. et al. Interleukin-6 mediates myocardial fibrosis, concentric hypertrophy, and diastolic dysfunction in rats. Hypertension 2010;56:225—231.
- Westermann D., Lindner D., Kasner M. et al. Cardiac inflammation contributes to changes in the extracellular matrix in patients with heart failure and normal ejection fraction. Circulation Heart Fail 2011;4:44—52.
- Mann D.L. Inflammatory mediators and the failing heart: past, present, and the foreseeable future. Circ Res 2002;91:988—998.
- Kaneko K., Kanda T., Yamauchi Y. et al. C-reactive protein in dilated cardiomyopathy. Cardiology 1999;91:215—219.
- Anand I.S., Latini R., Florea V.G. et al. C-reactive protein in heart failure: prognostic value and the effect of valsartan. Circulation 2005;112:1428—1434.
- Bolger A.P., Sharma R., von Haehling S. et al. Effect of interleukin-10 on the production of tumor necrosis factor-alpha by peripheral blood mononuclear cells from patients with chronic heart failure. Am J Cardiol 2002;90:384—389.
- Gullestad L., Aass H., Field J.G. et al. Immunomodulating therapy with intravenous immunoglobulin in patients with chronic heart failure. Circulation 2009;103:220—225.
- Ikeuchi M., Tsutsui H., Shiomi T. et al. Inhibition of TGF-beta signaling exacerbates early cardiac dysfunction but prevents late remodeling after infarction. Cardiovasc Res 2004;64:526—535.
- Dempsey P.W., Doyle S.E., He J.Q., Cheng G. The signaling adaptors and pathways activated by TNF superfamily. Cytokine Growth Factor Rev 2003;14:193—209.
- Панченко Л.Ф., Огурцов П.П., Пирожков С.В. и др. Печеночная недостаточность и медиаторы воспалительного ответа при алкогольной болезни печени и кардиомиопатии. Эффект пентоксифиллина. Наркология 2011;6:47—55.
- Lommi J., Pulkki K., Koskinen P. et al. Haemodynamic, neuroendocrine and metabolic correlates of circulating cytokine concentrations in congestive heart failure. Eur Heart J 1997;18:1620—1625.
- Rauchhaus M., Doehner W., Francis D.P. et al. Plasma cytokine parameters and mortality in patients with chronic heart failure. Circulation 2000;102:3060—3067.
- Zhu X., Coleman R.A., Alber C.T. et al. Chronic ethanol ingestion by mice increases expression of CD80 and CD86 by activated macrophages. Alcohol 2004;32:91—100.
- Silver M.A., Maisel A., Yancy C.W. et al. BNP Consensus Panel 2004: A clinical approach for the diagnostic, prognostic, screening, treatment monitoring, and therapeutic roles of natriuretic peptides in cardiovascular diseases. Congest Heart Fail 2004;10:5:1—30.
- Ferreira S., Almeida R., Guerrero H. et al. Prognóstico na Insuficiência Cardíaca Descompensada: Papel do NT-proBNP. Rev Port Cardiol 2007;28:535—545.
- Take Y., Nakata K., Hashimoto J. et al. Specifically modified osteopontin in rheumatoid arthritis fibroblast-like synoviocytes supports interaction with B cells and enhances production of interleukin-6. Arthritis Rheum 2009;60:3591—3601.
- Eriksson U., Kurrer M.O., Schmitz N. et al. Interleukin-6-deficient mice resist development of autoimmune myocarditis associated with impaired upregulation of complement C3. Circulation 2003;107:320—325.
- Rochman I., Paul W.E., Ben-Sasson S.Z. IL-6 increases primed cell expansion and survival. J Immunol 2005;174:4761—4767.
- Afanasyeva M., Wang Y., Kaya Z. et al. 2001b. Interleukin-12 receptor/STAT4 signaling is required for the development of autoimmune myocarditis in mice by an interferon-independent pathway. Circulation 2001;104:3145—3151.
- Lane J.R., Neumann D.A., Lafond-Walker A. Interleukin 1 or tumor necrosis factor can promote Coxsackie B3-induced myocarditis in resistant B10.A mice. J Exp Med 1992;175:1123—1129.
- Lane J.R., Neumann D.A., Lafond-Walker A. et al. LPS promotes CB3-induced myocarditis in resistant B10.A mice. Cell Immunol 1991;136:219—233.
ФГБУ «Национальный научный центр наркологии» Минздрава РФ, Москва
Лаборатория биохимии
Панченко Л.Ф. — д.м.н., проф., акад. РАН, зав. лабораторией.
Пирожков С.В. — д.м.н., проф. вед.н.с. лаборатории.
Теребилина Н.Н. — к.м.н., вед.н.с. лаборатории.
Наумова Т.А. — к.биол.н., вед.н.с. лаборатории.
Баронец В.Ю. — ст.н.с. лаборатории.
Федеральное государственное автономное образовательное учреждение высшего образования «Российский университет дружбы народов» (РУДН), Москва
Кафедра факультетской терапии
Моисеев В.С. — д.м.н., акад. РАН, зав. кафедрой.
Гончаров А.С. — аспирант кафедры.
E-mail: biochn@mail.ru
Источник

