Клеточный ответ при воспалении

Эта форма иммунного ответа предназначена для защиты от внутриклеточных патогенов, локализующихся в цитоплазматических гранулах — микроорганизмов, фагоцитированных клетками, но не разрушенных из-за недостатка адекватных эффекторных механизмов или их блокады патогенами. Типичные представители таких патогенов — различные виды микобактерий, а также многие простейшие (например, лейшмании, хламидии), риккетсии, плазмодии, грибы (кандиды) и др.
Клеточный иммунный ответ воспалительного типа осуществляется в 4 этапа (рис. 3.109).
- Презентация дендритными клетками антигена CD4+ Т-лимфоци- там, приводящая к их активации.
- Развитие хелперных Т-лимфоцитов типа ТЫ.
- Презентация антигена макрофагами ранее сформировавшимся Т-хелперам (ТЫ-типа), их взаимная активация и выделение цитокинов.
- Активация цитолиза в фагосомах макрофагов.
За реализцию этой формы защиты отвечают Thl-клетки и макрофаги. Thl-клетки формируются на этапе запуска иммунного ответа и отвечают за специфическую составляющую реакции (распознавание антигена и направление реакции на его носителя). Макрофаги выступают в качестве эффекторных клеток. Начальный этап реакции против внутриклеточных патогенов, локализованных в фаголизосомах, осуществляется так же, как при запуске любой формы иммунного ответа: дендритные клетки, захватившие патоген или его фрагмент, презентируют антигенный пептид CD4+ Т-клеткам, которые активируются, пролиферируют и дифференцируются в хелперные Т-лимфоциты. Уже на этапе распознавания антигена происходит ориентация дифференцировки CD4+ Т-лимфоцитов в хелперы Thl-типа, которая затем поддерживается цитокинами, продуцируемыми дендритными клетками — IL-12, IFNy (см. раздел 2.5.5.5).

Рис. 3.109. Схема развития клеточного иммунного ответа воспалительного типа
Активирующее взаимодействие Thl-клеток с макрофагами
Этот этап характерен именно для воспалительного иммунного ответа. Он состоит во взаимодействии специфических TM-клеток с макрофагами, которые содержат на своей поверхности молекулы MHC-II, несущие пепидный фрагмент антигена. При взаимодействии формируется иммунный синапс. В результате генерируются активирующие сигналы, направленные как в ТЫ-клетку, так и в макрофаг. В TW-лимфоцит сигналы поступают через молекулы TCR/CD4 и CD28. В результате этой повторной стимуляции Т-клетки (первая стимуляция была вызвана презентацией антигена дендритной клеткой) происходит усиление выработки цитокинов, важных для реализации последующих событий (в частности IFNy и TNFa).
Стимуляция макрофага при взаимодействии с TW-клеткой реализуется с помощью двух механихмов (рис. 3.110). Один из них — контактный — через костимулирующую молекулу CD40, с которой связывается ее лиганд CD154. CD40 спонтанно экспрессируется макрофагами, тогда как ее лиганд появляется на поверхности TM-клеток в результате активации при формировании иммунного синапса. В передаче сигнала от молекулы CD40 участвуют адапторные факторы TRAF-1, TRAF-2, TRAF-6. В результате происходят активация фактора NF-kB и запуск Rac-зависимой ветви MAP-каскада, завершающейся формированием транскрипционного фактора с-Jun. Второй механизм активации опосредуется IFNy. При связывании этого цитокина с рецептором включается сигнальный путь, вовлекающий киназы Jak1 и Jak2, транскрипционный фактор STAT1, а также дополнительные пути с участием MAP-каскада.
Результат активации макрофагов — экспрессия многочисленных генов, приводящая к повышению содержания на поверхности клетки молекул MHC-I и особенно MHC-II, сборке NADPH-оксидазы, активации ферментов окислительного метаболизма. Наиболее специфичное проявление ответа макрофагов на стимулирующее действие IFNy — экспрессия гена индуцибельной NO-синтазы. Именно NO и его производные, такие

Рис. 3.110. Активация макрофагов Т-хелперами. Показаны механизмы воздействия Thl-клеток на макрофаги (контактный и опосредованный цитокинами), а также индуцируемые Т-клетками проявления активации макрофагов
как пероксинитрит (ОО*NO), вызывают гибель микобактерий и других внутриклеточных патогенов, сохранявшихся и даже размножавшихся в фагосомах. Все эффекты IFNy, в том числе способность индуцировать образование NO-синтазы, усиливаются TNFa, продуцируемым как Th1- клетками, так и самими макрофагами. Эффективность действия цитокинов, вырабатываемых TM-клетками, существенно повышается в связи с сосредоточением их секреции в области контакта с макрофагами. Это, кроме того, уменьшает активацию посторонних клеток и их повреждение. Для обеспечения этой ориентированной секреции необходима поляризация клеток в ходе формирования иммунного синапса.
Особого внимания заслуживает взаимодействие цитокинов IL-12 и IFNy при воспалительном иммунном ответе (рис. 3.111). Экспрессия IL-12 в макрофагах индуцируется при связывании PAMP с TLR. Экспрессия гена IL12 — один из результатов сигнального пути, вовлекающего адапторный белок MyD88 и транскрипционный фактор NF-kB. IL-12 играет решающую роль в индукции дифференцировки TM-клеток и стимулирует выработку этими клетками IFNy, один из важнейших эффектов которого — усиление выработки макрофагами IL-12. Таким образом, эти цитокины вместе с рецепторами и сигнальными путями, ответственными за экспрессию их генов, образуют единую функциональную систему, которой принадлежит ключевая роль в реализации воспалительной формы клеточного иммунного ответа. Дефекты в любом звене этой системы приводят к развитию иммунодефицитов, сопровождающихся повышенной чувствительностью к микобактериям и другим патогенам, в ответ на которые вовлечены ТЫ-клетки и макрофаги.
Воспалительная составляющая Thl-клеточного иммунного ответа
В отличие от цитотоксического иммунного ответа, не связанного очевидным образом с воспалительной реакцией, иммунный ответ, опосредованный TW-клетками, полностью реализуется в ее рамках. Запуск ответа происходит по классической схеме. В очаге инфицирования (обычно в

Рис. 3.111. Роль интерферона у в дифференцировке и реализации функций Т-хел- перов. Интерферон у, продуцируемыйклеткамиврожденногоиммунитета, определяет направление развития адаптивного иммунного ответа, в ходе которого он также секретируется Thl-клетками и активирует основные эффекторы воспалительной формы клеточного ответа — макрофаги
барьерных тканях) дендритные клетки поглощают патоген или его фрагмент и транспортируют его в региональный лимфатический узел или иные вторичные лимфоидные органы. Дифференцировавшиеся специфические ХЫ-клетки поступают в рециркуляцию. Подобно цитотоксическим Т-лимфоцитам, они утрачивают мембранные молекулы, направляющие их миграцию в лимфоидные органы (CD62L, CCR7) и приобретают обычные свойства эффекторных клеток, включая усиленную экспрессию мембранных интегринов (LFA-1, VLA-4) и рецепторов для хемокинов, секретируе- мых в очагах воспаления и барьерных тканях (для Thl-клеток — CXCR3, CCR5, CCR2 и др.).
Оказавшись в очагах инфицирования, Thl-клетки в кооперации с макрофагами осуществляют реакции, описанные выше. В результате взаимодействия этих клеток, особенно действия IFNy, происходит максимально выраженная активация макрофагов. Эта активация результативна с точки зрения защиты от внутриклеточных патогенов, но деструктивна для окружающих тканей. Активированные макрофаги выделяют весь спектр своих секреторных продуктов. Он включает разнообразные провоспалительные факторы и факторы бактерицидности. К последним относят активные формы кислорода, их галоидные производные, оксид азота и его дериваты, ферменты и т.д. Среда в окружении таких клеток закисляется. Поскольку контакт макрофагов с Thl-клетками к этому моменту прекращается, секреция уже не носит ориентированного характера. Выделяемые молекулы выступают как факторы внеклеточной
микробицидности и одновременно вызывают повреждение окружающих нормальных клеток организма. Таким образом, продукты Th1-клеток дополнительно усиливают воспалительную реакцию, в то же время придавая ей специфичность в отношении конкретных возбудителей.
Вариант воспаления, реализуемый с участием Th1-клеток, называют иммунным воспалением, а сам Th1-клеточный иммунный ответ носит название воспалительного клеточного иммунного ответа. В рамках этой формы иммунного ответа особенно ярко проявляется соотношение факторов врожденного и адапативного иммунитета: эффекторным механизмом служит типичная реакция врожденного иммунитета — фагоцитоз, однако он усиливается и приобретает специфичность в отношении конкретных антигенов благодаря вовлечению в реакцию клеток адаптивного иммунитета.
Гранулема

При неэффективном клеточном ответе воспалительного типа, т.е. в случаях, когда разрушения и переваривания внутриклеточных патогенов не происходит, формируется гранулема (рис. 3.112). Гранулема представляет собой морфологическую структуру округлой формы, в центре которой расположены инфицированные макрофаги, а также клеточный детрит и патогены, освободившиеся в результате разрушения макрофагов. Вследствие слияния макрофагов образуются гигантские многоядерные клетки. Некоторые макрофаги претерпевают морфологические изменения, приобретая фенотип так называемых эпителиоидных клеток. Периферическая часть гранулемы образована активированными макрофагами, лишенными патогенов, и Т-лимфоцитами (преимущественно TM-клетками). Т-клетки постоянно
перемещаются, причем эта подвижность важна для сохранения структурной целостности гранулемы. Формирование гранулемы сопряжено с деструкцией ткани и нарушением функционирования большого участка пораженных органов (например, легких при туберкулезе), что делает ее патологическим образованием. С другой стороны, гранулема представляет способ изоляции патогена, с уничтожением которого иммунная система не справляется, и в этом смысле выступает как защитное приспособление организма.
Эффекторные реакции, опосредованные ТН2-клетками
^2-клетки участвуют в эффекторных реакциях, направленных на защиту от многоклеточных паразитов. Эти реакции изучены пока крайне мало. При этом, подобно TM-клеткам, ^2-лимфоциты вовлекают в защитную реакцию клетки миелоидного ряда. В отличие от реакций, опосредованных TW-клетками, эти клетки представлены не макрофагами, а эозинофилами и тучными клетками.
Роль ^2-клеток в этих процессах в значительной степени состоит в секреции цитокинов: IL-4, IL-5, IL-13, IL-9, IL-3 и GM-CSF. Каждый из них в той или иной степени участвует во взаимодействии с исполнительными клетками. Основную роль при этом играет IL-5. Этот цитокин служит фактором выживания эозинофилов, поддерживает их развитие и привлекает эти клетки в очаг поражения. Эозинофилы инфильтрируют ткань вокруг паразита и выделяют продукты своих гранул, из которых главный белок эозинофилов (MBP), пероксидаза эозинофилов (EPO) и катионный белок эозинофилов (ECP) обладают цитопатогенной активностью в отношении клеток гельминтов и других макропаразитов.
Вспомогательную роль в подобных реакциях играют антитела класса IgE. Полагают, что этот минорный класс иммуноглобулинов, известный как ключевой фактор аллергии немедленного типа, предназначен для осуществления антипаразитарной защиты. Помимо прямого блокирующего действия на паразитов, IgE способен «армировать» макрофаги, связываясь с высокоаффинными FceRI-рецепторами на их поверхности, что придает прицельность действию макрофагов и служит дополнительным фактором их активации.
Источник
Оглавление темы «Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.»: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
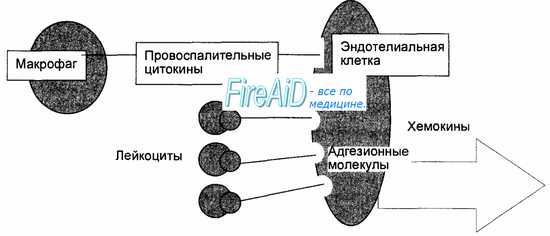
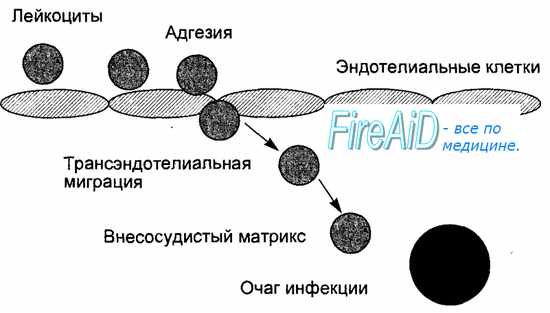
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») — Также рекомендуем «Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.» |
Источник
Ïîñðåäñòâîì ýòîé ñòàòüè ìû ñòðåìèìñÿ îáðàòèòü âíèìàíèå ÷èòàòåëÿ, îáùåñòâåííîñòè è ÑÌÈ íà íåîáõîäèìîñòü âîçðîæäåíèÿ ìåäèöèíû, íàóêè è âîññòàíîâëåíèÿ çäîðîâûõ îòíîøåíèé ìåæäó ïàöèåíòîì è âðà÷îì íà ïðèìåðå îòå÷åñòâåííûõ âåëèêèõ âðà÷åé, èõ ó÷èòåëåé è ó÷åíèêîâ. Èòàê, ïðèñòóïèì.
Ñåðãåé Ïåòðîâè÷ Áîòêèí
Îñíîâîïîëîæíèê íàó÷íîãî ïîäõîäà ê èçó÷åíèþ èíôåêöèîííûõ áîëåçíåé. Ãåíèàëüíûé êëèíèöèñò! Íèêàêîé âûìûøëåííûé äîêòîð Õàóñ íå ñðàâíèëñÿ áû ñ Áîòêèíûì. Ê òîìó æå, Ñåðãåé Ïåòðîâè÷ æèë â î÷åíü íåïðîñòîå âðåìÿ, ê ïðèìåðó, îðäèíàòóðó áóäóùèé âðà÷ ïðîõîäèë ïîä ðóêîâîäñòâîì Íèêîëàÿ Èâàíîâè÷à Ïèðîãîâà âî âðåìÿ Êðûìñêîé âîéíû â Ñèìôåðîïîëüñêîì âîåííîì ãîñïèòàëå.
Çà âñþ æèçíü äîêòîðà îôèöèàëüíî èçâåñòíî, ÷òî îí ïîñòàâèë ëèøü îäèí íåïðàâèëüíûé äèàãíîç. Íî îá ýòîé èñòîðèè ìû ðàññêàæåì ÷óòü ïîçæå.
Ñåðãåé Ïåòðîâè÷ î÷åíü âíèìàòåëüíî è âäóì÷èâî ïîäõîäèë ê ïàöèåíòó, åãî îáðàçó æèçíè, åãî îêðóæåíèþ, ðèòìó â òå÷åíèå äíÿ, ðàñïèñàíèþ.
Ïîêàçàòåëüíûé ïðèìåð èç ïðàêòèêè
Íàïðèìåð, îäíîìó ïàöèåíòó, ó êîòîðîãî, íåñìîòðÿ íà âñå ïðîöåäóðû, íèêàê íå ïðîõîäèëà ïðîñòóäà, Áîòêèí âåëåë ñìåíèòü ìàðøðóò äâèæåíèÿ íà ðàáîòó. Òîò åæåäíåâíî õîäèë â Êðåìëü ÷åðåç Ñïàññêóþ áàøíþ, à äîêòîð âåëåë íà÷àòü õîäèòü ÷åðåç Òðîèöêóþ. È áîëåçíü îòñòóïèëà. Ôàíòàñòèêà? Âîâñå íåò. Äåëî â òîì, ÷òî ó èêîíû Ñïàñà Íåðóêîòâîðíîãî, âèñÿùåé íàä Ñïàññêèìè âîðîòàìè, ñëåäîâàëî â ëþáîé ìîðîç ñíèìàòü øàïêó, ÷òî è ïîñëóæèëî ïðè÷èíîé âîçíèêíîâåíèÿ è ïîääåðæàíèÿ íåäóãà.
Êàê äî ýòîãî äîäóìàëñÿ Ñåðãåé Ïåòðîâè÷? Îòâåò î÷åâèäåí: îí î÷åíü ëþáèë ëþäåé è áûë âíèìàòåëåí ê íèì.
Äåòñòâî. Ó÷åáà. Ïåðâûé îïûò
Ñåðãåé Ïåòðîâè÷ Áîòêèí ðîäèëñÿ â áîãàòîé êóïå÷åñêîé ñåìüå â Ìîñêâå 17 ñåíòÿáðÿ 1832 ãîäà .
Äî 9 ëåò â ñåìüå Ñåðåæà ñ÷èòàëñÿ, ìÿãêî ãîâîðÿ, ãëóïûì, ïîñêîëüêó îí íå óìåë ÷èòàòü è ñ òðóäîì ñêëàäûâàë áóêâû. Ïîçæå âûÿñíèëîñü, ÷òî ó ðåáåíêà ñèëüíåéøèé àñòèãìàòèçì, è èìåííî ïëîõîå çðåíèå íå äàâàëî åìó óñïåøíî ó÷èòüñÿ.
Èíòåðåñíî, ÷òî íàó÷íûå çàäàòêè ðàñïîçíàëè è ïîìîãëè ðàçâèòü ðîäíûå áðàòüÿ, êîòîðûå çàìåòèëè, ÷òî ìàëåíüêèé Áîòêèí íå ÷èòàåò, à ïåðåñ÷èòûâàåò íà ïàëüöàõ àëôàâèò. Çàòåì â ñåìüþ ïðèãëàñèëè ÷àñòíîãî ó÷èòåëÿ ìàòåìàòèêè, êîòîðûé òàêæå ïîäìåòèë âûñîêèé ïîòåíöèàë ðåáåíêà, è ñîâñåì ñêîðî Ñåðåæà ñòàë ëó÷øèì ó÷åíèêîì.
Ó÷àñü íà ìåäèöèíñêîì ôàêóëüòåòå Ìîñêîâñêîãî óíèâåðñèòåòà, áóäóùèé âðà÷ ïîíÿë, ÷òî ìåäèöèíà äàëåêî íå ñîâåðøåííà, äàííûå èç ñïðàâî÷íèêîâ íå ÿâëÿþòñÿ àêñèîìîé, à ê êàæäîìó ÷åëîâåêó íåîáõîäèì èíäèâèäóàëüíûé ïîäõîä.
Íàãëÿäíûå ïðîñòûå èñòîðèè
Ó äâóõ áðàòüåâ ïîñëå êóïàíèÿ â õîëîäíîé âîäå íà÷èíàåòñÿ êàøåëü, îáîèì ïðîïèñûâàþò ëàêðè÷íûå ëåïåøêè. Ó îäíîãî êàøåëü ïðîõîäèò ÷åðåç òðè äíÿ, à ó äðóãîãî ñòàíîâèòñÿ ãëóõèì, óòðîáíûì è äåðæèòñÿ íåñêîëüêî ìåñÿöåâ.
Äëÿ ñïðàâêè: ëåïåøêè ÿâëÿëè ñîáîé ðàçíîâèäíîñòü êàøåê è èçâåñòíû ñî âðåìåí àðàáñêîé ìåäèöèíû. Ïðè ïðèãîòîâëåíèè ëåïåøåê ïîðîøêîîáðàçíûå èíãðåäèåíòû ðàñòèðàëè èëè ðàñòâîðÿëè, ñìåøèâàëè ñ êàìåäÿìè è ñóøèëè. Ëåïåøêè èçãîòàâëèâàëèñü èç ñûðîãî òåñòà, ñîäåðæàùåãî ëåêàðñòâåííûå âåùåñòâà ñ ïîñëåäóþùèì âûñóøèâàíèåì. Èçâåñòíî íàçíà÷åíèå ëåïåøåê èç ëàêðèöû, ìÿòû, àíèñà, ïîëûíè, ñàíòîíèíà è ò. ä.
Èëè äâå êóï÷èõè ìó÷àþòñÿ ñ ìèãðåíüþ, ïðè ýòîì îäíîé èç íèõ ïèÿâêè ïîìîãëè, à äðóãàÿ ïÿòíàìè ïîøëà, è ìèãðåíü ïðè ýòîì óñèëèëàñü.
Ïðè÷èíû âîçíèêíîâåíèÿ ãåìèêðàíèè (â áûòó ìèãðåíè) äî êîíöà òàê è íå èçó÷åíû, íî èçâåñòíî, ÷òî â íåêîòîðûõ ñëó÷àÿõ ëå÷åíèå ïèÿâêàìè áûâàåò ïðîäóêòèâíûì, ïîòîìó ÷òî â ñëþíå ýòèõ æèâîòíûõ ñîäåðæèòñÿ ãèðóäèí, êîòîðûé ìîæåò ðàçæèæàòü êðîâü è ñïîñîáñòâóåò î÷èùåíèþ è óêðåïëåíèþ ñîñóäîâ. Ïðè ðàçæèæåíèè êðîâè íàïðÿæåíèå èç ìûøö óõîäèò, è â ýòîì ñëó÷àå ãîëîâíûå áîëè è ìèãðåíü ïðîõîäÿò.
È êàê ïðè òàêîì ðàçíîì òå÷åíèè áîëåçíåé ó ðàçíûõ ëþäåé áåçîãîâîðî÷íî äîâåðÿòü ìåäèöèíñêèì ñïðàâî÷íèêàì, â êîòîðûõ ÷åòêî ãîâîðèòñÿ, ÷òî äîëæíî ïîìî÷ü? Íåò, âèäèìî òóò äåëî ñëîæíåå, ïîñêîëüêó íåò äâóõ îäèíàêîâûõ îðãàíèçìîâ.
Îäíàæäû ê Áîòêèíó (åùå â áûòíîñòü åãî ñòóäåíòîì) îáðàòèëñÿ äðóãîé ñòóäåíò ïî èìåíè Èâàí Òóìàíîâ. Îí æàëîâàëñÿ íà íåïðåðûâíûå áîëè â æèâîòå, íà òî, ÷òî âûïèñàííûé ëå÷àùèì âðà÷îì õèíèí íå ïîìîãàåò, à îò ïóçûðÿ ñî ëüäîì, êîòîðûé îí ïðèêëàäûâàåò ê áðþõó, äåëàåòñÿ òîëüêî õóæå. Ðàçãîâîð ïðîõîäèë â êîìíàòå Òóìàíîâà, òàì æå íàõîäèëèñü è äàãåðîòèïû, èçîáðàæàâøèå åãî íà çèìíåé îõîòå.
Âû âñåãäà õîäèòå â íåçàñòåãíóòîé øèíåëè? âäðóã ñïðîñèë ìîëîäîé Áîòêèí ïàöèåíòà.
Äà, â ëþáîé ìîðîç, îòâåòèë òîò.
Ñîâåòóþ Âàì âñå-òàêè çàñòåãèâàòüñÿ. Ïðîäîëæàòü õèíèí, à ëåä äîëîé. Âåðîÿòíåå âñåãî, Âàøå çàáîëåâàíèå ïðîñòóäíîãî õàðàêòåðà.
Ñåðãåé Ïåòðîâè÷ Áîòêèí òîãäà íå çíàë åùå î òàêîì çàáîëåâàíèè êàê æåëóäî÷íûé ãðèïï (ýòî çàáîëåâàíèå, ñîåäèíÿþùåå â ñåáå ñèìïòîìû ïðîñòóäíîãî çàáîëåâàíèÿ è ïèùåâàðèòåëüíîãî ðàññòðîéñòâà). Íî îí èíòóèòèâíî ïîíÿë, ÷òî õîëîä, êîòîðûé ïðèçâàí áûë ïîìî÷ü, â ýòîì êîíêðåòíîì ñëó÷àå âðåäèë. Ñîâåò âîçûìåë ïîëîæèòåëüíîå äåéñòâèå, Òóìàíîâ âûçäîðîâåë.
Ñåðãåé Ïåòðîâè÷ ñ÷èòàë, ÷òî âàæíî ïðàâèëüíî íàñòðîèòü ÷åëîâåêà, ÷òîáû åãî ìîçã ïîäàë êîìàíäó íà âûçäîðîâëåíèå.
Îí êàòåãîðè÷åñêè îòêàçûâàëñÿ ñëåäîâàòü ôîðìàëüíîìó óíèâåðñèòåòñêîìó êóðñó, êîòîðûé òðåáîâàë ïîä÷èíåíèÿ õîëîäíûì è áåçäóøíûì ñïðàâî÷íèêàì.
Êðûìñêàÿ âîéíà
Ïî îêîí÷àíèþ ó÷åáû Áîòêèí íàïðàâëÿåòñÿ â Êðûì íà âîéíó. Òÿãîòû ïîëåâîãî áûòà åãî íå ïóãàþò. Íåïîñðåäñòâåííûì íà÷àëüíèêîì ñòàíîâèòñÿ êóìèð ìîëîäîãî âðà÷à, çíàìåíèòûé õèðóðã Íèêîëàé Ïèðîãîâ.
Ñîâðåìåííèêè âñïîìèíàþò, êàê â âîçðàñòå 22 ëåò Ñåðãåé Ïåòðîâè÷ ïîìîãàë õèðóðãàì â âîåííî-ïîëåâûõ óñëîâèÿõ Êðûìñêîé âîéíû: «Êàê îðäèíàòîð, Ñåðãåé Ïåòðîâè÷ Áîòêèí ðàáîòàë ñïîêîéíî, åãî äâèæåíèÿ áûëè áûñòðû».
Îí íàó÷èëñÿ ïðîèçâîäèòü àìïóòàöèè. Íî âñêîðå ïîíÿë, ÷òî â ñâÿçè ñ áëèçîðóêîñòüþ è àñòèãìàòèçìîì íå ñìîæåò ñòàòü õèðóðãîì.  ïîñëåäóþùåì Áîòêèí íåîäíîêðàòíî âîçâðàùàëñÿ ê ñîáûòèÿì Êðûìñêîé âîéíû, è ìíîãèå åãî íàó÷íûå âçãëÿäû èìåþò îòïå÷àòêè âîåííûõ âïå÷àòëåíèé.
Ñòàæèðîâêà â Åâðîïå
Ïîñëå âîéíû Áîòêèí ðåøèë ïðîäîëæèòü ñâîå îáðàçîâàíèå â Åâðîïå. Îí ñòàæèðîâàëñÿ â Âþðöáóðãå è Áåðëèíå ó ïðîôåññîðà Ðóäîëüôà Âèðõîâà, ñëóøàë êóðñ ëåêöèé Êàðëà Ëþäâèãà, ïîñåùàë çíàìåíèòûå â òî âðåìÿ åâðîïåéñêèå êëèíèêè Ëþäâèãà Òðàóáå â Ãåðìàíèè, çàòåì Áàðòåçà, Òðóññî, Áóùþ è óðîëîãè÷åñêóþ êëèíèêó Êîäåìîíà â Ïàðèæå.
Íàó÷åííûé ìîñêîâñêèì îïûòîì, Ñåðãåé Ïåòðîâè÷ íå áåðåò íà âåðó âñ¸, ÷òî ïðåïîäàþò ýòè ñâåòèëà, èç-çà âûñîêîé ñìåðòíîñòè â ìåñòíûõ áîëüíèöàõ è î÷åâèäíûõ åìó îøèáêàõ ïðè ëå÷åíèè áîëüíûõ.
Áîòêèí ðàáîòàåò íå ïîêëàäàÿ ðóê. Äàæå âî âðåìÿ ñâàäåáíîãî ïóòåøåñòâèÿ â Âåíå ìîëîäîé âðà÷ ñòàðàëñÿ âñòðå÷àòüñÿ è îáùàòüñÿ ñ êîëëåãàìè äëÿ îáñóæäåíèÿ íàñóùíûõ âîïðîñîâ ìåäèöèíû. Áåäíàÿ Àíàñòàñèÿ Àëåêñàíäðîâíà åùå íå çíàëà, ÷òî âûøëà çàìóæ íå çà ìóæ÷èíó, à çà âñþ ðóññêóþ ìåäèöèíó.
Ðåçóëüòàòîì îáó÷åíèÿ ñòàëî òî, ÷òî ìîëîäîé âðà÷ ïîíÿë, ÷òî äëÿ òîãî, ÷òîáû èçáàâèòüñÿ îò ýìïèðèçìà, ÷òîáû ïðåâðàòèòü ìåäèöèíó èç èñêóññòâà â íàóêó, íåîáõîäèìî øèðîêî ïðèâëå÷ü õèìèþ, ïàòîëîãè÷åñêóþ àíàòîìèþ, ôèçèîëîãèþ è åùå òîëüêî çàðîæäàþùóþñÿ ìèêðîáèîëîãèþ. Èíòåðåñíî, ÷òî â äàëüíåéøåì óæå íà ðîäèíå, ñïóñòÿ íåñêîëüêî ëåò ìîëîäîé âðà÷ çà ñîáñòâåííûå ñðåäñòâà íà÷íåò îòêðûâàòü ñïåöèàëèçèðîâàííûå ëàáîðàòîðèè.
Ñëóæáà â Ñàíêò-Ïåòåðáóðãå
 28 ëåò Áîòêèí áûë íàçíà÷åí çàâåäóþùèì êàôåäðû ôàêóëüòåòñêîé òåðàïèè â Èìïåðàòîðñêîé ìåäèêî-õèðóðãè÷åñêîé àêàäåìèè â Ñàíêò-Ïåòåðáóðãå.
Ìîëîäîé ïðîôåññîð ýíåðãè÷íî âçÿëñÿ çà ðàáîòó. Ñâîþ çàäà÷ó îí âèäåë â ñîçäàíèè â àêàäåìèè îáðàçöîâîé êëèíèêè. Ïðè êëèíèêå áûëà ñîçäàíà ïåðâàÿ áåñïëàòíàÿ àìáóëàòîðèÿ, ÷òî â òî âðåìÿ áûëî íîâîââåäåíèåì.  àìáóëàòîðèè ïðåäïîëàãàëîñü âåñòè ïðèåì áåäíûõ ñëîåâ íàñåëåíèÿ, íî âñêîðå â íåå ñòàëè ïðèõîäèòü ëþäè âñåõ ñîñëîâèé. Âñêîðå Áîòêèíà ñòàëè íàçûâàòü «÷óäåñíûì äîêòîðîì». Ñåðãåé Ïåòðîâè÷ îáëàäàë ðåä÷àéøèì òàëàíòîì äèàãíîñòà.
Ïîñêîëüêó «÷óäåñíûé äîêòîð» íå ïðåäñòàâëÿë ñåáå êëèíèêó áåç ëàáîðàòîðèè, ñïóñòÿ âñåãî ãîä, â 1861 ãîäó, áûëà îðãàíèçîâàíà âïîëíå ñîâðåìåííàÿ êëèíèêî-ýêñïåðèìåíòàëüíàÿ ëàáîðàòîðèÿ, â êîòîðîé ïðîâîäèëèñü ïåðâûå â Ðîññèè èññëåäîâàíèÿ ïî ýêñïåðèìåíòàëüíîé ôàðìàêîëîãèè.  ëàáîðàòîðèè Ïàâëîâ ïðîâîäèë ñâîè èññëåäîâàíèÿ, íàïèñàë äîêòîðñêóþ î ñåðäå÷íûõ íåðâàõ è â äàëüíåéøåì âîçãëàâèë äåòèùå Áîòêèíà óæå êàê ëó÷øèé â íàøåé èñòîðèè ôèçèîëîã.
Çèìîé 1872 ã. Áîòêèíà ïðèãëàñèëè ñòàòü ëè÷íûì âðà÷îì èìïåðàòðèöû Ìàðèè Àëåêñàíäðîâíû, è îí áûë íàçíà÷åí ëåéá-ìåäèêîì.
Ðóññêî-òóðåöêàÿ âîéíà
Ñïóñòÿ ïÿòü ëåò, â 1877 ã., Ñåðãåé Ïåòðîâè÷ âî âòîðîé ðàç â ñâîåé æèçíè îòáûë íà òåàòð âîåííûõ äåéñòâèé â Äóíàéñêóþ àðìèþ íà Áàëêàíû, ãäå ïðîâåë â êà÷åñòâå âðà÷à îêîëî 7 ìåñÿöåâ, ýòî áûëà ðóññêî-òóðåöêàÿ âîéíà. Áîòêèí ïîåõàë äîáðîâîëüíî, ÷òîáû ïîâûñèòü íàâûêè ðàáîòû â íàïðÿæåííûõ, ýêñòðåìàëüíûõ ñèòóàöèÿõ.
Îäíàæäû íà ôðîíòå ê Áîòêèíó îáðàòèëñÿ ðóññêèé äèïëîìàò Èãíàòüåâ, îí æàëîâàëñÿ íà íåïðåêðàùàþùèåñÿ áîëè â çàòûëêå.
×åì Âû ëå÷èòåñü?
Äà âîò êðóïèíêàìè ãîìåîïàòèÿ.
Âñÿ ýòà ãîìåîïàòèÿ äëÿ ìèðíîé è ñïîêîéíîé æèçíè. Âû âîò ÷òî ñäåëàéòå, âûïåéòå ïîáîëüøå ñëàáèòåëüíîãî è ïðèìèòå òåïëóþ âàííó.
Áëèæàéøèå íåñêîëüêî ÷àñîâ íå áûëè ñàìûìè ïðèÿòíûìè â æèçíè Èãíàòüåâà, îäíàêî áîëè â çàòûëêå ïðåêðàòèëèñü. Áîòêèí âîñïðèíèìàë Èãíàòüåâà íå êàê î÷åðåäíîãî ïàöèåíòà, æàëóþùåãîñÿ íà ãîëîâíóþ áîëü, à êàê æèâîãî ÷åëîâåêà, âûíóæäåííîãî âåñòè íåïðèâû÷íûé äëÿ ñåáÿ, íåêîìôîðòíûé îáðàç æèçíè.
Íàó÷íîå íàñëåäèå Áîòêèíà
Ñâîè íàó÷íûå âçãëÿäû Áîòêèí èçëîæèë â òðåõ òîìàõ «Êóðñà êëèíèêè âíóòðåííèõ áîëåçíåé» è 35 ëåêöèÿõ, çàïèñàííûõ åãî ó÷åíèêàìè.
+ Ïåðâûé òîì áûë âûïóùåí â 1867 ã. è ïîñâÿùåí ðàçáîðó áîëüíîãî ñ áîëåçíüþ ñåðäöà.
+ Âòîðîé òîì óâèäåë ñâåò â 1868 ã. è ñîäåðæàë ðàçáîð áîëüíîãî ñûïíûì òèôîì è ïîäðîáíîå èçëîæåíèå ó÷åíèÿ î ëèõîðàäêå.
+ Òðåòèé âûïóñê ïîÿâèëñÿ â 1875 ã. è íàçûâàëñÿ «Î ñîêðàòèòåëüíîñòè ñåëåçåíêè è îá îòíîøåíèè çàðàçíûõ áîëåçíåé ê ñåëåçåíêå, ïå÷åíè, ïî÷êàì, ñåðäöó». Íà ïðîòÿæåíèè äîëãîãî âðåìåíè ýòà êíèãà áûëà íàñòîëüíîé ó ìíîãèõ ïîêîëåíèé âðà÷åé, ïåðåâåäåíà íà ôðàíöóçñêèé è íåìåöêèé ÿçûêè.
Âäîâñòâî è íîâàÿ æåíèòüáà
 ãîä íàïèñàíèÿ òðåòüåãî âûïóñêà êóðñà âíóòðåííèõ áîëåçíåé óìèðàåò æåíà, áîëåçíü îêàçàëàñü íåèçëå÷èìîé. Ñóïðóãà îñòàâèëà ïîñëå ñåáÿ øåñòåðûõ äåòåé è ÷óâñòâî íåâîñïîëíèìîé ïîòåðè. Áîòêèí íà÷àë æèòü õîëîñòÿêîì. Íåêîãäà øóìíûé äîì ñäåëàëñÿ íåóþòåí, äåòè õîäèëè, êàê â âîäó îïóùåííûå. Ãóâåðíàíòêè è íÿíüêè äåëàëè âñå, ÷òî ìîãëè, íî íå îò íèõ çàâèñåëî âåðíóòü â äîì Áîòêèíà áûëîå ñ÷àñòüå. Òàê ïðîøåë ãîä. Ñåðãåé Ïåòðîâè÷ íå âûäåðæàë è ïðåäëîæèë ðóêó è ñåðäöå Åêàòåðèíå Àëåêñååâíå Ìîðäâèíîâîé (Îáîëåíñêîé), òîæå âäîâå. Ìåæäó íèìè íå áûëî ïûëêîé ëþáâè, ê ñîþçó èõ òîëêíóëî ÷óâñòâî îäèíî÷åñòâà.
Áîðüáà ñ èíôåêöèîííûìè áîëåçíÿìè
Âàæíûìè ñ ïðàêòè÷åñêîé òî÷êè çðåíèÿ áûëè íàáëþäåíèÿ è âûâîäû Áîòêèíà, êàñàþùèåñÿ áîðüáû ñ èíôåêöèîííûìè çàáîëåâàíèÿìè (ïíåâìîíèÿ, ìàëÿðèÿ, äèçåíòåðèÿ, ñûïíîé è áðþøíîé òèô, èíôåêöèîííàÿ æåëòóõà) è ëå÷åíèÿ èíôåêöèîííûõ áîëüíûõ, à òàêæå âîïðîñîâ ïðîòèâîýïèäåìè÷åñêèõ ìåðîïðèÿòèé.
Ñåðãåé Ïåòðîâè÷ íåóñòàííî èñêàë ïóòè ñíèæåíèÿ èíôåêöèîííîé çàáîëåâàåìîñòè. Ïî åãî èíèöèàòèâå è ïðè åãî íåïîñðåäñòâåííîì ó÷àñòèè áûëà îòêðûòà Àëåêñàíäðîâñêàÿ ãîðîäñêàÿ áàðà÷íàÿ áîëüíèöà, â ïåðâóþ î÷åðåäü äëÿ «÷åðíîðàáî÷åãî êëàññà».
Íîâàòîð â ìåäèöèíå
1. Áëàãîäàðÿ Áîòêèíó ïîÿâèëñÿ ïðîîáðàç «ñêîðîé ïîìîùè» ñàíèòàðíàÿ êàðåòà.
2. Îí ÷åòêî ñëåäîâàë íàñòîÿùèì ÷åëîâå÷åñêèì ïðèíöèïàì: ïî åãî èíèöèàòèâå â ñòîëèöå, à çàòåì è â äðóãèõ ãîðîäàõ áûëè îòêðûòû ìåäèöèíñêèå êîìïëåêñû äëÿ áåäíåéøåãî íàñåëåíèÿ. Îíè ñîñòîÿëè èç àìáóëàòîðèè è áîëüíèöû, è ëå÷åíèå â íèõ áûëî áåñïëàòíûì. Äëÿ Áîòêèíà íå áûëî ïàöèåíòîâ âàæíûõ è íåâàæíûõ. Îí âíèêàë â êàæäîãî ïàöèåíòà, â óñëîâèÿ æèçíè ëþäåé. Ñîâåòû âðà÷à èíîãäà îáåñêóðàæèâàëè ïàöèåíòîâ, íî ïðè ýòîì âñå çíàëè, ÷òî ýòîò äîêòîð äàðîì ñëîâ íà âåòåð íå áðîñàåò.
3. Áîòêèí íåîäíîêðàòíî îáðàùàë âíèìàíèå ïðàâèòåëüñòâà íà íåóäîâëåòâîðèòåëüíîå ñàíèòàðíîå ñîñòîÿíèå æèëèù áåäíûõ ñëîåâ îáùåñòâà, óëó÷øåíèå óñëîâèé èõ æèçíè è ðàáîòû.
4. Ïî èíèöèàòèâå ïðîôåññîðà, êàê óïîìèíàëîñü ðàíåå, è íà ñîáñòâåííûå ñðåäñòâà â áîëüíèöå áûëà ñîçäàíà õèìèêî-ôèçèîëîãè÷åñêàÿ ëàáîðàòîðèÿ.  íåé áûëè âûïîëíåíû íåêîòîðûå èññëåäîâàíèÿ ïî çàðîæäàþùåéñÿ òîãäà ìèêðîáèîëîãèè.
5. Áëàãîäàðÿ Áîòêèíó áûëà ââåäåíà êàðòî÷íàÿ ñèñòåìà ðåãèñòðàöèè áîëüíûõ. Äëÿ ó÷åòà êàæäîãî ïîñòóïàþùåãî â áîëüíèöó çàâîäèëè «Ñêîðáíûé ëèñò» (ïðîîáðàç èñòîðèè áîëåçíè). Òàêîé ïîäõîä îáëåã÷àë ðàáîòó êîëëåãàì, â òîì ñëó÷àå åñëè ïàöèåíòà âåë íå îäèí âðà÷. Ðàáîòàÿ íà êàôåäðå, Ñåðãåé Ïåòðîâè÷ ïåðâûì ñòàë ïðèãëàøàòü ïàöèåíòîâ äëÿ äèàãíîñòèêè è ïîëíîãî ðàçáîðà òàêòèêè ëå÷åíèÿ ðåàëüíîãî ÷åëîâåêà. Ýòî âûçâàëî ñèëüíûå âîçìóùåíèÿ ó ïðåäñòàâèòåëåé ñòàðîé øêîëû, íî Áîòêèí áûë íåïðåêëîíåí.
6. Èì ëè÷íî áûë ðàçðàáîòàí ïëàí îêàçàíèÿ ïîìîùè íà äîìó è óñòàíîâëåíà ïîâèçèòíàÿ ïëàòà â 30 êîïååê, à â íî÷íîå âðåìÿ â 60 êîïååê.  òî âðåìÿ ýòî áûëà êðàéíå íèçêàÿ, ñèìâîëè÷åñêàÿ îïëàòà, çà ÷òî Áîòêèíà îò÷àÿííî êðèòèêîâàëà Êîìèññèÿ îáùåñòâåííîãî çäðàâèÿ. Äîêòîð áûë ïðåêðàñíûì îðãàíèçàòîðîì, êîîðäèíàòîðîì ÷åëîâå÷åñêèõ è ìàòåðèàëüíûõ ðåñóðñîâ. Áîðüáà ñ ýïèäåìèåé 1882 ãîäà â Ñàíêò-Ïåòåðáóðãå çàêîí÷èëàñü óñïåøíî áëàãîäàðÿ ðàöèîíàëüíîìó ðàñïðåäåëåíèþ âðà÷åáíûõ ñèë è ñðåäñòâ ïîä ðóêîâîäñòâîì Áîòêèíà, è, ïî ïðèçíàíèþ Ãîðîäñêîé Äóìû, «ïîòðåáîâàëà ñî ñòîðîíû ãîðîäà íåáîëüøîé äåíåæíîé çàòðàòû». Òàê áûëî ïîëîæåíî íà÷àëî êâàðòèðíîé ïîìîùè íàñåëåíèþ ñòîëèöû.
Òðè îñíîâíûõ ïðàâèëà òåðàïåâòà îò Ñ.Ï. Áîòêèíà:
1. Âî-ïåðâûõ, íóæíî íàñòðîèòü áîëüíîãî íà âûçäîðîâëåíèå, ïðèòîì íàñòðàèâàòü êàæäîãî ïî ðàçíîìó. Îäíîãî æàëåòü, âòîðîãî îáíàäåæèòü, äðóãîãî ïîäáàäðèâàòü, ñëåäóþùåãî ïóãàòü, ñ êåì-òî ïîøóòèòü. Ôîðìà, â êîòîðîé áóäåò âûñêàçàí ñîâåò, íå ìåíåå âàæíà, ÷åì ñîáñòâåííî ñîäåðæàíèå ýòîãî ñîâåòà.
2. Âî-âòîðûõ, ëå÷èòü íóæíî ÷åëîâåêà öåëèêîì.
3. Â-òðåòüèõ, ãëàâíóþ îòâåòñòâåííîñòü çà ïîÿâëåíèå è ðàçâèòèå áîëåçíåé íåñåò âíåøíÿÿ ñðåäà, îò êà÷åñòâà îòäûõà äî âçàèìîîòíîøåíèÿ ñ ðîäñòâåííèêàìè.
Ñî âðåìåíåì ýòè ïóíêòû ñòàëè ÷åì-òî âðîäå áèáëåéñêèõ çàïîâåäåé äëÿ ïðàêòèêóþùèõ òåðàïåâòîâ. Íåóäèâèòåëüíî, ÷òî Áîòêèí ñòàë ëó÷øèì äèàãíîñòîì ñâîåãî âðåìåíè, õîòÿ êîëëåãè ÷àñòî èðîíèçèðîâàëè íàä äèàãíîçàìè, íàñòîëüêî îíè øëè âðàçðåç ñ óñòîÿâøèìèñÿ ïðàêòèêàìè.
Öèðþëüíèê Êîíñòàíòèí Âàñèëüåâ. Ñëàáîñòü, ñîíëèâîñòü, ïîíèæåííûé èíòåðåñ ê æèçíè. Íåäàâíî ïåðååõàë â äîì íàïðîòèâ êðóãëîñóòî÷íîé òèïîãðàôèè. Ðåöåïò: çàòû÷êè â óøè íà íî÷ü.
Íî áîëüíûå íåîæèäàííî èçëå÷èâàëèñü, à åñëè íåò, òî âñêðûòèå ïîêàçûâàëî ïðàâîòó Ñåðãåÿ Ïåòðîâè÷à, è øóòíèêè äîâîëüíî áûñòðî óñïîêàèâàëèñü. Çàòî ñàì Áîòêèí íå óñòàâàë øóòèòü ñ ïàöèåíòàìè.
Âîò, íàïðèìåð, âîñïîìèíàíèÿ îäíîé èç ïàöèåíòîê, ñåðüåçíî çàáîëåâøåé æåíû ôèçèîëîãà Èâàíà Ïàâëîâà:
Ñêàæèòå, Âû ëþáèòå ìîëîêî?
Ñîâñåì íå ëþáëþ è íå ïüþ.
À âñå æå ìû áóäåì ïèòü ìîëîêî. Âû þæàíêà, íàâåðíîå, ïðèâûêëè ïèòü âèíî çà îáåäîì.
Íèêîãäà. Íè êàïëè.
Îäíàêî ìû áóäåì ïèòü. Èãðàåòå ëè Âû â êàðòû?
×òî Âû, Ñåðãåé Ïåòðîâè÷, íèêîãäà â æèçíè.
×òî æå, áóäåì èãðàòü. ×èòàëè ëè Âû Äþìà èëè åùå òàêóþ ïðåêðàñíóþ âåùü, êàê «Ðîêàìáîëü»?
Äà ÷òî Âû îáî ìíå äóìàåòå, Ñåðãåé Ïåòðîâè÷? Âåäü ÿ íåäàâíî êîí÷èëà êóðñû, è ìû íå ïðèâûêëè èíòåðåñîâàòüñÿ òàêèìè ïóñòÿêàìè.
Áóäåì ÷èòàòü «Ðîêàìáîëü».
Ñïóñòÿ òðè ìåñÿöà Ñåðàôèìà Àëåêñàíäðîâíà âûçäîðîâåëà.
Çäîðîâüå «÷óäåñíîãî äîêòîðà»
Ê ñîðîêà ãîäàì çäîðîâüå âðà÷à óæå ïîäîðâàíî, íî îí íå îáðàùàåò íà ýòî âíèìàíèå, à äóìàåò î òîì, êàê ïåðåäàòü ñâîè çíàíèÿ è ïîäõîä ê äèàãíîñòèêå è ëå÷åíèþ.
 1883 ã. â Ñàíêò-Ïåòåðáóðãå ñëó÷èëîñü òî, ÷òî äîëæíî áûëî ñëó÷èòüñÿ. Ñåðãåé Ïåòðîâè÷, òîëüêî ÷òî áîäðî ãîâîðèâøèé ñî ñâîèìè êîëëåãàìè, âäðóã ñïàë ñ ëèöà, ïîêà÷íóëñÿ è ðóõíóë áåç ÷óâñòâ. Ýòî ìîæíî áûëî áû ñïèñàòü íà íåðâíîå è ôèçè÷åñêîå ïåðåíàïðÿæåíèå, åñëè áû íå îäûøêà è ñëàáîñòü, êîòîðûå Ñåðãåé Ïåòðîâè÷ îùóùàë ïîñëåäíèå íåñêîëüêî ìåñÿöåâ.
Áîòêèí ðåøèë, ÷òî ýòî ñëåäñòâèå êîâàðíîé æåë÷åêàìåííîé áîëåçíè. Îí âûçâàë âèäíîãî àíãëèéñêîãî õèðóðãà, êîòîðûé áûë èçâåñòåí îïåðàöèÿìè íà æåë÷íîì ïóçûðå, òîò îñìîòðåë ïàöèåíòà, íî îïåðàöèþ äåëàòü íàîòðåç îòêàçàëñÿ. Õèðóðã ïîñòàâèë äðóãîé äèàãíîç, ãîðàçäî áîëåå ñåðüåçíûé «ãðóäíàÿ æàáà» ñòðàøíàÿ ñåðäå÷íàÿ áîëåçíü, ñ ýòîé áîëåçíüþ ïàöèåíò ìîæåò íå âûäåðæàòü âìåøàòåëüñòâà õèðóðãà.
«Ãðóäíàÿ æàáà» ýòî ïðèãîâîð, è Áîòêèí ïðèíÿë íåîáû÷íîå ðåøåíèå: äèàãíîç õèðóðãà ñ÷èòàòü îøèáî÷íûì, âñå ðàçãîâîðû î «æàáå» ïðåñå÷ü è âåñòè âñå òàêîé æå íàïðÿæåííûé îáðàç æèçíè. Ïóñòü îí ïðîæèâåò ìåíüøå, íî ñäåëàåò áîëüøå è äëÿ ñâîèõ ïàöèåíòîâ, è äëÿ Ðîññèéñêîé ìåäèöèíû âîîáùå.
Ìåæäó òåì áîëåçíü âñå ïðîãðåññèðîâàëà, Áîòêèí ïîñòîÿííî çàäûõàëñÿ, ñèëüíî ïîõóäåë, ó íåãî èçìåíèëñÿ öâåò ëèöà. Âñåì êîëëåãàì áûëî ÿñíî, ÷òî åñëè Ñåðãåé Ïåòðîâè÷ íå óêðîòèò ñâîé ïûë, òî ñ÷åò åãî æèçíè áóäåò èäòè íå íà ãîäû, à íà ìåñÿöû. Îíè îñòîðîæíî íàìåêàëè Áîòêèíó íà ýòî è êàæäûé ðàç âûñëóøèâàëè îäèí-åäèíñòâåííûé îòâåò: «Çàìîë÷èòå! Çíàþ, ÷òî âû ñêàæåòå. Íî òîëüêî æåë÷åêàìåííàÿ áîëåçíü ìîÿ åäèíñòâåííàÿ çàöåïêà, åñëè ïðåäïîëîæèòü ñàìîñòîÿòåëüíóþ áîëåçíü ñåðäöà, òî ÿ ïðîïàë. À åñëè ýòè ñèìïòîìû ÿâëÿþòñÿ ôóíêöèîíàëüíûì îòðàæåíèåì îò æåë÷íîãî ïóçûðÿ, òî ÿ åùå ìîãó âûêàðàáêàòüñÿ. Íè ñëîâà, ïîâòîðÿþ, íè ñëîâà ïðî «ãðóäíóþ æàáó», ó ìåíÿ áîëüíîé ïóçûðü è âñå!».
 ïîñëåäíèé ãîä ñâîåé æèçíè îí ðàçðàáàòûâàë ïðîáëåìó ñòàðîñòè, õîòÿ ñàìîìó åìó íå óäàëîñü äî íåå äîæèòü. Ñåðãåé Ïåòðîâè÷ ñêîí÷àëñÿ âî Ôðàíöèè, êîãäà åìó áûëî âñåãî 57 ëåò. Ðàáîòà áåç îòäûõà ïîäîðâàëà åãî ñèëû. Ó Ñåðãåÿ Ïåòðîâè÷à áîëåçíü ñåðäöà íà÷àëà ðàçâèâàòüñÿ äàâíî, è èìåííî òîãäà Áîòêèí ïîñòàâèë åäèíñòâåííûé íåâåðíûé äèàãíîç ñàìîìó ñåáå. Îîí óïîðíî ñ÷èòàë, ÷òî ñòðàäàåò îò ïå÷åíî÷íîé êîëèêè (íàèáîëåå ðàñïðîñòðàíåííîå êëèíè÷åñêîå ïðîÿâëåíèå æåë÷åêàìåííîé áîëåçíè).  1889 ãîäó, êàê ïèñàëè ãàçåòû, «ñìåðòü óíåñëà èç ýòîãî ìèðà ñàìîãî íåïðèìèðèìîãî ñâîåãî âðàãà»
Âåëèêèé êëèíèöèñò âîñïèòàë íå òîëüê