Клеточный инфильтрат при остром и хроническом воспалении
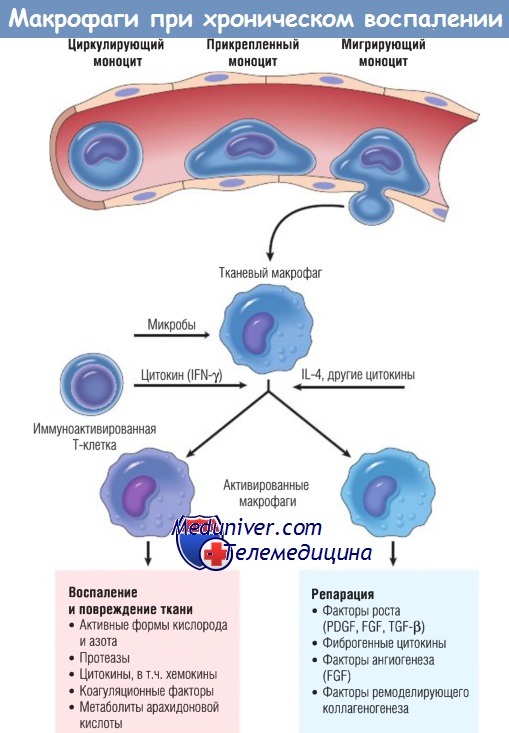
Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
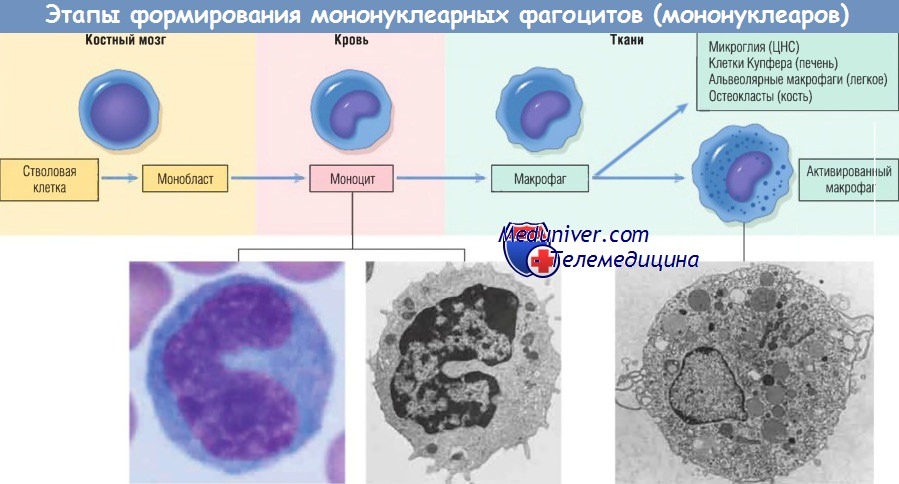
Макрофаг — главная клетка, участвующая в процессе хронического воспаления. Макрофаги являются частью системы мононуклеарных фагоцитов (иногда называемой ретикулоэндотелиальной системой), состоящей из клеток, близкородственных клеткам костного мозга, включая моноциты и тканевые макрофаги.
Тканевые макрофаги диффузно разбросаны по соединительной ткани или расположены в таких органах, как печень (клетки Купфера), селезенка и лимфатические узлы (гистиоциты синусов), легкие (альвеолярные макрофаги), а также в ЦНС (микроглия). Мононуклеарные фагоциты происходят из клеток-предшественников костного мозга, которые дифференцируются в моноциты. Из крови моноциты мигрируют в разные ткани и дифференцируются в макрофаги.
Период полужизни моноцитов длится около 1 дня, когда как период жизни тканевых макрофагов составляет несколько месяцев или лет. Превращение стволовой клетки костного мозга в тканевый макрофаг регулируется различными факторами роста и дифференцировки, цитокинами, молекулами адгезии и клеточными взаимодействиями.
Моноциты начинают мигрировать во внесосудистые ткани на ранних стадиях развития острого воспаления и в течение 48 час могут стать доминирующим типом клеток инфильтрата. Экстравазация моноцитов управляется теми же стимулами, которые участвуют в миграции нейтрофилов и представлены молекулами адгезии и химическими медиаторами с хемотаксическими и активирующими свойствами.
При попадании моноцита во внесосудистую ткань он подвергается трансформации в большую фагоцитарную клетку — макрофаг. Макрофаги активируются различными стимулами, включая микробные продукты, активирующие TLR и другие клеточные рецепторы, цитокины (например, IFN-y), секретированные сенсибилизированными Т-лимфоцитами и естественными клетками-киллерами, и другие химические медиаторы.
В результате активации макрофагов происходят элиминация таких повреждающих агентов, как микробы, и инициация процессов репарации, а также повреждение ткани (при хроническом воспалении).
Активация макрофагов приводит также к повышению уровней лизосомных ферментов и активных форм кислорода и азота, продукции цитокинов, факторов роста и других медиаторов воспаления. Некоторые из этих продуктов токсичны для микробов и организма (например, активные формы кислорода и азота) или ВКМ (протеазы); другие вызывают миграцию клеток (например, цитокины, хемотаксический стимул); третьи влияют на пролиферацию фибробластов, отложение коллагена и ангиогенез (например, факторы роста).
Разные популяции макрофагов выполняют различные функции: некоторые необходимы при киллинге микробов и воспалении, другие очень важны при репарации.
Впечатляющий арсенал медиаторов делает макрофаги мощным союзником организма в защите от непрошеных гостей, но в то же время при неправильной активации макрофаги могут вызывать значительное разрушение ткани, которое является одним из признаков хронического воспаления. Процесс разрушения ткани сам по себе может активировать каскад воспалительной реакции, поэтому одновременно могут присутствовать признаки и острого, и хронического воспаления.
При недолгом процессе воспаления, если стимул удален, макрофаги в итоге либо умирают, либо уходят в лимфатические сосуды и лимфоузлы. При хроническом воспалении происходит накопление макрофагов в результате их мобилизации из кровотока и местной пролиферации в очагах воспаления.

Роль активированных макрофагов при хроническом воспалении.
Макрофаги активируются неиммунными стимулами, например эндотоксином, или цитокинами из иммуноактивированных Т-клеток (особенно IFN-y).
Перечислена продукция активированных макрофагов.
FGF — фактор роста фибробластов; IFN — интерферон; IL — интерлейкин;
PDGF — тромбоцитарный фактор роста; TGF — трансформирующий фактор роста.
В развитии хронического воспаления участвуют и другие типы клеток: лимфоциты, клетки плазмы крови, эозинофилы и тучные клетки:
— лимфоциты мобилизуются в ходе как антителоопосредованных, так и клеточно-опосредованных иммунных реакций. Антиген-стимулированные лимфоциты (эффекторные клетки и клетки памяти) различных типов (Т- и В-клетки) используют разные пары адгезивных молекул (селектинов, интегринов и их лигандов) и хемокины для миграции в очаг воспаления. Цитокины активированных макрофагов, в основном TNF, IL-1 и хемокины, усиливают мобилизацию лейкоцитов, запуская стадию персистенции воспалительной реакции.
Лимфоциты и макрофаги взаимодействуют по реверсивному типу, что играет важную роль в развитии хронического воспаления. Макрофаги презентируют антигены Т-клеткам и продуцируют мембранные молекулы (костимуляторы) и цитокины (например, IL-12), которые стимулируют ответ Т-клеток. Активированные Т-клетки продуцируют цитокины, некоторые из которых мобилизуют моноциты из кровотока, и IFN-y — мощный активатор макрофагов. В результате этих взаимодействий Т-клеток и макрофагов в воспалительную реакцию вовлекается иммунная система, что делает реакцию хронической и тяжелой. Термин «иммунное воспаление» отражает наличие выраженного иммунного компонента в воспалительном процессе, например ответа Т- и В-клеток;
— клетки плазмы крови образуются из активированных В-клеток и продуцируют антитела, направленные либо против персистирующих чужеродных или собственных антигенов в очаге воспаления, либо против компонентов поврежденной ткани. При некоторых сильных воспалительных реакциях скопление лимфоцитов, антигенпрезентирующих клеток и клеток плазмы крови может напоминать морфологическое строение лимфоидного органа, особенно лимфоузла, содержащего хорошо сформированные герминативные центры.
Подобные очаги скопления лимфоцитов называют третичными лимфоидными органами. Такой тип лимфоидного органогенеза часто встречается в синовиальных оболочках у пациентов, длительно страдающих ревматоидным артритом;
— эозинофилами изобилуют иммунные реакции, опосредованные IgE и паразитарными инфекциями. Особо важный хемокин для мобилизации эозинофилов — эотаксин. Эозинофилы содержат гранулы, имеющие главный основной белок (высокоактивный катионный белок), который токсичен для паразитов, но может вызвать лизис эпителиальных клеток млекопитающих. Таким образом, эозинофилы контролируют паразитарные инфекции, но также участвуют в повреждении ткани при иммунных реакциях, например аллергии;
— тучные клетки широко распространены в соединительных тканях по всему телу и могут участвовать как в острых, так и в хронических воспалительных реакциях. Тучные клетки экспрессируют на своей поверхности рецептор FceRI, связывающийся с Fc-фракцией антитела IgE. При реакции гиперчувствительности немедленного типа антитела IgE связываются с клеточными Fc-peцепторами, специфично распознающими антиген, клетка дегранулируется и высвобождает медиаторы — гистамин и простагландины. Этот тип ответа наблюдается при пищевой аллергии, укусах насекомых, лекарственной аллергии, иногда с ужасающими исходами (например, анафилактическим шоком).
Тучные клетки тоже присутствуют при реакциях хронического воспаления и секретируют множество цитокинов, т.е. они способны как усиливать, так и ограничивать воспалительную реакцию в разных ситуациях.
Как правило, присутствие нейтрофилов характерно для острого воспаления, но и при многих формах хронического воспаления, длящегося месяцами, выявляется большое количество нейтрофилов, индуцированных либо персистирующими микробами, либо медиаторами, продуцированными активированными макрофагами и Т-лимфоцитами. При хронических бактериальных инфекциях костей (остеомиелите) нейтрофильный экссудат может сохраняться многие месяцы. Нейтрофилы также важны при хроническом воспалении в легких, индуцированном курением или другим стимулом.
Помимо мононуклеарного характера клеточного инфильтрата при хроническом воспалении часто происходит пролиферация кровеносных и лимфатических сосудов. Этот процесс стимулируют факторы роста, продуцируемые макрофагами и эндотелиальными клетками.
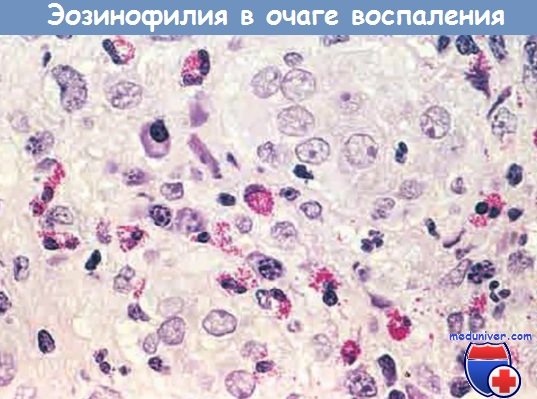
Очаг воспаления с большим количеством эозинофилов (эозинофилия)
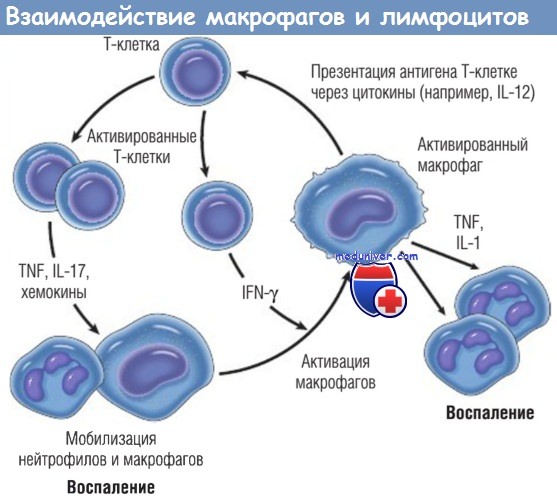
Взаимодействия макрофагов и лимфоцитов при хроническом воспалении.
Активированные Т-клетки продуцируют цитокины, которые мобилизуют макрофаги (TNF, IL-17, хемокины), и IFN-y, который является мощным активатором макрофагов.
Разные типы Т-клеток (Тh1 и Тh17) могут продуцировать различные типы цитокинов.
В свою очередь, активированные макрофаги стимулируют Т-клетки, презентируя им антигены через цитокины (например, IL-12).
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли.
— Рекомендуем ознакомиться со следующей статьей «Причины и механизмы гранулематозного воспаления. Что такое гранулема?»
Оглавление темы «Патофизиология»:
- Клетки участвующие в хроническом воспалении — макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей — репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Источник
Течение воспаления определяется реактивностью организма, видом, силой и продолжительностью действия флогогена. Различают острое, подострое и хроническое воспаление.
Острое воспаление характеризуется:
— интенсивным течением и сравнительно небольшой продолжительностью (обычно 1-2, максимально до 4-6 недель), зависящей от поврежденного органа или ткани, степени и масштаба их альтерации, реактивности организма и др.; умеренно выраженной альтерацией и деструкцией тканей, экссудацией и пролиферацией в очаге повреждения при нормергическом характере воспаления. При гиперергическом его течении в очаге воспаления доминируют альтерация и разрушение тканей.
Хроническое воспаление характеризуется:
— длительным и вялым течением. Сохраняется такое воспаление в течение многих лет и даже всей жизни пациента (например, у больных проказой, туберкулезом, токсоплазмозом, хроническими формами пневмонии, гломерулонефритом, гепатитом, ревматоидным артритом и др.);
— формированием гранулем (например, при туберкулезном, бруцеллезном или сифилитическом воспалении);
— образованием фиброзной капсулы (например, при наличии в ткани инородного тела или отложении солей кальция);
— частым развитием некроза в центре очага хронического воспаления.
Хроническое воспаление может быть первичным и вторичным.
Если течение воспаления после острого периода приобретает затяжной характер, то оно обозначается как «вторично-хроническое». В случае, когда воспаление изначально имеет персистирующее (вялое и длительное) течение, его называют «первично-хроническим».
Причины хронического воспаления:
— различные формы фагоцитарной недостаточности;
— длительный стресс и другие состояния, сопровождающиеся повышенной концентрацией в крови КА и ГК, которые подавляют процессы пролиферации, созревание и активность фагоцитов;
— повторное повреждение ткани или органа, сопровождающееся образованием чужеродных антигенов и развитием иммупатологических реакций;
— персистирующая инфекция и (или) интоксикация;
Характер течения хронического воспаления определяется:
— местными факторами (клеточным составом, медиаторами воспаления, характером, степенью и масштабом повреждения ткани и др.);
— общими, системными факторами к которым относят: гормоны (адреналин, ГК, СТГ, тиреоидные гормоны, глюкагон и др.) и опиоидные пептиды (эндорфины и энкефалины).
Виды воспаления
В зависимости от характера доминирующего местного процесса (альтерация, экссудация или пролиферация) различают три вида воспаления. В случае преобладания альтеративных процессов, дистрофии, некроза, развивается альтеративное (некротическое) воспаление. Оно наблюдается чаще всего в паренхиматозных органах, при инфекционных заболеваниях, протекающих с выраженной интоксикацией (творожистый распад легких или надпочечников при туберкулезе). Преобладают явления повреждения над эксудативно-инфильтративными и пролиферативными.
Различают также экссудативный и пролиферативный виды воспаления в соответствии с выраженностью того или иного процесса. Экссудативное воспаление характеризуется выраженным нарушением кровообращения с явлениями экссудации и эмиграции лейкоцитов. По характеру экссудата различают серозное, гнойное, геморрагическое, фибринозное, смешанное воспаление. Кроме того, при вовлечении в воспалительный процесс слизистых оболочек, когда к экссудату примешивается слизь, говорят о катаральном воспалении, которое обычно сочетается с экссудативным воспалением других видов (серозно-катаральное, гнойно-катаральное и др.).
Пролиферативное (продуктивное) воспаление характеризуется доминирующим размножением клеток гематогенного и гистиогенного происхождения. В зоне воспаления возникают клеточные инфильтраты, которые в зависимости от характера скопившихся клеток подразделяются на круглоклеточные (лимфоциты, гистиоциты), плазмоклеточные, эозинофильноклеточные, эпителиоидноклеточные, макрофагальные. При воспалении клетки с законченным циклом развития (зрелые) погибают, мезенхимальные же клетки претерпевают трансформацию и дифференциацию, в результате которых образуется молодая соединительная ткань. Она проходит все стадии созревания, вследствие чего орган или часть его пронизывается соединительно-тканными тяжами, что на поздних стадиях воспаления может привести к циррозу.
Теории воспаления
Учение о воспалении на научной основе стало развиваться с середины XIX в. – первой половины XX в., в связи с разработкой биохимических, биофизических, гистохимических методов и методов электронно-микроскопического изучения тканей.
Р. Вихров (1859), обратив внимание на повреждение паренхимы органов (дистрофические изменения клеток) при воспалении, создал так называемую нутритивную («питательную») теорию воспаления. На смену этой теории пришла сосудистая теория Ю. Конгейма (1887), который основное значение в патогенезе воспаления придавал реакции мелких сосудов, нарушению микроциркуляции. Он считал, что расширение приводящих сосудов и прилив артериальной крови в очаг воспаления обусловливают появление жара и покраснение тканей, увеличение проницаемости капилляров – припухлость, образование инфильтрата – сдавление нервов и возникновение боли, а все вместе — нарушение функции. Сосудистая теория Конгейма благодаря своей ясности и простоте получила широкое распространение. Современные электронно- и биомикроскопические исследования дают новое подтверждение ряду положений этой теории. В дальнейшем И.И. Мечниковым (1892) была выдвинута биологическая теория воспаления. В его трактовке воспаление рассматривается как реакция приспособления и защиты организма от вредных факторов. И.И. Мечников развил учение о фагоцитозе и придавал ему большое значение в механизме борьбы макроорганизма с «агрессором». Все предшественники И.И. Мечникова рассматривали воспаление как местный процесс. И.И. Мечников охарактеризовал воспаление как процесс, развивающийся на всех уровнях организации организма: клеточном (фагоцитоз), системном (иммунная система), организменном (эволюция воспаления в онто- и филогенезе).
В 1923 Г. Шаде (Н. Sсhade) выдвинул физико-химическую теорию воспаления. По его мнению основой воспаления является тканевой ацидоз, гипоксия, гипероксия и гипертония в очаге повреждения, которыми и определяется в дальнейшем вся совокупность изменений при воспалении. Риккер (С. Riсker, 1924), рассматривая феномены воспаления как проявления сосудисто-нервных расстройств, предложил нервно-сосудистую теорию воспаления. Однако, все эти теории – это теории очага воспаления, его отдельных сторон. В настоящее время патогенез воспаления рассматривается значительно шире. Предпринимаются попытки обобщить накопленные данные по этому вопросу и выстроить современную теорию воспаления. Однако, до сих пор единой обобщающей теории воспаления нет.
Источник
