Клеточный иммунный ответ иммунное воспаление

Эта форма иммунного ответа предназначена для защиты от внутриклеточных патогенов, локализующихся в цитоплазматических гранулах — микроорганизмов, фагоцитированных клетками, но не разрушенных из-за недостатка адекватных эффекторных механизмов или их блокады патогенами. Типичные представители таких патогенов — различные виды микобактерий, а также многие простейшие (например, лейшмании, хламидии), риккетсии, плазмодии, грибы (кандиды) и др.
Клеточный иммунный ответ воспалительного типа осуществляется в 4 этапа (рис. 3.109).
- Презентация дендритными клетками антигена CD4+ Т-лимфоци- там, приводящая к их активации.
- Развитие хелперных Т-лимфоцитов типа ТЫ.
- Презентация антигена макрофагами ранее сформировавшимся Т-хелперам (ТЫ-типа), их взаимная активация и выделение цитокинов.
- Активация цитолиза в фагосомах макрофагов.
За реализцию этой формы защиты отвечают Thl-клетки и макрофаги. Thl-клетки формируются на этапе запуска иммунного ответа и отвечают за специфическую составляющую реакции (распознавание антигена и направление реакции на его носителя). Макрофаги выступают в качестве эффекторных клеток. Начальный этап реакции против внутриклеточных патогенов, локализованных в фаголизосомах, осуществляется так же, как при запуске любой формы иммунного ответа: дендритные клетки, захватившие патоген или его фрагмент, презентируют антигенный пептид CD4+ Т-клеткам, которые активируются, пролиферируют и дифференцируются в хелперные Т-лимфоциты. Уже на этапе распознавания антигена происходит ориентация дифференцировки CD4+ Т-лимфоцитов в хелперы Thl-типа, которая затем поддерживается цитокинами, продуцируемыми дендритными клетками — IL-12, IFNy (см. раздел 2.5.5.5).

Рис. 3.109. Схема развития клеточного иммунного ответа воспалительного типа
Активирующее взаимодействие Thl-клеток с макрофагами
Этот этап характерен именно для воспалительного иммунного ответа. Он состоит во взаимодействии специфических TM-клеток с макрофагами, которые содержат на своей поверхности молекулы MHC-II, несущие пепидный фрагмент антигена. При взаимодействии формируется иммунный синапс. В результате генерируются активирующие сигналы, направленные как в ТЫ-клетку, так и в макрофаг. В TW-лимфоцит сигналы поступают через молекулы TCR/CD4 и CD28. В результате этой повторной стимуляции Т-клетки (первая стимуляция была вызвана презентацией антигена дендритной клеткой) происходит усиление выработки цитокинов, важных для реализации последующих событий (в частности IFNy и TNFa).
Стимуляция макрофага при взаимодействии с TW-клеткой реализуется с помощью двух механихмов (рис. 3.110). Один из них — контактный — через костимулирующую молекулу CD40, с которой связывается ее лиганд CD154. CD40 спонтанно экспрессируется макрофагами, тогда как ее лиганд появляется на поверхности TM-клеток в результате активации при формировании иммунного синапса. В передаче сигнала от молекулы CD40 участвуют адапторные факторы TRAF-1, TRAF-2, TRAF-6. В результате происходят активация фактора NF-kB и запуск Rac-зависимой ветви MAP-каскада, завершающейся формированием транскрипционного фактора с-Jun. Второй механизм активации опосредуется IFNy. При связывании этого цитокина с рецептором включается сигнальный путь, вовлекающий киназы Jak1 и Jak2, транскрипционный фактор STAT1, а также дополнительные пути с участием MAP-каскада.
Результат активации макрофагов — экспрессия многочисленных генов, приводящая к повышению содержания на поверхности клетки молекул MHC-I и особенно MHC-II, сборке NADPH-оксидазы, активации ферментов окислительного метаболизма. Наиболее специфичное проявление ответа макрофагов на стимулирующее действие IFNy — экспрессия гена индуцибельной NO-синтазы. Именно NO и его производные, такие

Рис. 3.110. Активация макрофагов Т-хелперами. Показаны механизмы воздействия Thl-клеток на макрофаги (контактный и опосредованный цитокинами), а также индуцируемые Т-клетками проявления активации макрофагов
как пероксинитрит (ОО*NO), вызывают гибель микобактерий и других внутриклеточных патогенов, сохранявшихся и даже размножавшихся в фагосомах. Все эффекты IFNy, в том числе способность индуцировать образование NO-синтазы, усиливаются TNFa, продуцируемым как Th1- клетками, так и самими макрофагами. Эффективность действия цитокинов, вырабатываемых TM-клетками, существенно повышается в связи с сосредоточением их секреции в области контакта с макрофагами. Это, кроме того, уменьшает активацию посторонних клеток и их повреждение. Для обеспечения этой ориентированной секреции необходима поляризация клеток в ходе формирования иммунного синапса.
Особого внимания заслуживает взаимодействие цитокинов IL-12 и IFNy при воспалительном иммунном ответе (рис. 3.111). Экспрессия IL-12 в макрофагах индуцируется при связывании PAMP с TLR. Экспрессия гена IL12 — один из результатов сигнального пути, вовлекающего адапторный белок MyD88 и транскрипционный фактор NF-kB. IL-12 играет решающую роль в индукции дифференцировки TM-клеток и стимулирует выработку этими клетками IFNy, один из важнейших эффектов которого — усиление выработки макрофагами IL-12. Таким образом, эти цитокины вместе с рецепторами и сигнальными путями, ответственными за экспрессию их генов, образуют единую функциональную систему, которой принадлежит ключевая роль в реализации воспалительной формы клеточного иммунного ответа. Дефекты в любом звене этой системы приводят к развитию иммунодефицитов, сопровождающихся повышенной чувствительностью к микобактериям и другим патогенам, в ответ на которые вовлечены ТЫ-клетки и макрофаги.
Воспалительная составляющая Thl-клеточного иммунного ответа
В отличие от цитотоксического иммунного ответа, не связанного очевидным образом с воспалительной реакцией, иммунный ответ, опосредованный TW-клетками, полностью реализуется в ее рамках. Запуск ответа происходит по классической схеме. В очаге инфицирования (обычно в

Рис. 3.111. Роль интерферона у в дифференцировке и реализации функций Т-хел- перов. Интерферон у, продуцируемыйклеткамиврожденногоиммунитета, определяет направление развития адаптивного иммунного ответа, в ходе которого он также секретируется Thl-клетками и активирует основные эффекторы воспалительной формы клеточного ответа — макрофаги
барьерных тканях) дендритные клетки поглощают патоген или его фрагмент и транспортируют его в региональный лимфатический узел или иные вторичные лимфоидные органы. Дифференцировавшиеся специфические ХЫ-клетки поступают в рециркуляцию. Подобно цитотоксическим Т-лимфоцитам, они утрачивают мембранные молекулы, направляющие их миграцию в лимфоидные органы (CD62L, CCR7) и приобретают обычные свойства эффекторных клеток, включая усиленную экспрессию мембранных интегринов (LFA-1, VLA-4) и рецепторов для хемокинов, секретируе- мых в очагах воспаления и барьерных тканях (для Thl-клеток — CXCR3, CCR5, CCR2 и др.).
Оказавшись в очагах инфицирования, Thl-клетки в кооперации с макрофагами осуществляют реакции, описанные выше. В результате взаимодействия этих клеток, особенно действия IFNy, происходит максимально выраженная активация макрофагов. Эта активация результативна с точки зрения защиты от внутриклеточных патогенов, но деструктивна для окружающих тканей. Активированные макрофаги выделяют весь спектр своих секреторных продуктов. Он включает разнообразные провоспалительные факторы и факторы бактерицидности. К последним относят активные формы кислорода, их галоидные производные, оксид азота и его дериваты, ферменты и т.д. Среда в окружении таких клеток закисляется. Поскольку контакт макрофагов с Thl-клетками к этому моменту прекращается, секреция уже не носит ориентированного характера. Выделяемые молекулы выступают как факторы внеклеточной
микробицидности и одновременно вызывают повреждение окружающих нормальных клеток организма. Таким образом, продукты Th1-клеток дополнительно усиливают воспалительную реакцию, в то же время придавая ей специфичность в отношении конкретных возбудителей.
Вариант воспаления, реализуемый с участием Th1-клеток, называют иммунным воспалением, а сам Th1-клеточный иммунный ответ носит название воспалительного клеточного иммунного ответа. В рамках этой формы иммунного ответа особенно ярко проявляется соотношение факторов врожденного и адапативного иммунитета: эффекторным механизмом служит типичная реакция врожденного иммунитета — фагоцитоз, однако он усиливается и приобретает специфичность в отношении конкретных антигенов благодаря вовлечению в реакцию клеток адаптивного иммунитета.
Гранулема

При неэффективном клеточном ответе воспалительного типа, т.е. в случаях, когда разрушения и переваривания внутриклеточных патогенов не происходит, формируется гранулема (рис. 3.112). Гранулема представляет собой морфологическую структуру округлой формы, в центре которой расположены инфицированные макрофаги, а также клеточный детрит и патогены, освободившиеся в результате разрушения макрофагов. Вследствие слияния макрофагов образуются гигантские многоядерные клетки. Некоторые макрофаги претерпевают морфологические изменения, приобретая фенотип так называемых эпителиоидных клеток. Периферическая часть гранулемы образована активированными макрофагами, лишенными патогенов, и Т-лимфоцитами (преимущественно TM-клетками). Т-клетки постоянно
перемещаются, причем эта подвижность важна для сохранения структурной целостности гранулемы. Формирование гранулемы сопряжено с деструкцией ткани и нарушением функционирования большого участка пораженных органов (например, легких при туберкулезе), что делает ее патологическим образованием. С другой стороны, гранулема представляет способ изоляции патогена, с уничтожением которого иммунная система не справляется, и в этом смысле выступает как защитное приспособление организма.
Эффекторные реакции, опосредованные ТН2-клетками
^2-клетки участвуют в эффекторных реакциях, направленных на защиту от многоклеточных паразитов. Эти реакции изучены пока крайне мало. При этом, подобно TM-клеткам, ^2-лимфоциты вовлекают в защитную реакцию клетки миелоидного ряда. В отличие от реакций, опосредованных TW-клетками, эти клетки представлены не макрофагами, а эозинофилами и тучными клетками.
Роль ^2-клеток в этих процессах в значительной степени состоит в секреции цитокинов: IL-4, IL-5, IL-13, IL-9, IL-3 и GM-CSF. Каждый из них в той или иной степени участвует во взаимодействии с исполнительными клетками. Основную роль при этом играет IL-5. Этот цитокин служит фактором выживания эозинофилов, поддерживает их развитие и привлекает эти клетки в очаг поражения. Эозинофилы инфильтрируют ткань вокруг паразита и выделяют продукты своих гранул, из которых главный белок эозинофилов (MBP), пероксидаза эозинофилов (EPO) и катионный белок эозинофилов (ECP) обладают цитопатогенной активностью в отношении клеток гельминтов и других макропаразитов.
Вспомогательную роль в подобных реакциях играют антитела класса IgE. Полагают, что этот минорный класс иммуноглобулинов, известный как ключевой фактор аллергии немедленного типа, предназначен для осуществления антипаразитарной защиты. Помимо прямого блокирующего действия на паразитов, IgE способен «армировать» макрофаги, связываясь с высокоаффинными FceRI-рецепторами на их поверхности, что придает прицельность действию макрофагов и служит дополнительным фактором их активации.
Источник
Оглавление темы «Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.»: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
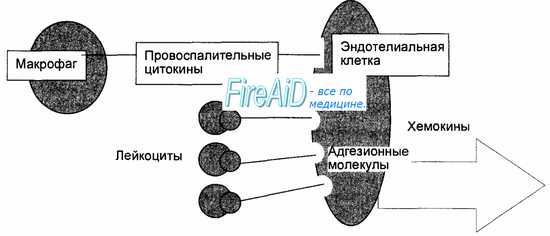
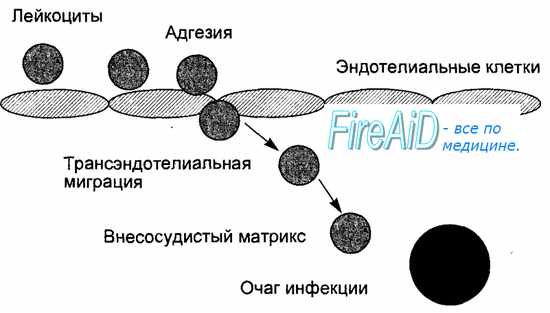
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») — Также рекомендуем «Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.» |
Источник
Основные этапы клеточного иммунного ответа
При клеточном иммунном ответе деструкцию и элиминацию причинного антигена осуществляют цитотоксические лимфоциты (ЦТЛ) и активированные иммунной системой («нанятые» ею) лейкоциты воспалительной реакции. Основные этапы клеточного иммунного ответа следующие (в кратком виде они приведены на рис. 37.1-1):
– взаимодействие с антигеном антигенпрезентирующей клетки (АПК), чаще – дендритной клетки или макрофага,
– процессинг антигена в АПК,
– презентация процессированного антигена антигенпрезентирующей клеткой Т-хелперу (CD4-клетке),
– активация Т-хелперов первого типа и синтез ими активационных цитокинов (ИЛ-2 и др.),
– действие активационных цитокинов, проявляющаяся в активации и пролиферации соответствующего клона Т-киллера, а также в активации («нанимании») лейкоцитов воспалительной реакции,
– эффекторное звено клеточного иммунного ответа – уничтожение клеток, несущих комплекс [чужеродный пептид + МНС-I] ЦТЛ (Т-киллерами), а также развитие иммунного воспаления, осуществляемое «нанятыми» лейкоцитами,
– завершающие процессы (в случае успешной деструкции и элиминации причинного антигена, т.е. эффективного иммунного ответа) – супрессия иммунного ответа вследствие гибели активированных клеток, а также ингибиции их активности, и появление клеток иммунологической памяти (долгоживущих и не до конца дифференцированных Т-лимфоцитов).

Рис. 37.1-1. Общая схема клеточного иммунного ответа
37.2. Процессинг антигена
Этим термином обозначаются те изменения, которые происходят с антигеном внутри антигенпрезентирующей клетки (Рис 37.2-1).

Рис. 37.2-1. Процессинг и презентация антигена
А. Процессинг начинается с поглощения антигена антигенпрезентирующей клеткой.
Б. Затем происходит частичная деградация антигена с вычленением эпитопов.
В. После этого в цитоплазме АПК каждый вычлененный эпитоп соединяется с молекулой МНС и образуется «процессированный антиген» – так называется комплекс [эпитоп + МНС].
37.3. Презентация процессированного антигена
Вывод комплекса [эпитоп + МНС] на поверхностную мембрану антигенпрезентирующей клетки называется презентацией антигена, а сам этот комплекс обозначается как презентированный антиген (Рис. 37.3-1).
А. Комплекс [эпитоп + МНС-II] презентируется Т-хелперам (CD4-лимфоцитам).
Б. Комплекс [эпитоп + МНС-I] презентируется Т-киллерам (CD8-лимфоцитам).

Рис. 37.3-1. Взаимодействие рецепторных и корецепторных молекул при презентации АПК процессированного антигена Т-киллеру (слева) и Т-хелперу (справа).
37.4. Активация Т-хелпера первого типа
Дивергенция иммунного ответа, т.е. выбор пути его преимущественного осуществления –клеточного или гуморального, осуществляется посредством выбора соответствующего типа Т-хелпера, активируемого антигенпрезентирующей клеткой. Точнее, выбора того пути активации, который будет избран для неактивного Т-хелпера (так называемого «нулевого Т-хелпера» – Th0). В случае клеточного иммунного ответа нулевой Т-хелпер активируется и дифференцируется в Т-хелпер первого типа (Th1), а в случае гуморального иммунного ответа – в Т-хелпер второго типа (Th2). При этом алгоритм активации Т-хелперов обоего типа практически идентичен, разница заключается лишь в конкретном наборе цитокинов, продуцируемых активированным Т-хелпером и, соответственно, в тех дальнейших событиях, которые этими цитокинами обуславливаются. Поэтому разбираемый ниже процесс активации Т-хелпера первого типа можно рассматривать и как алгоритм активации Т-хелпера второго типа, о котором пойдет речь в разделе 38.
А. Процесс активации Т-хелпера начинается с получения им информационных сигналов от антигенпрезентирующей клетки.
1. Первый информационный сигнал обусловлен контактом при полном соответствии TcR Т-хелпера с презентированным антигеном на поверхности АПК.
2. Второй и последующие информационные сигналы обусловлены корецепторными взаимодействиями Т-хелпера с АПК (включая действие на Т-хелпер синтезируемого макрофагом интерлейкина-1).
Б. Эти информационные сигналы инициируют внутри Т-хелпера определенные биохимические реакции.
В. Продукты этих биохимических реакций активируют транскрипцию определенных генов.
Г. Белки, синтез которых детерминируется этими генами, обуславливают пролиферацию клона Т-хелпера (происходит так называемая экспансия клона).
Д. Практически параллельно начинаются процессы додиференцировки Т-хелперов.
1. Во-первых, синтезируются определенные цитокины.
а. Для активации Т-киллеров (цитотоксических лимфоцитов).
б. Для активации иммунного воспаления (т.е. для «нанимания» осуществляющих его лейкоцитов).
2. Во-вторых, на Т-хелперах данного клона появляются (экспрессируются) специфические мембранные молекулы.
а. Рецепторы для активационных цитокинов, благодаря которым Т-хелперы резко усиливают свою чувствительность к «сигналам активации».
б. Других молекул межклеточного взаимодействия.
37.5. Действие активационных цитокинов
Активационные цитокины синтезируются всеми клетками, участвующими в иммунном ответе. При клеточном иммунном ответе это АПК, Т-хелперы, цитотоксические лимфоциты, лейкоциты воспалительной реакции. В таком «перекрестном» действии иммунокомпетентных клеток и их партнеров проявляется, в числе прочего, кооперативный механизм действия иммунной системы (Рис. 37.5-1).

Рис. 37.5-1. Схема взаимодействия клеток в ходе клеточного иммунного ответа
(по Воробьеву А.А., 2002 г.)
А. Эти цитокины вызывают активацию Т-киллеров, принимающих участие в эффекторном звене клеточного иммунного ответа.
Б. Кроме этого, активационные цитокины стимулируют развитие в зоне нахождения причинного антигена воспалительной реакции, которая, наряду с действием Т-киллеров, и олицетворяет собой результат клеточного иммунного ответа.
37.6. Эффекторное звено клеточного иммунного ответа
Как уже указывалось, эффекторным звеном клеточного иммунного ответа является иммунное воспаление вкупе с цитотоксической активностью Т-киллеров.
А. Воспалительная реакция является нормальной защитной реакцией макроорганизма на проникновение в него микроба, поэтому само по себе воспаление является признаком наличия инфекционного процесса (хотя в редких случаях и может развиться так называемое асептическое воспаление). Термин «иммунное воспаление», которым обозначается одна из двух основных сторон эффекторного звена клеточного иммунного ответа, означает, что воспалительная реакция организована именно иммунной системой в помощь активированным в ходе иммунного ответа цитотоксическим лимфоцитам. Закономерности развития воспалительной реакции разбираются в курсе патологической физиологии.
Б. Что же касается механизмов уничтожения клеток, несущих чужеродный антиген (клеток-мишеней), Т-киллерами (цитотоксическими лимфоцитами), то они сводятся к двум основным процессам.
1. Это, во-первых, внеклеточная цитотоксичность, осуществляемой перфоринами.
а. Перфорин представляет собой особый протеин. В гранулах цитотоксических лимфоцитах он находится в виде растворимого белка-предшественника.
б. Будучи секретирован Т-киллером, перфорин в течение нескольких секунд полимеризуется в мембране клетки-мишени (липофильные участки наружу, гидрофобные – внутрь клетки) с образованием поры диаметром 16 нм. В результате клетка-мишень разрушается в результате осмотического лизиса (Рис. 37.6-1).

Рис. 37.6-1. Осмотический лизис клетки-мишени как результат воздействия на нее перфоринов, синтезированных цитотоксическими лимфоцитами
2. Во-вторых, запуск в клетках-мишенях процесса апоптоза (генетически запрограммированной гибели клеток без образования токсических продуктов распада). Цитотоксические лимфоциты включают апоптоз в клетке-мишени двумя путями.
а. Через мембранную пору, сформированную перфорином, внутрь клетки-мишени проникают секретируемые цитотоксическим лимфоцитом гранзимы (сериновые протеазы), которые активируют в клетке-мишени каспазы (особые ферменты – цистеиновые протеазы), которые в свою очередь активируют эндонуклеазы, осуществляющие фрагментацию ДНК (кариорексис) (Рис. 37.6-2), вслед за чем происходит выпочковывание апоптозных телец (фрагментов, окруженных мембраной) и распад на них клетки без формирования воспалительной реакции (т.е. продукты распада клетки не являются токсичными для макроорганизма) (Рис. 37.6-3).

Рис. 37.6-2. Дефрагментация ДНК при апоптозе

Рис. 37.6-3. Процесс апоптоза
б. Взаимодействие комплекса [TCR + CD3] с MHC-I на поверхности клетки-мишени приводит к включению в геноме ЦТЛ механизма транскрипции гена, детерминирующего синтез Fas-лиганда, который затем экспрессируется на поверхности ЦТЛ. На поверхности клетки-мишени находится рецептор для Fas-лиганда – Fas-белок. Специфическое связывание Fas-белка с Fas-лигандом активизирует Fas-белок, который, в свою очередь запускает процесс активации каспаз (Рис. 37.6-4).

Рис. 37.6-4. Запуск Т-киллером апоптоза клетки-мишени вследствие экспрессии на нем Fas-лиганда и специфического взаимодействия последнего с Fas-рецептором (Fas-белком) на поверхности клетки-мишени
в. На организацию сигнала к апоптозу для клетки-мишени цитотоксическому лимфоциту требуется не более 5 минут, после чего он физически переходит к другой клетке-мишени. Т.е. ЦТЛ является серийным киллером (Рис. 37.6-5).

Рис. 37.6-5. Серийный убийца – цитотоксический лимфоцит (Т-киллер)
(на рисунке видно, что на поверхности клетки-мишени – например, клетки, инфицированной вирусом – меняется «репертуар» рецепторных молекул, что и делает возможным прикрепление к ней Т-киллера с последующим запуском описанных выше путей внеклеточной цитотоксичности последнего)
г. После завершения апоптоза происходит своеобразная «уборка» образовавшихся продуктов распада клетки, в которой участвуют макрофаги и дендритные клетки.
1. Макрофаги фагоцитируют апоптозные тельца.
2. Дендритные клетки играют двоякую роль.
а. С одной стороны, они поглощают апоптозные тельца макрофагоцитозом.
б. С другой стороны, дендритные клетки способны индуцировать иммунный ответ на компоненты апоптозных телец.
37.7. Завершающие процессы эффективного клеточного иммунного ответа
Эффективный иммунный ответ приводит к элиминации (т.е. уничтожению) причинного антигена. С этого момента организм начинает «гасить» иммунологическую реакцию, чтобы не допустить перенапряжения иммунной системы, в частности – дефицита лимфоцитов (так как продолжительность жизни активированных лимфоцитов не велика). События развиваются в двух направлениях.
А. Организовывается супрессия (т.е. подавление) иммунного ответа. Этот процесс осуществляет, в частности, специальная субпопуляция цитотоксических лимфоцитов – Т-супрессоры.
1. Происходит гибель активированных клеток. Механизмы этой гибели аналогичны тем, которые разбирались в разделе 37.6.Б, поскольку на этот раз активированные в ходе иммунного ответа клетки сами являются мишенью действия ЦТЛ.
2. Наряду с этим, путем синтеза соответствующих цитокинов, происходит ингибиция активности активированных в ходе иммунного ответа клеток.
Б. Одновременно появляются клетки иммунологической памяти. Это долгоживущие и не до конца дифференцированные Т-лимфоциты, которые при повторном контакте с причинным антигеном обуславливают развития вторичного иммунного ответа. В отличие от первичного (т.е. в ответ на первый контакт с причинным антигеном), вторичный иммунный ответ развивается значительно быстрее, так как начинается не с одного клона недифференцированных клеток, а со сравнительно многочисленного пула клеток, уже прошедших первые стадии дифференцировки.
Источник