Каскад реакций при воспалении
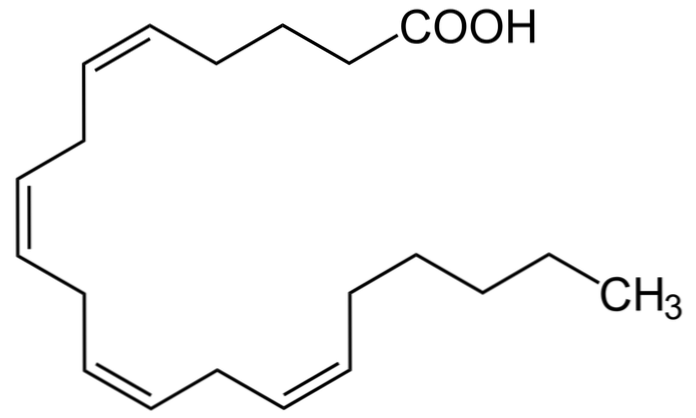
Рис. 7.
PG – простагландины; LT – лейкотриены; 5-НРЕТЕ – гидроперекись арахидоновой (эйкозотетраеновой) кислоты. Заштрихоновы стабильные метаболиты.
Простагландины (ПГ) являются функциональными синергистами гистамина, повышая капиллярную проницаемость и участвуя в модуляции болевой афферентной импульсации. Простациклин (PGI2) является главным естественным антиагрегантом тромбоцитов, а тромбоксан А2 (ТхА2) – мощнейшим вазоконстриктором и агрегантом. Лейкотриены сокращают гладкие мышцы и проявляют хемотаксические свойства, способствуя миграции нейтрофильных лейкоцитов в очаг воспаления. Повышению капиллярной проницаемости и облегчению эмиграции лейкоцитов способствуют также метаболиты-оксиданты – гипохлорит и хлорамин, накапливающиеся в высокой концентрации в очаге альтерации.
Начавшаяся лейкоцитарная эмиграция, в дальнейшем самоподдерживается собственными хемоаттрактантами: факторами хемотаксиса макрофагов, нейтрофилов, лимфоцитов. Факторы хемотаксиса входят в многочисленную группу клеточных БАВ – хемокинов, монокинов, лимфокинов. Помимо хемоаттракции они выполняют следующие функции:
♦- цитотоксичность (пероксиды, катионные белки, лимфотоксины, ФНО, интерфероны, лизосомальные гидролазы, кейлоны и др.);
♦- бласттрансформацию – пролиферацию и созревание иммуноцитов (митогенные факторы – ИЛ-1, ИЛ-2, ИЛ-6, факторы роста гранулоцитов, макрофагов, фибробластов и др.);
♦- активацию и ингибицию синтеза антител,
♦- пирогенность.
Помимо клеточных медиаторов, в патогенезе воспаления значительную роль выполняют медиаторы гуморального происхождения (табл. 5). Их источниками являются системы комплемента, кининов, гемостаза и фибринолиза.
Белковые медиаторы системы комплемента обеспечивают цитотоксичность (мембраноатакующие фрагменты комплемента: 3b5,6,7,8,9 и С5,6,7,8,9), опсонизацию и хемотаксис. Система комплемента – полифункциональна, и ее активность напрямую свзана с активностью систем гемостаза, фибринолиза и иммунитета.
Подключение кининов в воспалительный процесс начинается с момента расщепления плазменного α2-глобулина – кининогена на активные продукты: брадикинин и др. Это происходит под действием плазменных и тканевых протеиназ – калликреинов, активацию которых в очаге альтерации осуществляют фактор Хагемана (ХII-фактор свертывающей системы крови), гистамин, катионные белки, лизосомальные протеиназы. В целом, активированные пептиды калликреин-кининовой системы обеспечивают хемотаксис, вазодилатацию и капиллярную проницаемость. Калликреин-кининовая система – полифункциональна и объединяет все протеолитические системы организма, в том числе системы гемостаза и фибринолиза.
Активация систем гемостаза и фибринолиза в очаге альтерации инициируется коллагеном – белком базальных мембран капилляров, который «обнажается» при повреждении и десквамации (слущивание) эндотелия сосудов. Коллаген, в свою очередь, активирует фактор Хагемана, тот – калликреин, а затем развивается каскад реакций активации различных протеиназ, обеспечивающих гемокоагуляцию. Повреждение эндотелия может также инициировать активацию системы фибринолиза, с последующим лизисом тромбов и восстановлением кровообращения в зоне воспаления.
Следствием вышеуказанных микроциркуляторных нарушений в зоне альтерации создаются условия для процесса формирования отека – экссудата, который поддерживается нарастающими гиперионией, гиперонкией и ацидозом. Ацидоз еще более повышает капиллярную проницаемость, а гипериония и гиперонкия, возникающие из-за смешивания неорганических и органических электролитов интерстиция и разрушенных клеток, повышают осмотическое давление в очаге повреждения. По этим причинам сюда начинает перемещаться вода плазмы крови и ряд ее белков, которые вместе с содержимым участка повреждения и образуют экссудат. Роль экссудата в воспалении заключается в следующем:
♦- экссудат уменьшает дальнейшую альтерацию, разбавляя повреждающие факторы;
♦- вместе с экссудатом в очаг воспаления поступают антитела и другие бактерицидные вещества крови;
♦- экссудат сдавливает сосуды в пределах здоровых тканей, препятствуя распространению за пределы очага повреждения повреждающих факторов и продуктов распада тканей.
Барьерную роль экссудата усиливает тромбирование сосудов в зоне альтерации.
Параллельно процессу экссудации в очаг повреждения под влиянием хемоаттрактантов эмигрируют фагоциты. В начальный период экссудации, когда его метаболические нарушения характеризуются ацидозом (рН 4 – 5), в эмиграции превалируют нейтрофильные лейкоциты, цитотоксические системы которых максимально активны при высокой концентрации водородных ионов. Лейкоциты обеспечивают эффективный фагоцитоз микроорганизмов и инородных тел. К концу фазы экссудации, при нейтральных значениях рН, превалирует эмиграция макрофагов, которые фагоцитируют преимущественно погибшие клетки и останки тканей, расчищая зону поражения.
Цитотоксические эффекты фагоцитов реализуются АКР (супероксидный анион радикал, гидроксильный радикал, пергидроксил), лизосомальными гидролазами, катионными белками нейтрофилов и лимфотоксинами лимфоцитов. Свободные радикалы и гидролазы разрушают также межклеточный матрикс.
Завершающим этапом этой фазы воспаления является инактивация, сделавших свое дело, цитотоксических медиаторов иммуноцитов и торможение дальнейшей экссудации. Это осуществляется противовоспалительными медиаторами: ингибиторами протеиназ — например, антитрипсином, антиоксидантами (пероксидазы, СОД и др.), полиаминами (путресцин, спермин, кадаверин), глюкокортикоидами, гепарином.
Воспалительный процесс завершается фазой восстановления поврежденных тканей – пролиферацией. Она реализуется митогенными факторами неповрежденных паренхиматозных, стромальных и иммунных клеток, располагающихся, в основном, по периферии зоны воспаления. К наиболее значимым из них относятся:
1.Митогены: цитокины мононуклеаров (ИЛ-1, ЭФР, фактор роста фибробластов и др. факторы роста), антикейлоны, полиамины (путресцин, спермидин, спермин), цГМФ, гормоны (СТГ, инсулин и др.). Антимитогены: ФНО, цитокины — ингибиторы фибробластов, кейлоны, глюкокортикоиды, цАМФ.
2.Простагландины группы Еобеспечивают трофический компонент пролиферации.
3.Пептиды стимулируют ангиогенез – образование новых сосудов.
Интенсивность размножения паренхиматозных клеток в разных тканях существенно варьирует, что во многом определяет конечный итог: будет ли регенерация полной, или неполной – рубцовой. В этом смысле все органы и ткани принято делить на три группы:
1.Органы и ткани с практически неограниченной регенераторной потенцией паренхимы: эпителий кожи, слизистых дыхательных путей, ЖКТ, мочеполовой системы, гемопоэтическая ткань. Обязательным условием для их полной регенерации является поверхностное повреждение – эрозия, при которой сохраняется целостность базальной эпителиальной мембраны. Она осуществляется эпителизацией – замещением дефекта миграцией паренхиматозных клеток из базального слоя.
2.Ткани с ограниченной регенераторной потенцией паренхимы: сухожилия, хрящи, связки, костная ткань, периферические нервные волокна.
3.Ткани с практически отсутствующей регенераторной потенцией паренхимы и выраженной стромальной регенерацией: мышечная ткань, нейроны ЦНС.
Патогенез воспалительной пролиферации начинается уже в фазу экссудации и клеточной эмиграции, формированием в очаге повреждения фибринового каркаса для размножающихся клеток. В зависимости от преобладания митогенной активности первыми начинают делиться либо паренхиматозные, либо стромальные клетки – фибробласты. Фибробласты продуцируют полимеры соединительной ткани – протеогликаны, коллагены и др., скрепляя паренхиму. Через 1 – 2 суток после фибробластов в зону восстановления проникают эндотелиальные клетки, которые размножаясь, формируют новые капилляры. Вокруг них концентрируются тучные клетки, макрофаги и нейтрофилы, секретирующие факторы ангиогенеза. При преобладающем размножении фибробластов, они, вместе со своими продуктами и вновь образованными капиллярами, формируют грануляционную ткань. Ее функцией является защита от внешних факторов и восстановление анатомической целостности поврежденного участка. Со временем под влиянием антимитогенов образование грануляционной ткани прекращается, и она постепенно превращается в волокнистую ткань – рубец. Рубцы могут вызывать деформацию органов: например, сужение пищевода, мочеточников, сморщивание клапанов сердца и серьезно нарушать их функцию.
Хотя процесс воспаления и носит локальный характер, он не может не сказываться на общем состоянии организма. Степень этих влияний тем больше, чем хуже срабатывают барьерные механизмы воспаления. В этих случаях из воспалительного очага в общий кровоток поступает много БАВ, продуктов распада тканей и микробных токсинов, вызывающих общую интоксикацию. Ряд БАВ — медиаторов лейкоцитов: ИЛ-1, ИЛ-6, ФНО, интерфероны индуцируют развитие организменной реакции, которая получила название системной реакции острой фазы. Частью этой реакции является формирование лихорадки, где указанные цитокины играют роль эндогенных пирогенов. Она проявляется также лейкоцитозом, который вызывается повышенным выходом ПЯЛ из костного мозга под влиянием ИЛ-1. Этот же цитокин, активируя нейроны головного мозга ответственные за медленный сон, способствует развитию заторможенности и сонливости. ИЛ-1 стимулирует секрецию АКТГ и СТГ, что приводит к мобилизации в кровь глюкозы, жирных кислот и аминокислот, обеспечивая высокую доступность этих субстратов защитным механизмам. Одним из проявлений острофазной реакции является синтез в печени белков острой фазы(С — реактивный белок, гаптоглобин, плазминоген, антитрипсин и др.) и поступление их в кровь. Часть этих белков вовлекается в реализацию защитных и патогенных механизмов, а часть является маркерами воспаления и служит диагностическим целям.
Воспаление может быть острым и хроническим. Острое воспаление характеризуется достаточно быстрым развитием и завершением в течение 1 – 2 недель. Хроническое воспаление может длиться месяцами и годами. Если оно изначально имеет вялое и длительное течение, его называют «первично-хроническим», а если оно приобретает затяжное течение после острого периода, то – «вторично-хроническим». Для хронического воспаления характерно наличие постоянного некротического очага, значительная лейкоцитарная (преимущественно макрофагальная и лимфоцитарная) инфильтрация, образование фиброзной капсулы и формирование специфических соединительнотканных бугорков – гранулем, содержащих возбудителя. Гранулемы могут подвергаться распаду (при туберкулезе, сифилисе и т.д.), а на их месте образуются полости, которые в свою очередь рубцуются. Хронизации воспаления способствуют:
♦- иммунодефицитные состояния;
♦- персистирующая инфекция и неинфекционные факторы альтерации;
♦- присоединение иммунной аутоагрессии;
♦- постоянное психоэмоциональное стрессирование.
В зависимости от доминирования какой либо из фаз, различают 3 основных вида воспаления.
1.Альтеративноевоспаление. Характеризуется доминированием процессов разрушения – деструкции над процессами экссудации и пролиферации. Оно чаще всего встречается в паренхиматозных органах (почках, печени, сердце) и клинически проявляется острым и тяжёлым течением.
2.Экссудативно-инфильтративноевоспаление, Характеризуется выраженными процессами экссудации и клеточной эмиграции. В зависимости от состава экссудата различают следующие его виды:
— серозный экссудат — содержит до 3 – 5% белка, премущественно альбумина с единичными лейкоцитами. Он образуется и накапливается в полостях плевры, брюшины или выделяться на поверхности слизистых оболочек (например, дыхательных путей). Серозный экссудат легко рассасывается, иногда оставляя незначительное утолщение серозных оболочек;
♦- фибринозныйэкссудат — содержит фибрин и образует пленки на поверхностях серозных и слизистых оболочек. Фибринозное воспаление с плотными пленками называют еще дифтеритическим. Оно характерно для пищевода, миндалин, полости рта. Рыхлые фибриновые пленки образуются в ЖКТ, воздухоносных путях и носят название крупа, а само воспаление именуется крупозным. На серозных оболочках массы фибрина частично подвергаются аутолизу, а большая часть прорастает соединительной тканью, образуя рубцы и спайки, нарушающие функции органа. На слизистых оболочках фиброзные пленки рассасываются и отторгаются, оставляя язвенные дефекты, заживление которых может затянуться надолго;
♦— гнойный экссудат — вязкий, мутный, зеленоватого оттенка и помимо белков содержит продукты распада тканей, погибшие лейкоциты (гнойные тельца). Гнойное воспаление развивается на слизистых оболочках, в серозных полостях и паренхиме органов. Оно может протекать в виде абсцесса – при инкапсулировании, флегмоны – при пропитывании тканей, или эмпиемы – при скоплении в полостях;
♦— гнилостный экссудат называется ихорозным и образуется при анаэробной инфекции. Он вязкий, грязно-зеленого цвета и зловонного запаха из-за образующихся газов;
♦- геморрагическийэкссудат – содержит эритроциты. Он образуется при высоковирулентной инфекции – чуме, сибирской язве, черной оспе, токсическом гриппе;
♦- смешанные формы экссудата – серозно-фибринозный, серозно-гнойный, серозно-геморрагический, гнойно-фибринозный и др. образуются при присоедингении вторичной инфекции на фоне ослабленного иммунитета;
♦- катаральный экссудат – содержит большое количество слизи, лейкоцитов, лимфоцитов, слущенных эпителиальных клеток. Он образуется при воспалении слизистых оболочек, стекая по ним. Таковы катаральный ринит, риносинусит, гастрит, энтероколит. Обычно воспаление слизистой начинается с серозного катара, который затем переходит в слизистый и гнойный.
3.Пролиферативное (продуктивное)воспаление. Характеризуется преобладанием процессов разрастания соединительной ткани и формирования специфических гранулем. Оно развивается при хронических инфекциях, интоксикациях и приводит к тканевой деформации и дисфункции.
Принципы терапиивоспалительного процесса, с одной стороны, базируется на поддержании его саногенетических механизмов, а с другой, — на подавлении патогенных. Основные ее положения следующие:
♦- уничтожение возбудителей инфекции при септическом воспалении антибактериальными препаратами;
♦- активация иммунитета (за исключением аллергического воспаления) иммунностимуляторами, активаторами эмиграции лейкоцитов, фагоцитоза и пролиферации;
♦- подавление чрезмерной экссудации неспецифическими противовоспалительными препаратами (НПВС) при гиперергическом и аллергическом воспалении;
♦- подавление рубцовой пролиферации НПВС при хроническом воспалении.
Источник
арахидоновая кислота Это соединение из 20 атомов углерода. Это полиненасыщенная жирная кислота, потому что она имеет двойные связи между своими атомами углерода. Эти двойные связи находятся в положении 5, 8, 11 и 14. По положению своих связей относится к группе омега-6 жирных кислот.
Все эйкозаноиды — молекулы липидной природы, участвующие в различных путях с жизненно важными биологическими функциями (например, воспаление) — происходят из этой жирной кислоты из 20 атомов углерода. Большая часть арахидоновой кислоты содержится в фосфолипидах клеточной мембраны и может выделяться рядом ферментов..
Арахидоновая кислота участвует в двух путях: путь циклооксигеназы и путь липоксигеназы. Первый приводит к образованию простагландинов, тромбоксанов и простациклина, а второй генерирует лейкотриены. Эти два ферментативных пути не связаны.
индекс
- 1 Функции
- 2 Арахидоновая кислота в рационе
- 3 Каскад арахидоновой кислоты
- 3.1 Высвобождение арахидоновой кислоты
- 3.2 Простагландины и тромбоксаны
- 3.3 Лейкотриены
- 3.4 Неферментативный метаболизм
- 4 Ссылки
функции
Арахидоновая кислота обладает широким спектром биологических функций, среди которых:
— Это неотъемлемая составляющая клеточной мембраны, придающая ей текучесть и гибкость, необходимые для нормального функционирования клетки. Эта кислота также подвергается циклам деацилирования / реакции, когда она обнаруживается в мембране в виде фосфолипида. Процесс также известен как цикл Земли.
— Он обнаруживается, в частности, в клетках нервной системы, скелета и иммунной системы..
— В скелетных мышцах это помогает восстановить и вырастить это. Процесс происходит после физической нагрузки.
— Не только метаболиты, производимые этим соединением, имеют биологическое значение. Кислота в своем свободном состоянии способна модулировать различные ионные каналы, рецепторы и ферменты, активируя или дезактивируя их через различные механизмы..
— Метаболиты, полученные из этой кислоты, способствуют воспалительным процессам и приводят к образованию медиаторов, ответственных за решение этих проблем..
— Свободная кислота вместе с ее метаболитами стимулирует и модулирует иммунные реакции, ответственные за устойчивость к паразитам и аллергии..
Арахидоновая кислота в рационе
Как правило, арахидоновая кислота поступает из рациона. Он богат продуктами животного происхождения, различными видами мяса, яйцами, другими продуктами питания..
Однако его синтез возможен. Чтобы сделать это, линолевая кислота используется в качестве прекурсора. Это жирная кислота, которая имеет 18 атомов углерода в своей структуре. Это незаменимая жирная кислота в рационе.
Арахидоновая кислота не является необходимой, если имеется достаточное количество доступного линолевой кислоты. Последний содержится в значительных количествах в продуктах растительного происхождения.
Каскад арахидоновой кислоты
Различные стимулы могут способствовать высвобождению арахидоновой кислоты. Они могут быть гормонального, механического или химического типа.
Высвобождение арахидоновой кислоты
Как только необходим сигнал, кислота высвобождается из клеточной мембраны с помощью фермента фосфолипазы А2 (PLA2), но тромбоциты, помимо обладания PLA2, также обладают фосфолипазой C.
Сама кислота может выступать в качестве второго мессенджера, изменяя другие биологические процессы, или она может превращаться в разные молекулы эйкозаноидов по двум различным ферментативным путям..
Он может высвобождаться различными циклооксигеназами и могут быть получены тромбоксаны или простагландины. Аналогичным образом, он может быть направлен на липоксигеназный путь, и лейкотриены, липоксины и гепоксилины получены в качестве производного..
Простагландины и тромбоксаны
Окисление арахидоновой кислоты может пройти по циклооксигеназному пути и PGH-синтетазе, продуктами которой являются простагландины (PG) и тромбоксан.
Есть две циклооксигеназы, в двух отдельных генах. Каждый выполняет определенные функции. Первый, COX-1, кодируется в хромосоме 9, обнаруживается в большинстве тканей и является конститутивным; то есть он всегда присутствует.
Напротив, ЦОГ-2, кодируемый в хромосоме 1, проявляется под действием гормональных или других факторов. Кроме того, ЦОГ-2 связан с воспалительными процессами.
Первыми продуктами, которые образуются в результате COX-катализа, являются циклические эндопероксиды. Впоследствии фермент производит оксигенацию и циклизацию кислоты, образуя PGG2..
Последовательно, тот же самый фермент (но на этот раз с его функцией пероксидазы) добавляет гидроксильную группу и превращает PGG2 в PGH2. Другие ферменты ответственны за катализ PGH2 в простаноиды.
Функции простагландинов и тромбоксанов
Эти молекулы липидов действуют на различные органы, такие как мышцы, тромбоциты, почки и даже кости. Они также участвуют в ряде биологических событий, таких как повышение температуры, воспаление и боль. Они также играют роль во сне.
В частности, COX-1 катализирует образование соединений, которые связаны с гомеостазом, желудочной цитопротекцией, регуляцией тонуса сосудов и ветвей, сокращениями матки, функциями почек и агрегацией тромбоцитов..
Вот почему большинство лекарств против воспаления и боли действуют путем блокирования ферментов циклооксигеназы. Некоторые распространенные препараты с таким механизмом действия — аспирин, индометацин, диклофенак и ибупрофен..
лейкотриены
Эти молекулы трех двойных связей вырабатываются ферментом липоксигеназы и секретируются лейкоцитами. Лейкотриены могут оставаться в организме около четырех часов.
Липоксигеназа (LOX) включает молекулу кислорода в арахидоновую кислоту. Есть несколько LOX, описанных для людей; в этой группе наиболее важным является 5-LOX.
5-LOX для своей активности требует наличия активирующего белка (FLAP). FLAP обеспечивает взаимодействие между ферментом и субстратом, позволяя реакции.
Функции лейкотриенов
Клинически они играют важную роль в процессах, связанных с иммунной системой. Высокий уровень этих соединений связан с астмой, ринитом и другими нарушениями гиперчувствительности.
Неферментативный метаболизм
Таким же образом метаболизм может осуществляться по неферментативным путям. То есть упомянутые ранее ферменты не действуют. Когда происходит перекисное окисление — следствие свободных радикалов — возникают изопростаны.
Свободные радикалы — это молекулы с неспаренными электронами; следовательно, они нестабильны и должны реагировать с другими молекулами. Эти соединения были связаны со старением и болезнями.
Изопротано очень похожи на соединения с простагландинами. По тому, как они производятся, они являются маркерами окислительного стресса..
Высокие уровни этих соединений в организме являются показателями заболеваний. Они в изобилии у курящих. Кроме того, эти молекулы связаны с воспалением и восприятием боли.
ссылки
- Сирил А. Д., Лломбарт С. М., Тамарго Дж. Дж. (2003). Введение в терапевтическую химию. Ediciones Díaz de Santos.
- Ди Унглауб, С. (2008). Физиология человека комплексный подход. Четвертое издание. Панамериканская медицинская редакция.
- del Castillo, J.M.S. (Ed.). (2006). Основное питание человека. Университет Валенсии.
- Фернандес, П. Л. (2015). Веласкес. Базовая и клиническая фармакология. Ed. Panamericana Medical.
- Лендс, У. Э. (ред.). (2012). Биохимия обмена арахидоновой кислоты. Springer Science & Business Media.
- Tallima H. & El Ridi R. (2017). Арахидоновая кислота: физиологические роли и потенциальные преимущества для здоровья. Обзор. Журнал перспективных исследований.
Источник

