Кардиоэзофагеальный переход с хроническим воспалением
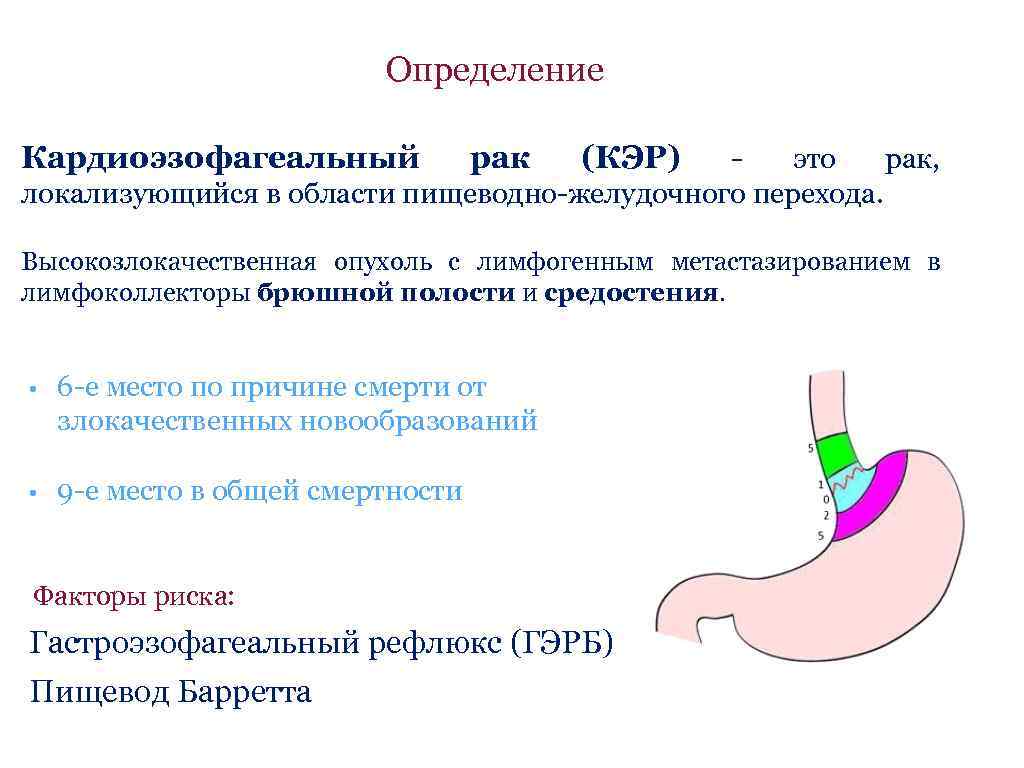
 Рис. 1. Эндоскопическая картина опухолевой стриктуры пищевода. а — в нижней трети пищевода определяется циркулярный стенозирующий опухолевый рост; проксимальный край опухолевого роста находится на расстоянии 38 см от резцов; б — просвет в области опухолевого роста составляет примерно 6—7 мм; в — дистальный край опухоли в кардиальном отделе находится на границе с верхней третью тела желудка.
Рис. 1. Эндоскопическая картина опухолевой стриктуры пищевода. а — в нижней трети пищевода определяется циркулярный стенозирующий опухолевый рост; проксимальный край опухолевого роста находится на расстоянии 38 см от резцов; б — просвет в области опухолевого роста составляет примерно 6—7 мм; в — дистальный край опухоли в кардиальном отделе находится на границе с верхней третью тела желудка.
 Рис. 2. Выполнение эндоскопического стентирования пищевода. а — эксперты в операционной: Гвидо Костаманья (Рим, Италия), М.С. Бурдюков (Москва, Россия), медсестра Т.Ю. Колесова; б — заведение доставляющего устройства с нитиноловым частично покрытым стентом с проксимальным раскрытием Boston Scientific Ultraflex (США) 120 мм под контролем ультратонкого видеогастроскопа Olympus GIF N180 (Япония).
Рис. 2. Выполнение эндоскопического стентирования пищевода. а — эксперты в операционной: Гвидо Костаманья (Рим, Италия), М.С. Бурдюков (Москва, Россия), медсестра Т.Ю. Колесова; б — заведение доставляющего устройства с нитиноловым частично покрытым стентом с проксимальным раскрытием Boston Scientific Ultraflex (США) 120 мм под контролем ультратонкого видеогастроскопа Olympus GIF N180 (Япония).
 Рис. 3. Этапы эндоскопического стентирования злокачественной структуры пищевода. а — доставляющее устройство с нитиноловым частично покрытым стентом Boston Scientific Ultraflex (США) с проксимальным раскрытием установлено на уровне опухолевой стриктуры; б — проксимальный край стента выше стриктуры на 2 см, дистальный край — в просвете желудка, доставочное устройство удалено, раскрытие полное, корректное положение стента; в — рентгеноскопия: определяется сохранение талии стента в зоне опухолевого стеноз, контраст поступает в просвет желудка.
Рис. 3. Этапы эндоскопического стентирования злокачественной структуры пищевода. а — доставляющее устройство с нитиноловым частично покрытым стентом Boston Scientific Ultraflex (США) с проксимальным раскрытием установлено на уровне опухолевой стриктуры; б — проксимальный край стента выше стриктуры на 2 см, дистальный край — в просвете желудка, доставочное устройство удалено, раскрытие полное, корректное положение стента; в — рентгеноскопия: определяется сохранение талии стента в зоне опухолевого стеноз, контраст поступает в просвет желудка.
Заболеваемость злокачественными новообразованиями пищеводно-желудочного перехода в западных странах резко увеличилась за последние 30 лет. Пятилетняя выживаемость пациентов с опухолью именно пищеводно-желудочного перехода составляет менее 20% [1, 2]. Тяжелым и нередко фатальным осложнением этого заболевания является дисфагия. Поэтому больные, страдающие выраженной степенью дисфагии, должны в неотложном порядке быть подвергнуты паллиативному лечению. Для проведения симптоматической терапии неоперабельным пациентам при опухолевых стенозах пищевода и зоны кардии выполняется установка самораскрывающихся металлических стентов.
По сравнению со стандартным методом стентирования опухолевого стеноза проксимального отдела пищевода, установка стента в зону пищеводно-желудочного перехода имеет некоторые дополнительные особенности и, следовательно, несет в себе более высокий риск развития осложнений [3].
В этой статье представлен клинический случай стентирования зоны пищеводно-желудочного перехода во время эндоскопического курса, проведенного в рамках 15-й Международной конференции «Высокие технологии в эндоскопии пищеварительной системы», прошедшей в Ярославле 6 июля 2015 г.
Пациентка 56 лет с диагнозом: «Кардиоэзофагеальный рак T3N2M1, IV стадия, IV клиническая группа. Осложнение основного заболевания: дисфагия III—IV степени. Кахексия».
Больная предъявляла жалобы на затруднение глотания мягкой пищи, дискомфорт в груди в течение последних 3 мес, на похудание на 20 кг за последние 3—4 мес.
По результатам ЭГДС: кардиоэзофагеальный рак (тип III по Зиверту) со стенозом и признаками кровотечения. Протяженность опухолевого стеноза 7 см.
Результаты гистологического исследования: инвазивная (не менее 1 мм) тубулярная темно-клеточная высокодифференцированная аденокарцинома пищеводно-желудочного перехода.
План лечения: эндоскопическое стентирование злокачественной стриктуры пищевода.
Ход операции: ультратонкий видеогастроскоп Olympus GIF N180 (Япония) заведен в пищевод. В нижней трети пищевода определяется циркулярный стенозирующий опухолевый рост. Проксимальный край опухолевого роста находится на расстоянии 38 см от резцов, дистальный в субкардиальном отделе — на 44 см. Просвет в области опухолевого роста составляет примерно 6—7 мм, проходим с трудом. Протяженность опухолевого стеноза достигает 7—8 см. В желудке натощак обнаружена старая кровь, умеренное количество пенистого прозрачного секрета.
План вмешательства: установка стента (Boston Scientific Ultraflex производства США, длиной 120 мм, диаметром 22 мм) в стенотическую стриктуру.
Через канал эндоскопа струна-проводник установлена в просвет желудка, аппарат удален. По проводнику доставляющее устройство с нитиноловым частично покрытым стентом с проксимальным раскрытием Boston Scientific Ultraflex (США) 120 мм установлено на уровне стриктуры. Под эндоскопическим и рентгенологическим контролем позиционирована проксимальная граница стента выше опухоли на 2 см. По рентгенографической картине — дистальный край в просвете тела желудка. Доставочное устройство удалено. На уровне стриктуры определяется сохранение талии стента, диаметр минимального раскрытия достигает 8 мм. Проксимальная граница стента находится на расстоянии 35 см от резцов, дистальная — в просвете верхней трети тела желудка.
Пациентка выписана на 3-и сутки после операции в удовлетворительном состоянии, явления дисфагии отсутствуют.
Комплексное использование возможностей современных методов лечения открывает перспективы для проведения полноценной симптоматической терапии инкурабельных больных с распространенным стенозирующим раком пищевода и кардии. Для лечения применяют различные варианты паллиативной помощи, при которых преследуют две основные задачи: уменьшение дисфагии и повышение качества жизни. Установка самораскрывающихся металлических стентов в настоящее время является альтернативой травматичному хирургическому паллиативному вмешательству и, несомненно, альтернативой гастростоме.
Стентирование зоны кардии имеет некоторые дополнительные особенности по сравнению со стентированием опухолевого стеноза проксимальных отделов пищевода и имеет более высокий риск осложнений. Отличительной особенностью стентирования зоны пищеводно-желудочного перехода является более высокий риск таких осложнений, как миграция стента и появление симптомов гастроэзофагеального рефлюкса.
Миграция стента происходит чаще из-за того, что его дистальный конец свободно выступающий в просвет желудка, не фиксирован к стенке. Согласно данным литературы, использование стентов большего диаметра (25—28 мм) может снизить риск миграции до 8—15% [4, 5]. Тем не менее стенты большего диаметра могут увеличить риск осложнений, включающих кровотечение, перфорацию и образование свищей [5—7].
С целью снижения риска миграции на сегодняшний день разработаны и используются стенты со специальными антимиграционными механизмами. Нити-S стент («Taewong Medical», Сеул, Южная Корея) имеет двойную плетеную стенку, внутренний слой из полиуретана для предотвращения врастания опухоли, внешний — непокрытая сетчатая нитиноловая манжета, которая врастает в стенку пищевода и уменьшает риск миграции.
Технология Shim состоит из модифицированного покрытого металлического стента с шелковой нитью, присоединенной к краю проксимального конца стента («Hanarostent»; «MI TechCo», Pyeongtaek, Южная Корея). После раскрытия стента нить крепится к носовой пазухе или мочке уха пациента. Стент имеет непокрытую проксимальную часть, которая дополнительно врезается в здоровую слизистую оболочку. При контрольной ЭГДС через 2 нед оценивается состояние проксимального края стента. Если при инсуффляции и аспирации воздуха из просвета пищевода конец стента фиксирован и не отделяется от стенки пищевода, то наружная внешняя фиксация снимается.
Фиксация проксимального края стента к слизистой оболочке пищевода при помощи клипс может быть эффективна в некоторых случаях, позволяя избежать миграции стента. H. Kato и соавт. [8] сообщили результаты исследования с участием 44 пациентов, что после фиксации верхнего конца стента к слизистой оболочке пищевода клипсами снизилось число случаев миграции полностью покрытых стентов с 34 до 13% [9].
Установка в зону пищеводно-желудочного перехода частично покрытых стентов также позволяет существенно сократить риск миграции по сравнению с полностью покрытыми стентами.
В литературе описано пилотное исследование успешной фиксации стента с помощью эндоскопического сшивающего аппарата Overstitch («Apollo Inc.», Техас, США). Это устройство позволяет пришить стент к пищеводу непрерывным швом различной длины или отдельными стежками [10].
Гастроэзофагеальный рефлюкс отмечается у большинства пациентов после стентирования зоны пищеводно-желудочного перехода. Из-за отсутствия естественного сфинктера эта проблема кажется неизбежной. Для стентирования зоны кардии специально разработаны стенты с антирефлюксным механизмом. На сегодняшний день накоплен большой опыт использования подобных стентов. В литературе описаны противоречивые данные по использованию стентов с антирефлюксным клапаном.
K. Dua и соавт. [11] описали отсутствие симптомов рефлюкса у пациентов с опухолью пищеводно-желудочного перехода после стентирования Z-стентом с антирефлюксным клапаном («Wilson COOK», США). Эти результаты были подтверждены в исследовании H-U Laasch и соавт. [12], в котором у 3 (12%) пациентов из 25 с установленным в зону кардии антирефлюксным Z-стентом был выраженный рефлюкс по сравнению с 24 (96%) пациентами из 25 исследованных после стентирования открытым стентом Фламинго (Wallstent, «Boston Scientific»; р<0,001). В другом исследовании 30 пациентов с опухолью в зоне пищеводно-желудочного перехода были рандомизированы на две группы: больным 1-й группы был установлен стент с антирефлюксным клапаном (FerX-Ella, «ELLA-CS, s.r.o.», HradecKralove, CzechRepublic; n=15); во 2-й — стандартный самораскрывающийся стент (SEMS) той же конструкции, но без клапана (n=15) [13]. Гастроэзофагеальный рефлюкс через 2 нед после операции оценивали по стандартной анкете-опроснику и по 24-часовому мониторингу рН в пищеводе. Симптомы гастроэзофагеального рефлюкса отмечали 25% пациентов с антирефлюксным стентом по сравнению с 14% пациентов с открытым стентом. Суточный мониторинг рН показал увеличение экспозиции кислоты в пищеводе у пациентов с антирефлюксным стентом.
Согласно данным Американской гастроэнтерологической ассоциации, регулярное использование SEMS с антирефлюксным клапаном для снижения желудочно-пищеводного рефлюкса после стентирования злокачественного стеноза в зоне пищеводно-желудочного перехода не может быть рекомендовано [14].
В нашем случае выбор частично покрытого стента без антирефлюксного клапана обоснован большим опытом стентирования этой зоны. В эндоскопическом отделении ГБУЗ ЯО «Областная клиническая онкологическая больница» на сегодняшний день имеется опыт эндоскопического стентирования пищевода (n=172) и конкретно зоны пищеводно-желудочного перехода (n=87). Явления дисфагии купированы во всех случаях, неполная миграция частично покрытого стента наблюдалась в одном случае, что потребовало повторного стентирования по типу «стент в стент». Явления гастроэзофагеального рефлюкса адекватно купируются приемом ингибиторов протонной помпы (20 мг 2 раза в день), не доставляя дискомфорта пациенту.
Паллиативное лечение рака пищеводно-желудочного перехода направлено на устранение дисфагии. Эта цель достигается путем установки стента, который обеспечивает хорошее качество жизни в короткий период времени. Миграция является наиболее частым осложнением после постановки стента в зону кардии, особенно при установке полностью покрытых стентов. Благодаря адекватному подбору длины и диаметра стента, внешней и внутренней его фиксации, это осложнение может быть предотвращено.
Установка стентов с антирефлюксным клапаном в зону пищеводно-желудочного перехода для предупреждения появления нежелательных симптомов гастроэзофагеального рефлюкса дискутабельна и, по мнению многих экспертов, нецелесообразна.
Источник

«Лучевая диагностика и лечение кардиоэзофагеального рака» Амирханова Ф. М. , 764 хирургия

Определение Кардиоэзофагеальный рак (КЭР) — это рак, локализующийся в области пищеводно-желудочного перехода. Высокозлокачественная опухоль с лимфогенным метастазированием в лимфоколлекторы брюшной полости и средостения. • 6 -е место по причине смерти от злокачественных новообразований • 9 -е место в общей смертности Факторы риска: Гастроэзофагеальный рефлюкс (ГЭРБ) Пищевод Барретта
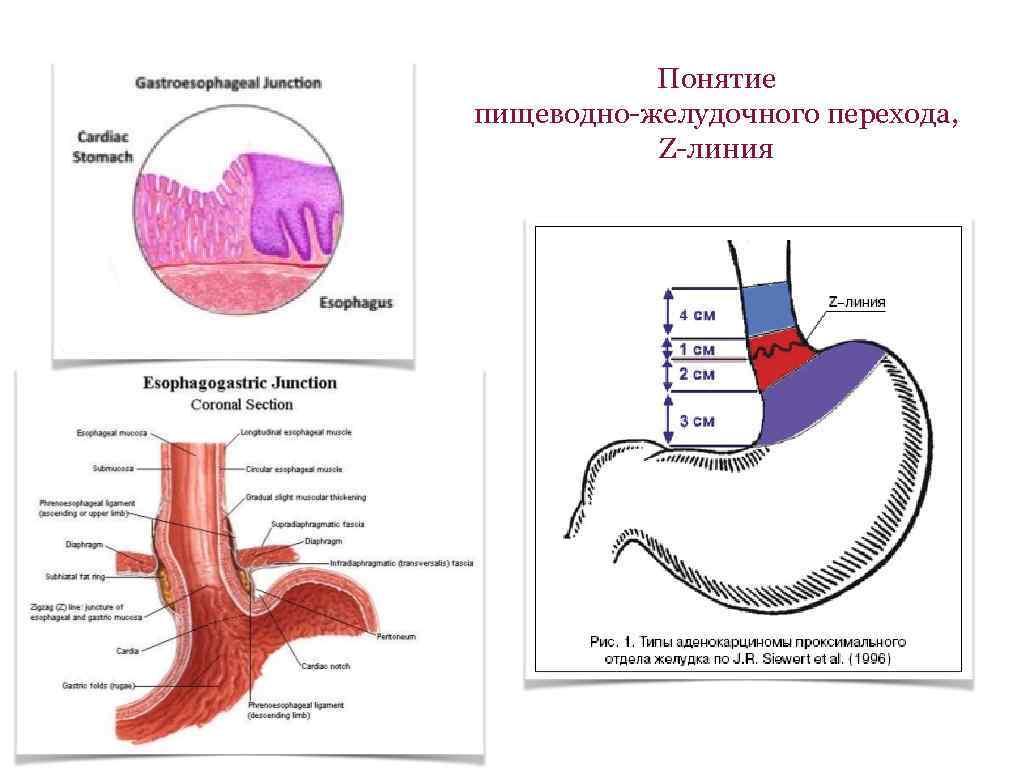
Понятие пищеводно-желудочного перехода, Z-линия
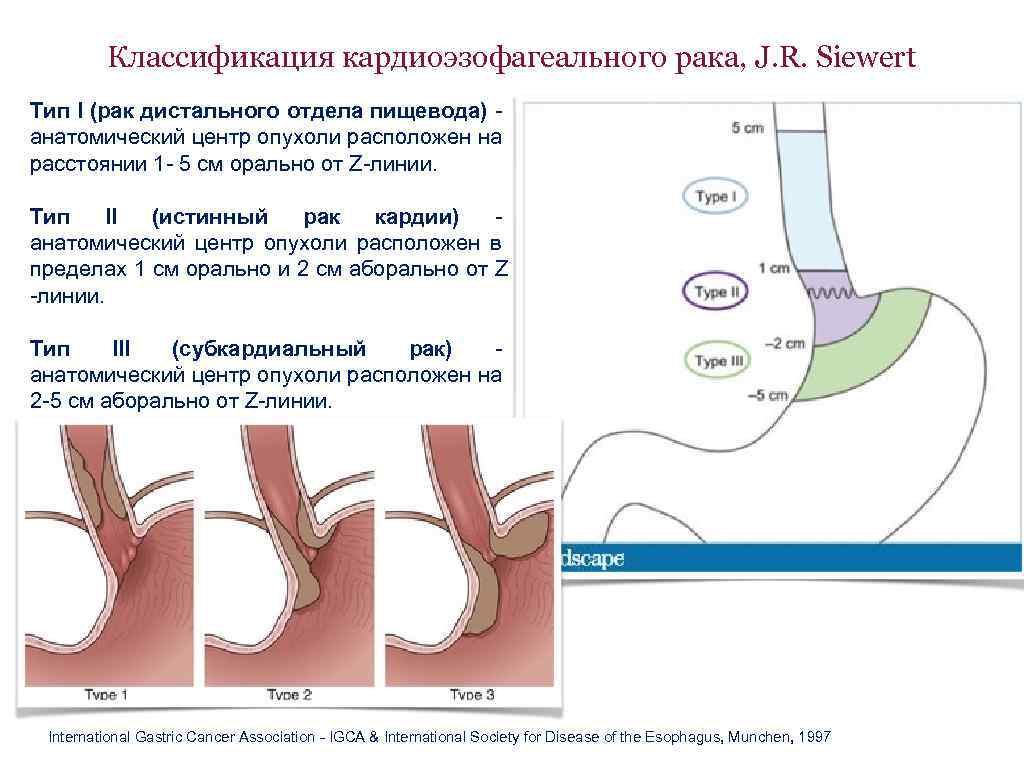
Классификация кардиоэзофагеального рака, J. R. Siewert Тип I (рак дистального отдела пищевода) анатомический центр опухоли расположен на расстоянии 1 — 5 см орально от Z-линии. Тип II (истинный рак кардии) анатомический центр опухоли расположен в пределах 1 см орально и 2 см аборально от Z -линии. Тип III (субкардиальный рак) анатомический центр опухоли расположен на 2 -5 см аборально от Z-линии. International Gastric Cancer Association — IGCA & International Society for Disease of the Esophagus, Munchen, 1997
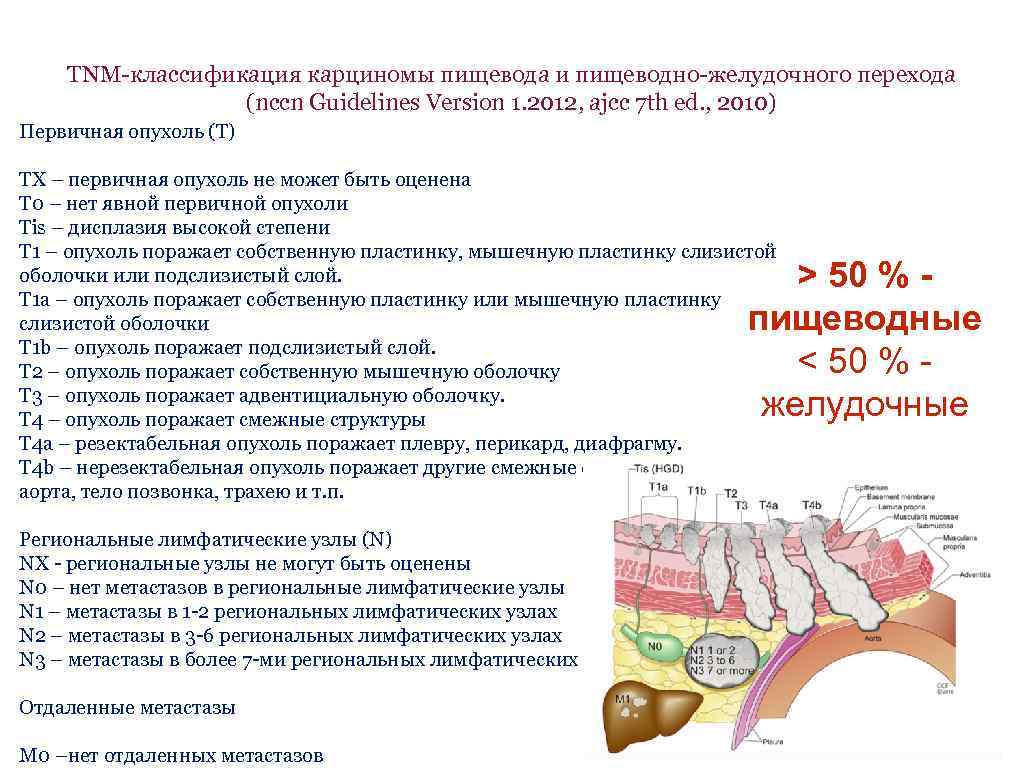
TNM-классификация карциномы пищевода и пищеводно-желудочного перехода (nccn Guidelines Version 1. 2012, ajcc 7 th ed. , 2010) Первичная опухоль (Т) ТХ – первичная опухоль не может быть оценена Т 0 – нет явной первичной опухоли Тis – дисплазия высокой степени T 1 – опухоль поражает собственную пластинку, мышечную пластинку слизистой оболочки или подслизистый слой. T 1 a – опухоль поражает собственную пластинку или мышечную пластинку слизистой оболочки T 1 b – опухоль поражает подслизистый слой. Т 2 – опухоль поражает собственную мышечную оболочку Т 3 – опухоль поражает адвентициальную оболочку. Т 4 – опухоль поражает смежные структуры Т 4 а – резектабельная опухоль поражает плевру, перикард, диафрагму. Т 4 b – нерезектабельная опухоль поражает другие смежные структуры, такие как аорта, тело позвонка, трахею и т. п. > 50 % пищеводные

Морфологические характеристики Cancer of the Esophagus and Esophagogastric Junction: An Eighth Edition Staging Primer. Thomas W. Rice, MD, a, * Hemant Ishwaran, Ph. D, b Mark K. Ferguson, MD, c Eugene H. Blackstone, MD, a Peter Goldstraw, MDd. Journal of Thoracic Oncology, 2017, Vol. 12 No. 1: 36 -42
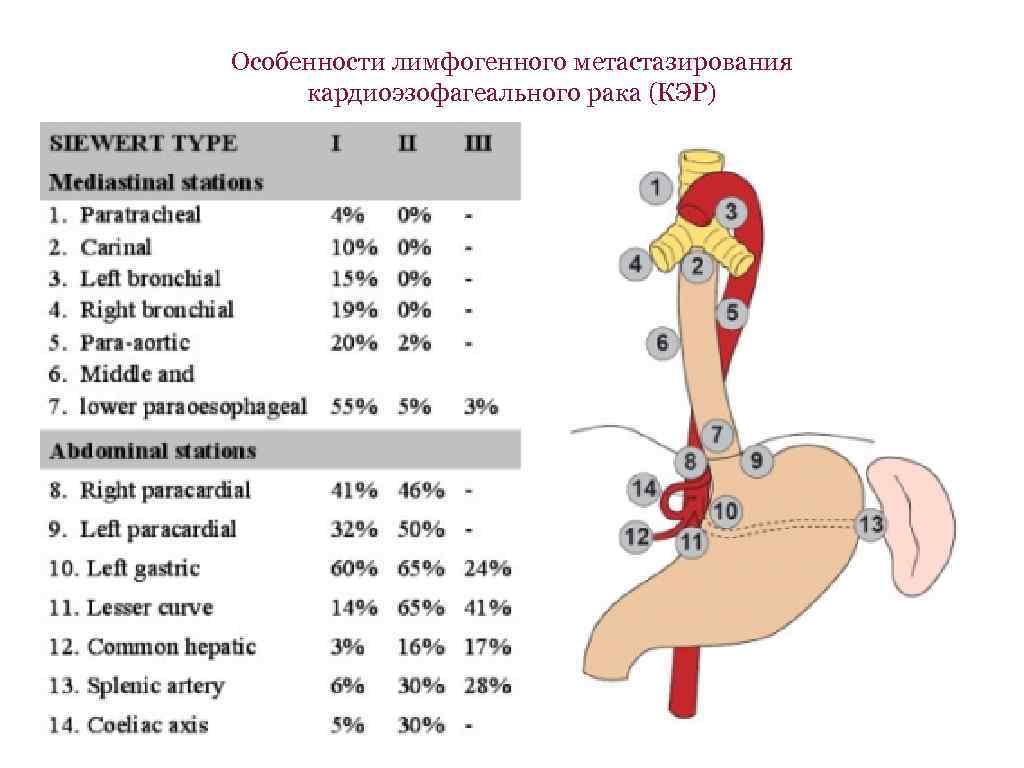
Особенности лимфогенного метастазирования кардиоэзофагеального рака (КЭР)
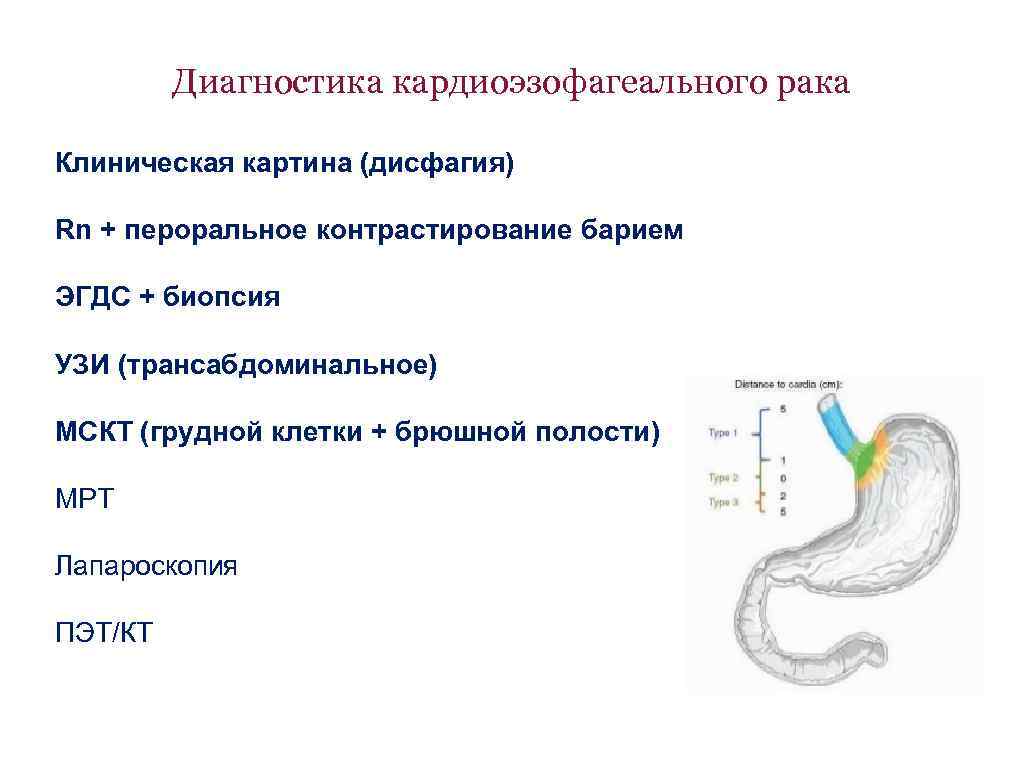
Диагностика кардиоэзофагеального рака Клиническая картина (дисфагия) Rn + пероральное контрастирование барием ЭГДС + биопсия УЗИ (трансабдоминальное) МСКТ (грудной клетки + брюшной полости) МРТ Лапароскопия ПЭТ/КТ
Кардиоэзофагеальный рак
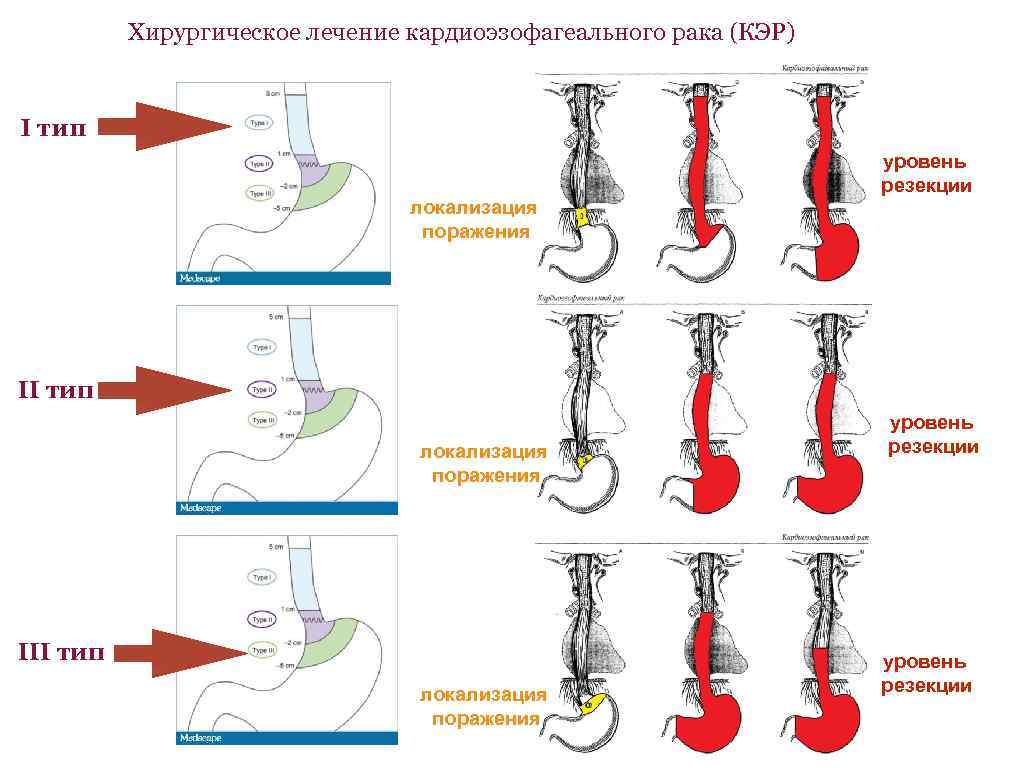
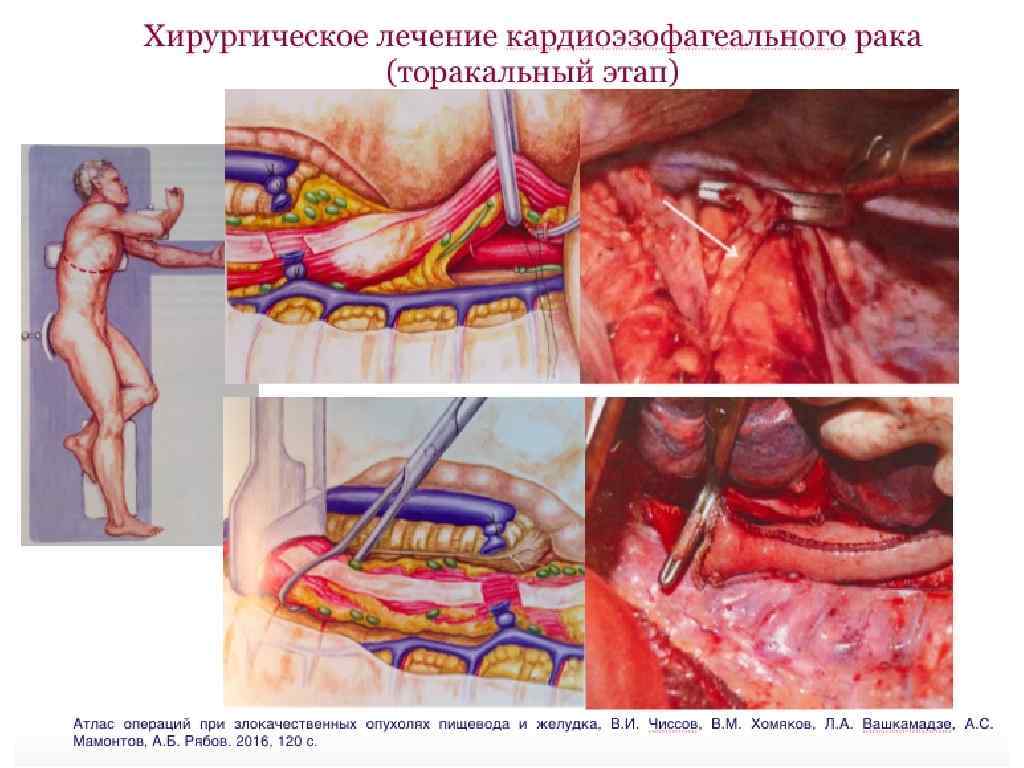
Хирургическое лечение кардиоэзофагеального рака (КЭР) I тип локализация поражения уровень резекции II тип локализация поражения III тип локализация поражения уровень резекции
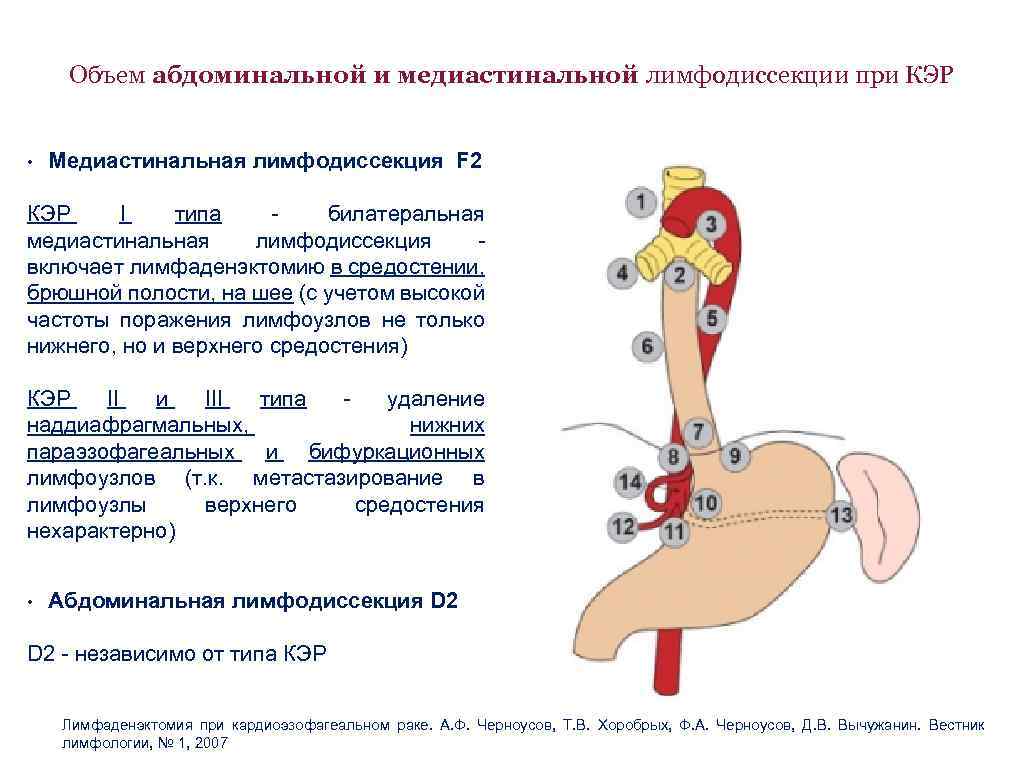
Объем абдоминальной и медиастинальной лимфодиссекции при КЭР • Медиастинальная лимфодиссекция F 2 КЭР I типа билатеральная медиастинальная лимфодиссекция включает лимфаденэктомию в средостении, брюшной полости, на шее (с учетом высокой частоты поражения лимфоузлов не только нижнего, но и верхнего средостения) КЭР II и III типа удаление наддиафрагмальных, нижних параэзофагеальных и бифуркационных лимфоузлов (т. к. метастазирование в лимфоузлы верхнего средостения нехарактерно) • Абдоминальная лимфодиссекция D 2 — независимо от типа КЭР Лимфаденэктомия при кардиоэзофагеальном раке. А. Ф. Черноусов, Т. В. Хоробрых, Ф. А. Черноусов, Д. В. Вычужанин. Вестник лимфологии, № 1, 2007
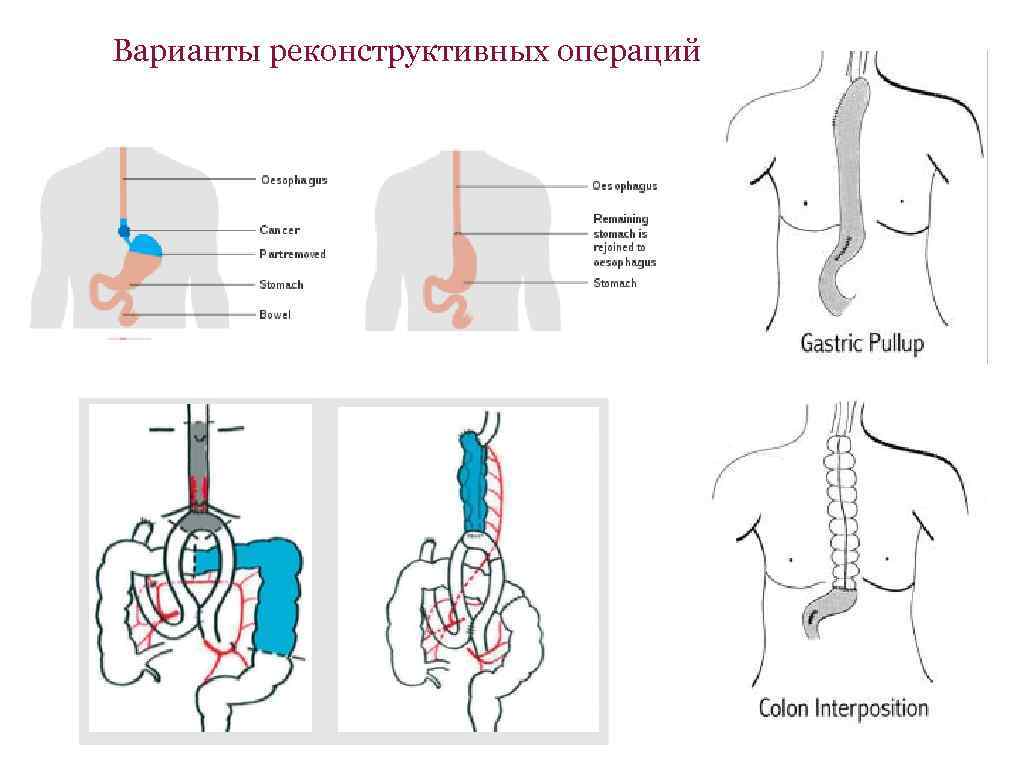
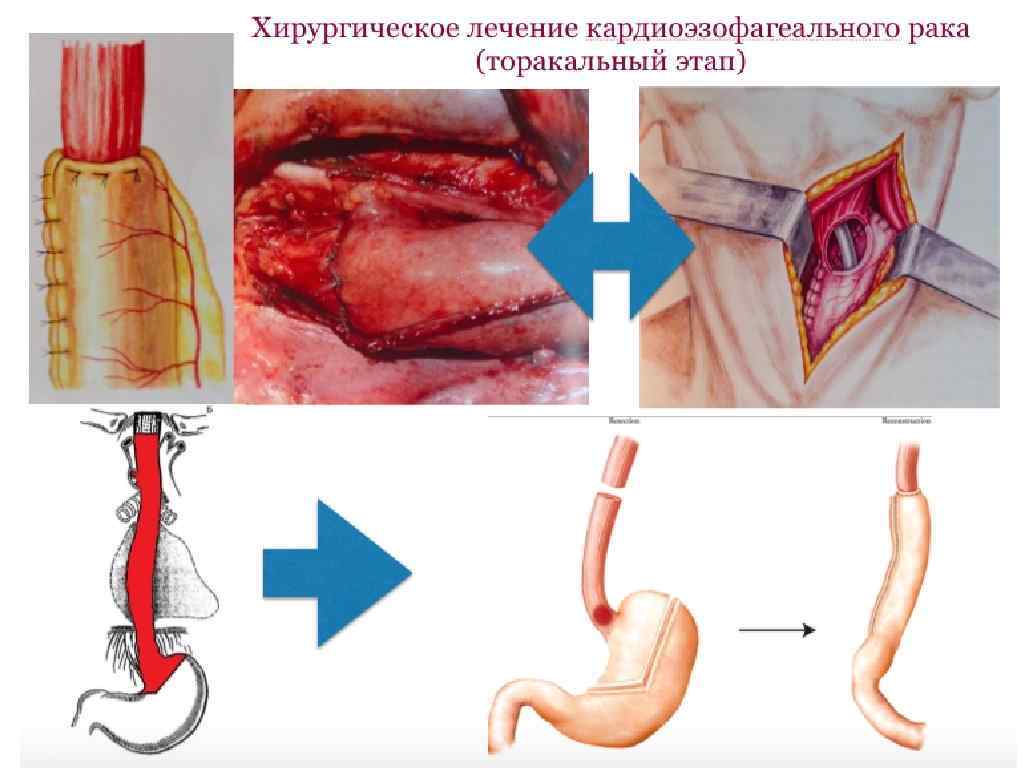
Варианты реконструктивных операций
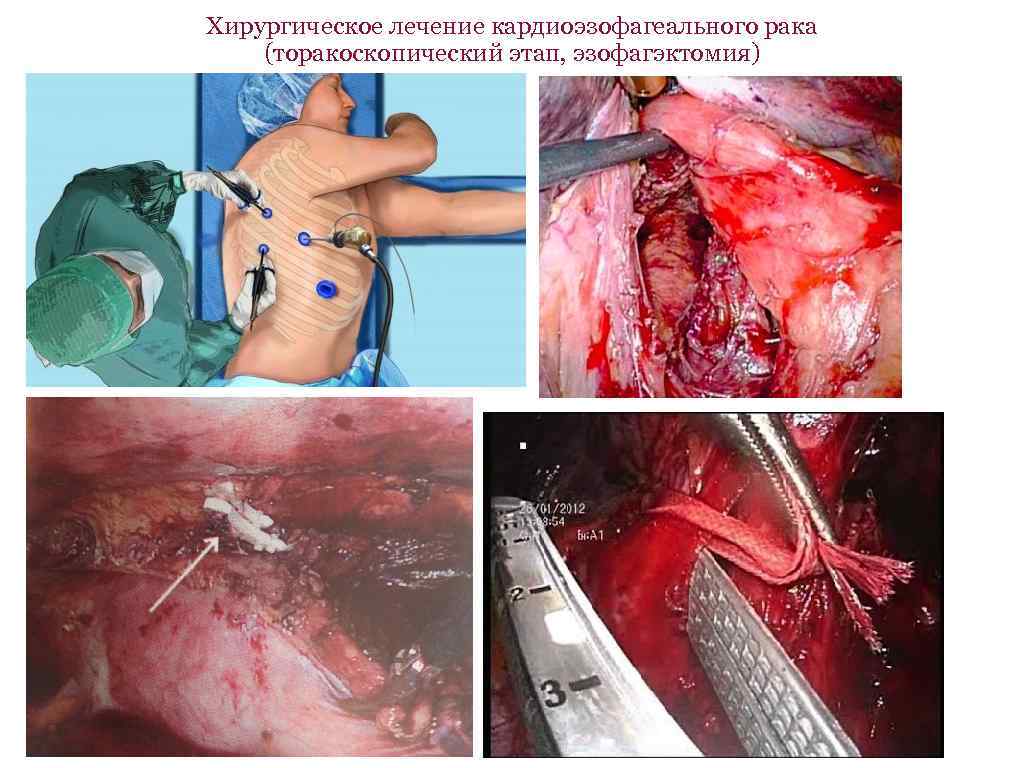
Хирургическое лечение кардиоэзофагеального рака (торакоскопический этап, эзофагэктомия)
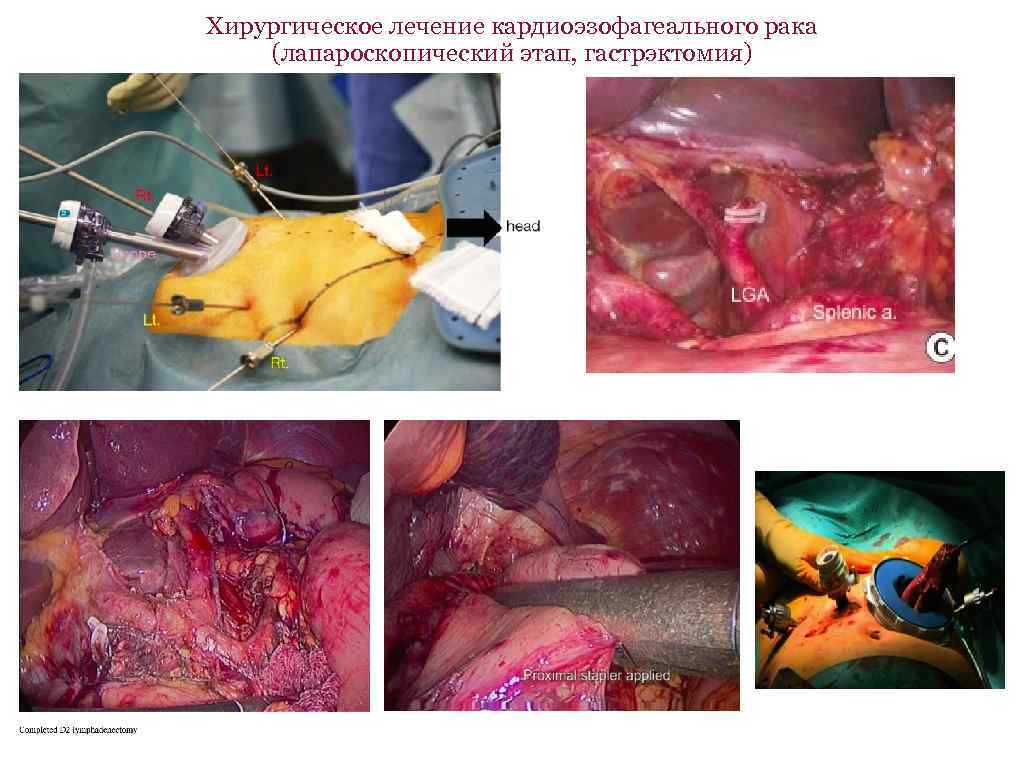
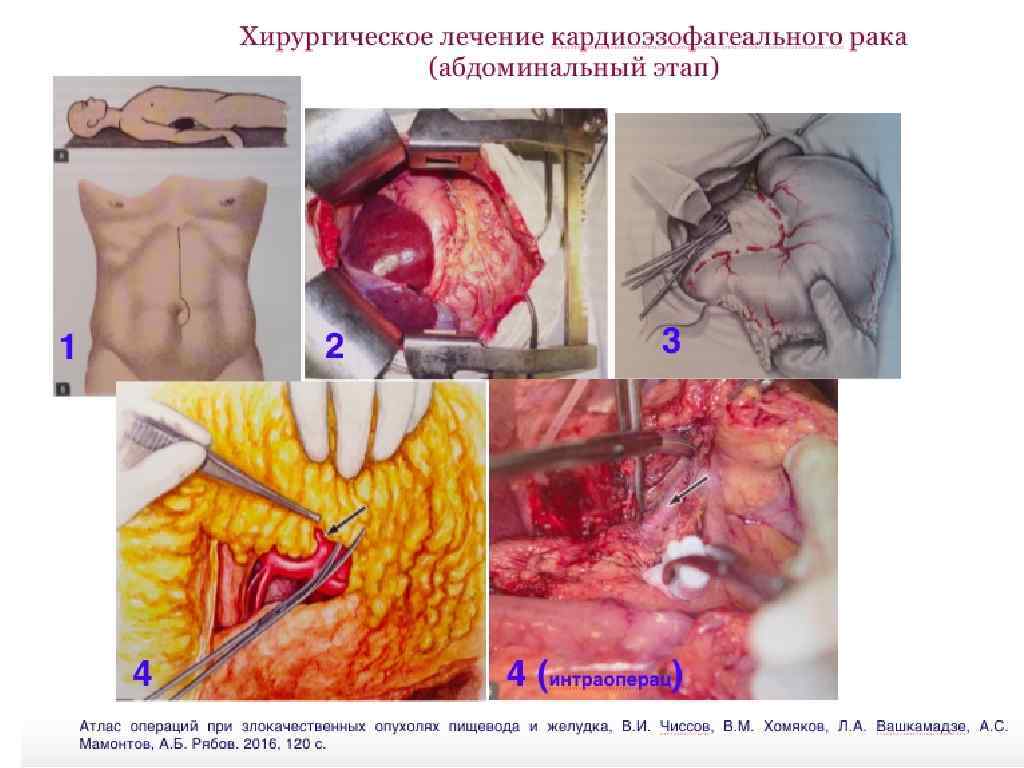
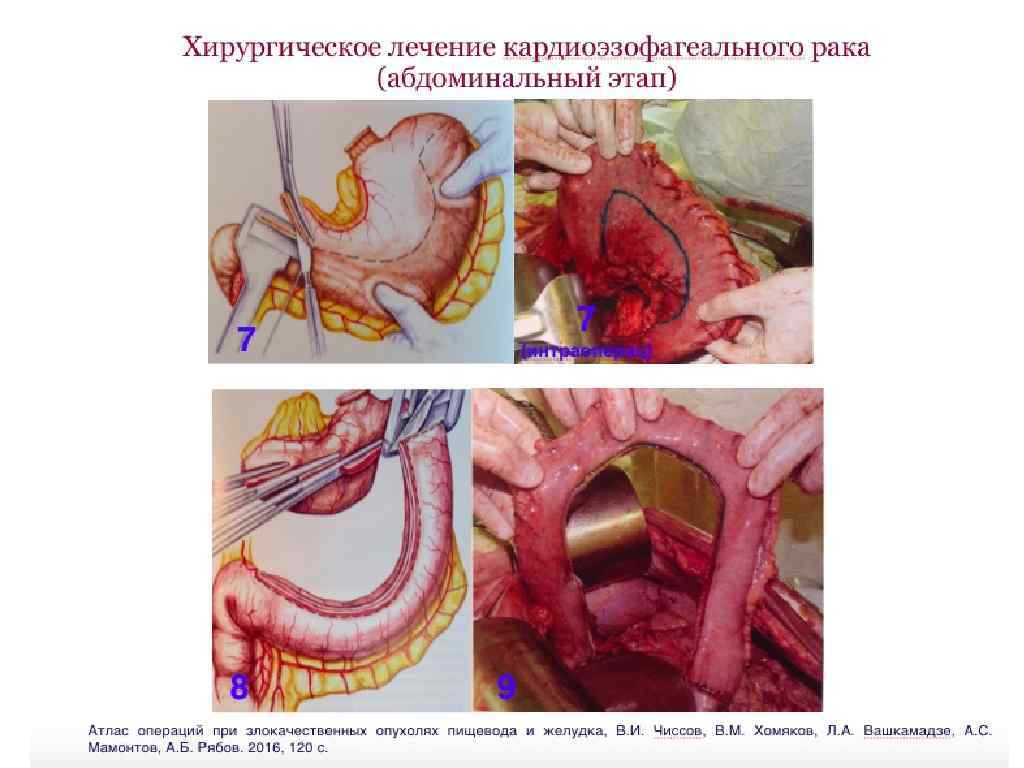
Хирургическое лечение кардиоэзофагеального рака (лапароскопический этап, гастрэктомия)
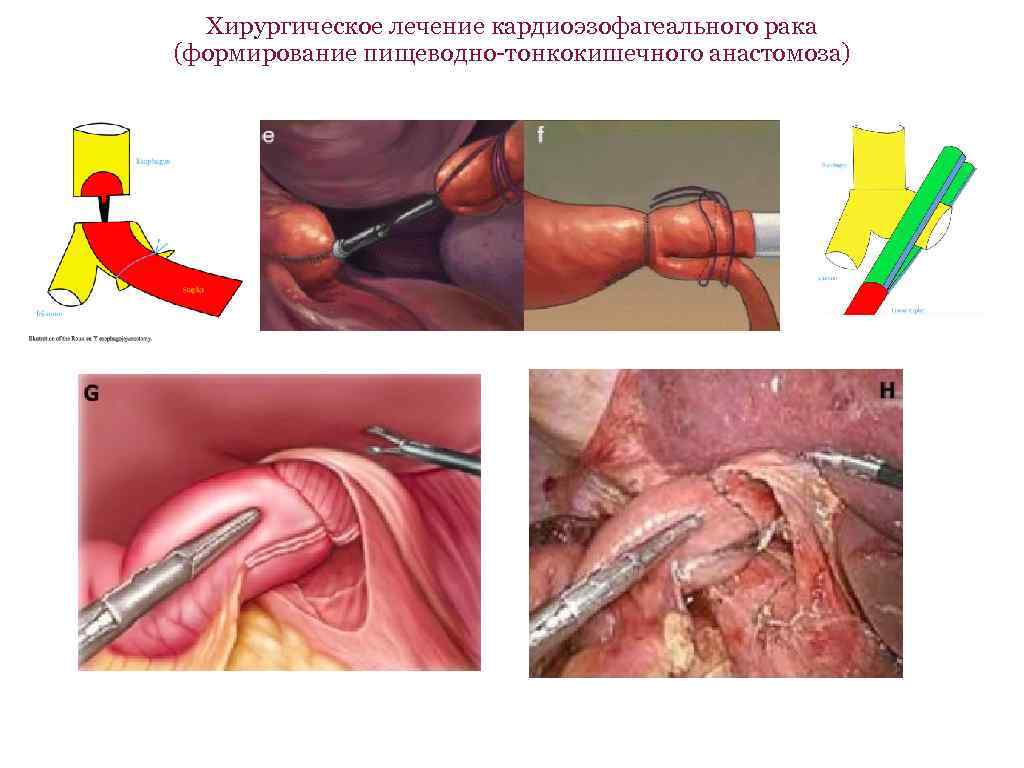
Хирургическое лечение кардиоэзофагеального рака (формирование пищеводно-тонкокишечного анастомоза)
Робот-ассистированная хирургия (Da Vinci)

FAST TRACK • экстубация в операционной или в первые часы после операции • на фоне эпидурального обезболивания местными анестетиками проведение активизации больного с 1 -х суток • интенсивное выполнение дыхательной гимнастики с первых часов после операции • начало кормления через еюностому • кормление через рот на 4 -5 несостоятельности анастомоза) сутки (после Rn подтверждения отсутствия
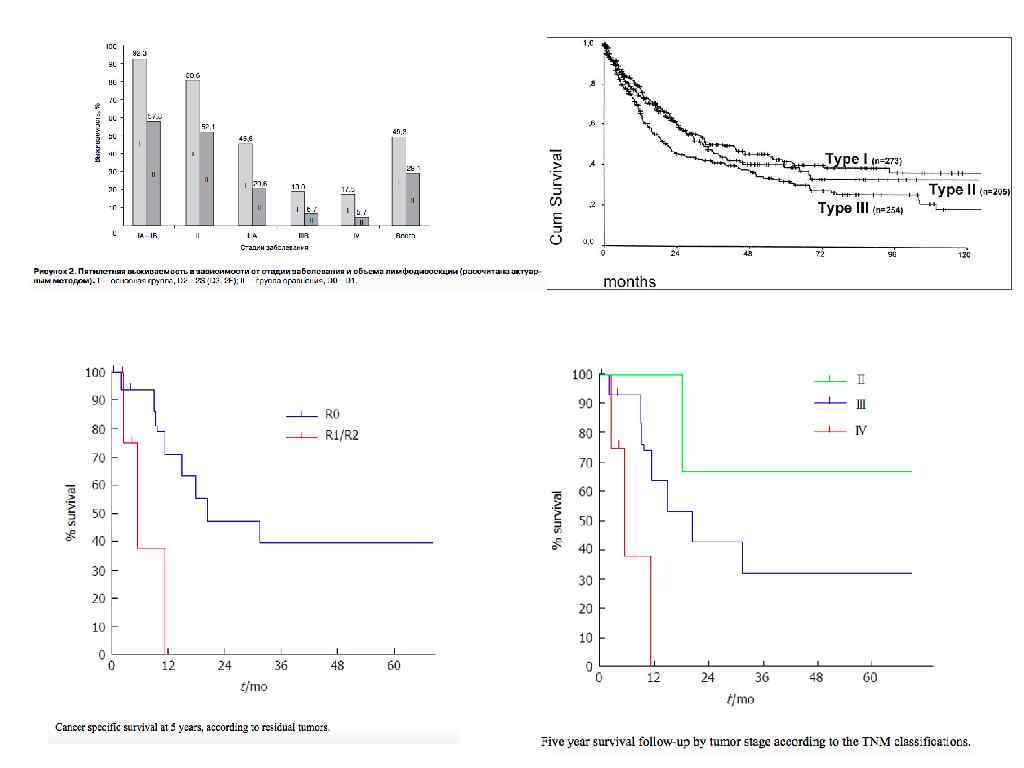
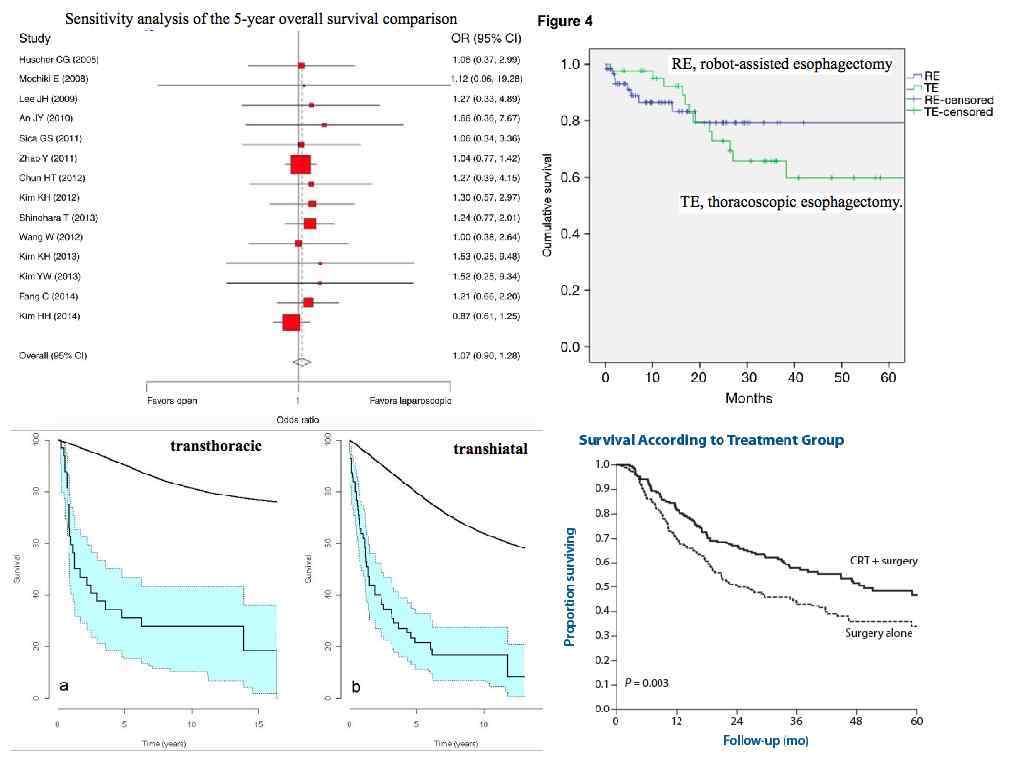

Спасибо за внимание
Источник
30.05.2016, 19:37 | |||
| |||
Здравствуйте! Продолжение. |
Источник

