Эозинофильное воспаление при хобл

Современные представления о хронической обструктивной болезни легких (ХОБЛ) характеризуются многообразием клинико-функциональных особенностей заболевания и гетерогенностью воспалительного ответа. Воспаление является одним из ключевых патофизиологических механизмов ХОБЛ и, соответственно, важной мишенью для фармакологического воздействия. Эозинофильный вариант воспаления при ХОБЛ ассоциируется с частыми обострениями и высокими темпами прогрессирования заболевания. Исследования последних лет свидетельствуют о существенном влиянии эозинофильного воспаления не только на особенности течения и прогноз больных ХОБЛ, но и на терапевтический ответ. Эозинофильный фенотип ХОБЛ служит предиктором эффективности ингаляционных глюкокортикостероидов, что следует учитывать при выборе фармакотерапии данной патологии.
Введение
Современные представления о хронической обструктивной болезни легких (ХОБЛ) свидетельствуют о сложном по своей патофизиологии и морфологии заболевании, для которого характерны многообразные клинико-функциональные проявления и гетерогенный воспалительный ответ. Длительное время ключевой клеткой воспаления дыхательных путей при ХОБЛ считался нейтрофил, тогда как эозинофильное воспаление рассматривалось в качестве типичной цитологической характеристики бронхиальной астмы – БА [1, 2]. Вместе с тем накоплены многочисленные данные, свидетельствующие о гетерогенности воспалительного ответа у больных ХОБЛ как в стабильном состоянии [3, 4], так и при обострении заболевания [5, 6]. В частности, результаты исследований последних лет демонстрируют эозинофильное воспаление дыхательных путей у значительной части больных ХОБЛ при исключении сопутствующей БА [7, 8].
Растущее число исследований, посвященных многообразию клинических форм ХОБЛ, свидетельствует о существенном влиянии эозинофильного воспаления не только на особенности течения и прогноз больных ХОБЛ, но и на различия терапевтической эффективности ингаляционных глюкокортикостероидов (ИГКС), что подтверждает фенотипическую гетерогенность заболевания.
Эозинофилия крови как косвенный маркер эозинофильного воспаления дыхательных путей при ХОБЛ
При оценке воспалительного ответа при ХОБЛ и БА предпочтение отдается исследованию цитологической характеристики содержимого дыхательных путей. Эозинофильный вариант ХОБЛ определяется при наличии ≥3% эозинофилов в цитологии индуцированной мокроты [3]. Эозинофилия мокроты, по данным ряда исследователей, встречается у трети (34–38%) больных ХОБЛ в стабильном состоянии [3, 4]. Следует отметить, что цитологический анализ индуцированной мокроты является методически сложной и трудоемкой задачей для большинства клинических лабораторий и во многих случаях малодоступен в реальной клинической практике.
В связи со сказанным привлекают внимание результаты исследований, показывающие, что содержание эозинофилов в мокроте коррелирует с уровнем эозинофилии крови [6, 9]. Механизм взаимосвязи уровня эозинофилов в периферической крови и выраженности воспалительного процесса в дыхательных путях при ХОБЛ изучен недостаточно. Вместе с тем продемонстрированы существенные различия уровня эозинофилии крови больных ХОБЛ с таковой мокроты и без нее, что подтверждается корреляционным анализом (r=0,535; p

Кроме того, выраженность эозинофильного воспаления в бронхах, в частности в подслизистой оболочке дыхательных путей у больных ХОБЛ при исключении БА, также коррелирует с показателем эозинофилии периферической крови (r=0,57; р=0,009) [10]. Аналогичные данные, подтверждающие взаимосвязь уровней эозинофилии крови и мокроты, получены и у больных БА [11–13], что позволяет рассматривать эозинофилию крови в качестве универсального маркера эозинофильного воспаления дыхательных путей. Необходимо отметить, что анализ крови в отличие от исследования индуцированной мокроты широко доступен, легко выполним и может проводиться всем больным, поэтому число эозинофилов крови в качестве биомаркера заслуживает самого пристального внимания для фенотипической характеристики воспаления при ХОБЛ.
Изучение клинических особенностей эозинофильного фенотипа ХОБЛ позволило выявить существенные различия частоты обострений у больных ХОБЛ в зависимости от уровня эозинофилии периферической крови [14, 15]. При этом подчеркивается, что эозинофилия крови является независимым фактором риска обострений заболевания. Ретроспективный анализ некоторых исследований свидетельствует о закономерном увеличении вероятности обострений ХОБЛ по мере нарастания числа эозинофилов периферической крови. Так, у больных ХОБЛ с эозинофилией крови
В современных научных публикациях по ХОБЛ отсутствуют строго согласованные количественные критерии эозинофильного воспаления с учетом выраженности эозинофилии периферической крови. Однако большинство исследователей определяют эозинофильный вариант воспаления при уровне эозинофилии ≥2%, или 200 и более клеток/мкл, периферической крови [3, 14, 16]. Проект федеральных клинических рекомендаций по ХОБЛ, представленный на сайте Российского респираторного общества [17], предлагает использовать в качестве критерия эозинофильного воспаления вне обострения заболевания уровень эозинофилии крови >300 клеток/мкл.
Доля больных ХОБЛ с эозинофилией периферической крови ≥2%, по данным литературы, существенно варьирует: от 32 до 75% [7, 14, 16]. Представленный разброс по числу больных в зависимости от уровня эозинофилии крови (рис. 1), вероятнее всего, можно объяснить различающимися критериями включения/исключения и возможным участием в некоторых из представленных исследований больных ХОБЛ в сочетании с БА. Вместе с тем в клинических исследованиях, критерии включения/исключения которых были прицельно ориентированы на изолированную ХОБЛ без возможной БА, хотя и наблюдалось меньшее число больных с эозинофилией, тем не менее и у них частота уровня эозинофилов в крови >2% была достаточно высокой, составив 27–37% [7, 8].
Большое клиническое значение для фенотипической характеристики того или иного заболевания имеет оценка воспроизводимости или стабильности оцениваемого биомаркера. N. Negewo и соавт. показали, что повторный анализ уровня эозинофилии крови больных ХОБЛ с интервалом 1 месяц в среднем характеризовался высоким внутриклассовым коэффициентом корреляции – 0,8 (95% доверительный интервал [ДИ] – 0,66–0,88; р200 клеток/мкл) в периферической крови в качестве обоснованного предиктора эозинофилии дыхательных путей и, соответственно, широко доступного в клинической практике диагностического биомаркера эозинофильного фенотипа ХОБЛ.
Характеризуя клинические особенности эозинофильного фенотипа ХОБЛ, следует иметь в виду неблагоприятное модифицирующее влияние эозинофильного воспаления на эволюцию заболевания. В частности, при эозинофильном фенотипе ХОБЛ увеличивается частота обострений [15, 18] и темпы прогрессирования заболевания [16], что приводит к неблагоприятному прогнозу и повышенной летальности по сравнению с пациентами без увеличенного уровня эозинофилов в крови и/или мокроте. Было показано, что эозинофилия крови >275 клеток/мкл ассоциируется с увеличением риска смерти в 4,8 раза среди больных ХОБЛ с анамнезом обострений заболевания [19]. Кроме того, анализ показателей летальности продемонстрировал, что указанный уровень эозинофилии крови в общей популяции на протяжении 30-летнего периода наблюдения был связан с увеличением общей смертности на 40% [20].
К настоящему времени накоплены убедительные данные о том, что выделение эозинофильного фенотипа ХОБЛ имеет большое значение не только в связи с клиническими особенностями и прогнозом заболевания, но и с точки зрения его дифференцированной терапии. В частности, эффективность и безопасность ИГКС для больных ХОБЛ существенно ассоциированы с выраженностью эозинофильного воспаления.
Эозинофилия при ХОБЛ как предиктор эффективности терапии ИГКС
Хорошо известно, что воспаление дыхательных путей является одним из ключевых патофизиологических механизмов ХОБЛ и, соответственно, важной мишенью для фармакологического воздействия. В связи с этим до недавнего времени добавление ИГКС к длительно действующим бронходилататорам рассматривалось в качестве обязательного шага терапевтического алгоритма для больных тяжелой и крайне тяжелой ХОБЛ [21]. В последние годы целесообразность назначения ИГКС в терапии ХОБЛ подвергается существенному пересмотру, поскольку влияние этой группы препаратов на легочное и системное воспаление неоднозначно [22]. Кроме того, в ряде исследований был обнаружен повышенный риск развития пневмонии и туберкулеза легких на фоне применения этого класса препаратов у больных с ХОБЛ [23,24]. Все вышеизложенное послужило предпосылкой для поиска новых терапевтических мишеней и анализа соотношения польза/риск для ИГКС при различных фенотипах ХОБЛ, в т.ч. его эозинофильном варианте.
Анализ данных двух рандомизированных исследований, в которых оценивались комбинированная терапия флутиказоном фуроатом и вилантеролом, а также монотерапия вилантеролом, свидетельствует о значительных различиях частоты обострений ХОБЛ, зависимых от исходного уровня эозинофилии крови в сравниваемых группах. При комбинированной терапии по сравнению с группой монотерапии вилантеролом частота обострений ХОБЛ в год у пациентов с уровнем эозинофилов в крови ≥2% снижалась на 29% (р
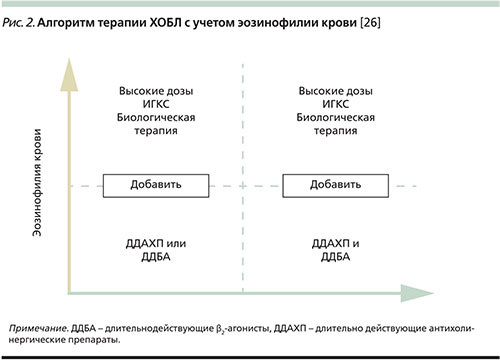
Полученные данные позволяют рассматривать уровень эозинофилов крови не только в качестве биомаркера более частых обострений ХОБЛ и предиктора их снижения на фоне терапии ИГКС, но и как индикатор, позволяющий прогнозировать высокую вероятность развития обострений ХОБЛ при отмене ИГКС. Результаты проведенных исследований еще раз подтверждают вывод, согласно которому исследование уровня эозинофилов периферической крови позволяет не только персонализировать терапию ХОБЛ, но и оптимизировать ее эффективность (рис. 2) [26]. Аналогичные алгоритмы терапии ХОБЛ, учитывающие уровень эозинофилии крови, в самое последнее время представлены и другими авторами [27, 28].
Анализируя взаимосвязь эозинофилии и обострений ХОБЛ, следует отметить, что повышенный уровень эозинофилов в периферической крови не только ассоциируется с более частыми обострениями, но и является предиктором их тяжести [29]. Так, у пациентов с эозинофилией крови ≥200 клеток/мкл и/или ≥2% риска повторных госпитализаций в течение 12 месяцев по поводу тяжелого обострения ХОБЛ или любых других состояний, требующих стационарного лечения, был значительно выше по сравнению с больными, у которых регистрировалось меньшее число эозинофилов для тяжелых обострений ХОБЛ и для госпитализаций по другим причинам (отношение шансов [ОШ]=3,59 [1,65–7,82]; p=0,0013) и (ОШ=2,32 [1,10–4,92]; p=0,0277) [29].
Эозинофильный фенотип ХОБЛ ассоциируется не только с повышением частоты обострений и их тяжести, но и с более быстрыми темпами снижения легочной функции. Это показал ретроспективный анализ эффективности ИГКС в исследовании ISOLDE: у больных ХОБЛ были выявлены существенные различия ежегодного снижения ОФВ1 в зависимости от исходного числа эозинофилов крови (рис. 3) [16]. У больных ХОБЛ с эозинофилией крови менее 2% терапия флутиказоном пропионатом по сравнению с группой плацебо не сопровождалась различиями показателей скорости снижения ОФВ1 – 54,2 и 51,3 мл/год соответственно (р=0,688), тогда как у пациентов с числом эозинофилов в крови ≥2% темпы падения легочной функции были существенно ниже в группе флутиказона пропионата, составив 33,9 мл/год по сравнению с показателем группы плацебо 74,5 мл/год (р=0,003).
Таким образом, анализ результатов приведенного исследования убедительно подтверждает мнение, cогласно которому для эозинофильного фенотипа ХОБЛ характерно более быстрое нарастание бронхиальной обструкции, тогда как терапия ИГКС позволяет значительно замедлять скорость прогрессирования заболевания при данном фенотипе болезни.

Также не менее важными представляются вопросы безопасности длительного применения ИГКС больными ХОБЛ в зависимости от уровня эозинофилии периферической крови. Проведенный мета-анализ 10 рандомизированных клинических исследований с участием 10 861 пациента, основной целью которого стало определение различий в отношении риска развития пневмонии у больных ХОБЛ с низким (
Более низкая частота пневмоний у пациентов с эозинофильным фенотипом ХОБЛ рассматривается специалистами с позиций активного участия эозинофилов в иммунно-воспалительных реакциях, опосредованных Тh-2-клетками, а также противоинфекционной активности эозинофильных гранулоцитов [30]. Соответственно, уменьшение числа эозинофилов может говорить о повышенной восприимчивости к инфекции или быть следствием недавно перенесенной инфекции. Кроме того, у пациентов с ХОБЛ и уровнем эозинофилов крови
Таким образом, эозинофильный фенотип ХОБЛ наряду с отмеченными выше клинико-функциональными особенностями заболевания характеризуется и клинически значимыми особенностями ответа на терапию ИГКС, уменьшающими в этой группе больных частоту обострений и снижающими темп прогрессирования бронхиальной обструкции.
Заключение
Приводимые в настоящем обзоре материалы свидетельствуют о существенном вкладе эозинофильного воспаления в клинические проявления ХОБЛ, включая и особенности терапевтического ответа, что позволяет рассматривать эозинофилию при ХОБЛ в качестве самостоятельной фенотипической характеристики заболевания.
Эозинофильный фенотип ХОБЛ, диагностируемый по уровню эозинофилии мокроты и/или крови, достаточно широко распространен и определяется примерно у трети больных. Эозинофильное воспаление в значительной степени модифицирует течение ХОБЛ, влияя на частоту обострений и темп прогрессирования обструктивных нарушений, что в конечном счете обусловливает и более высокую смертность в этой группе больных. Вместе с тем использование ИГКС в терапии эозинофильного фенотипа оказывает существенное влияние на эволюцию ХОБЛ, снижая частоту обострений и замедляя скорость прогрессирования заболевания.
Таким образом, выделение в клинической практике эозинофильного фенотипа ХОБЛ играет важную роль, поскольку не только детализирует клинические особенности заболевания, но и обосновывает целесообразность назначения ИГКС (в комбинации с ДДБА), что повышает эффективность лечения в данной группе больных.
1. Barnes P.J. The cytokine network in asthma and chronic obstructive pulmonary disease. J. Clin. Invest. 2008;118(11):3546–56.
2. Barnes P.J. Mechanisms in COPD: differences from asthma. Chest. 2000;117(Suppl. 2):10–4.
3. McDonald V.M., Higgins I., Wood L.G., Gibson P.G. Multidimensional assessment and tailored interventions for COPD: respiratory utopia or common sense? Thorax. 2013;68(7):691–94.
4. Leigh R., Pizzichini M.M., Morris M.M., Maltais F., Hargreave F.E., Pizzichini E. Stable COPD: predicting benefit from high-dose inhaled corticosteroid treatment. Eur. Respir. J. 2006;27(5):964–71.
5. Bafadhel M., Greening N.J., Harvey-Dunstan T.C., Williams J.E., Morgan M.D., Brightling C.E., Hussain S.F., Pavord I.D., Singh S.J., Steiner M.C. Blood Eosinophils and Outcomes in Severe Hospitalized Exacerbations of COPD. Chest. 2016;150(2):320–28.
6. Bafadhel M., McKenna S., Terry S., Mistry V., Reid C., Haldar P., McCormick M., Haldar K., Kebadze T., Duvoix A., Lindblad K., Patel H., Rugman P., Dodson P., Jenkins M., Saunders M., Newbold P., Green R.H., Venge P., Lomas D.A., Barer M.R., Johnston S.L., Pavord I.D., Brightling C.E. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am. J. Respir. Crit. Care Med. 2011;184:662–71.
7. Singh D., Kolsum U., Brightling C.E., Locantore N., Agusti A., Tal-Singer R. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur. Respir. J. 2014;44:1697–700.
8. Cosio B.G., Soriano J.B., Lopez-Campos J.L., Calle-Rubio M., Soler-Cataluna J.J., de-Torres J.P. Defining the asthma – COPD overlap syndrome in a COPD cohort. Chest. 2015;307(8):980251.7
9. Negewo N.A., McDonald V.M., Baines K.J., Wark P.A., Simpson J.L., Jones P.W., Gibson P.G. Peripheral blood eosinophils: a surrogate marker for airway eosinophilia in stable COPD. Int. J. COPD. 2016;11:1495–504.
10. Eltboli O., Mistry V., Barker B., Brightling C.E. Relationship between blood and bronchial submucosal eosinophilia and reticular basement membrane thickening in chronic obstructive pulmonary disease. Respirology. 2015;20(4):667–70.
11. Westerhof G.A., Korevaar D.A., Amelink M., de Nijs S.B., de Groot J.C., Wang J., Weersink E.J., en Brinke A., Bossuyt P.M., Bel E.H. Biomarkers to identify sputum eosinophilia in different adult asthma phenotypes. Eur. Respir. J. 2015;46(3):688–96.
12. Zhang X.Y., Simpson J.L., Powell H., Zhang X.Y., Simpson J.L., Powell H., Yang I.A., Upham J.W., Reynolds P.N., Hodge S., James A.L., Jenkins C., Peters M.J., Lin J.T., Gibson P.G. Full blood count parameters for the detection of asthma inflammatory phenotypes. Clin. Exp. Allergy 2014;44(9):1137–45.
13. Fowler S.J., Tavernier G., Niven R. High blood eosinophil counts predict sputum eosinophilia in patients with severe asthma. J. Allergy Clin. Immunol. 2015;135(3):822–24.
14. Pavord I.D., Lettis S., Locantore N., Pascoe S., Jones P.W., Wedzicha J.A., Barnes N.C. Blood eosinophils and inhaled corticosteroid/long-acting β-2 agonist efficacy in COPD. Thorax. 2016;71:118–25.
15. Pascoe S., Locantore N., Dransfield M.T., Barnes N.C., Pavord I.D. Blood eosinophil counts, exacerbations, and response to the addition of inhaled fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease: a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir. Med. 2015;3:435–42.
16. Barnes N.C., Sharma R., Lettis S., Calverley P.M. Blood eosinophils as a marker of response to inhaled corticosteroids in COPD. Eur. Respir. J. 2016;47(5):1374–82.
17. Хроническая обструктивная болезнь легких. Клинические рекомендации. 2016. URL: https://spulmo.ru/obrazovatelnye-resursy/federalnye-klinicheskie-rekomendatsii/
18. Watz H., Tetzlaff K., Wouters E.F., Kirsten A., Magnussen H., Rodriguez-Roisin R., Vogelmeier C., Fabbri L.M., Chanez P., Dahl R., Disse B., Finnigan H., Calverley P.M. Blood eosinophil count and exacerbations in severe chronic obstructive pulmonary disease after withdrawal of inhaled corticosteroids: a post-hoc analysis of the WISDOM trial. Lancet Respir. Med. 2016;4(5):390–98.
19. Hospers J.J., Schouten J.P., Weiss S.T., Rijcken B., Postma D.S. Asthma attacks with eosinophilia predict mortality from chronic obstructive pulmonary disease in a general population sample. Am. J. Respir. Crit. Care Med. 1999;160:1869–74.
20. Hospers J.J., Schouten J.P., Weiss S.T., Postma D.S., Rijcken B. Eosinophilia is associated with increased all-cause mortality after a follow-up of 30 years in a general population sample. Epidemiology. 2000;11:261–68.
21. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Global Initiative for Chronic Obstructive Lung Disease (2010). www.goldcopd.org
22. Barnes P.J. Glucocorticosteroids: current and future directions. Br. J. Pharmacol. 2011;163(1):29–43.
23. Dong Y.H., Chang C.H., Lin Wu F.L., Shen L.J., Calverley P.M., Lofdahl C.G., Lai M.S., Mahler D.A. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: systematic review and meta-analysis of randomized controlled trials. a systematic review and meta-analysis of randomized controlled trials. Chest. 2014;145(6):1286–97.
24. Kew K.M., Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst. Rev. 2014;10(3):CD010115.
25. Magnussen H., Disse B., Rodriguez-Roisin R., Kirsten A., Watz H., Tetzlaff K., Towse .L, Finnigan H., Dahl R., Decramer M., Chanez P., Wouters E.F., Calverley P.M.; WISDOM Investigators. Withdrawal of inhaled glucocorticoids and exacerbations of COPD. N. Engl. J. Med. 2014;371(14):1285–94.
26. Pavord I.D., Agusti A. Blood eosinophil count: a biomarker of an important treatable trait in patients with airway disease. Eur. Respir. J. 2016;47(5):1299–303.
27. Hizawa N. LAMA/LABA vs ICS/LABA in the treatment of COPD in Japan based on the disease phenotypes. Int. J. Chron. Obstruct. Pulmon. Dis. 2015: 1093–102.
28. Kerwin E. A new alphabet for COPD care. Eur. Respir. J. 2016;48(4):972–75.
29. Couillard S., Larivee P., Courteau J., Vanasse A. Eosinophils in chronic obstructive pulmonary disease exacerbations are associated with increased readmissions. Chest. 2016: S0012-3692(16)60762-6.
30. Pavord I.D., Lettis S., Anzueto A., Barnes N. Blood eosinophil count and pneumonia risk in patients with chronic obstructive pulmonary disease: a patient-level meta-analysis. Lancet Respir. Med. 2016;4(9):731–41.
Автор для связи: И.Н. Трофименко – д.м.н., доцент кафедры клинической аллергологии и пульмонологии ИГМАПО – филиала ФГБОУ ДПО РМАНПО Минздрава РФ, Иркутск; e-mail: tin11@mail.ru
Источник
ЭОЗИНОФИЛЫ И БРОНХИАЛЬНАЯ ОБСТРУКЦИЯ ПРИ ХОБЛ В СОЧЕТАНИИ С ХРОНИЧЕСКОЙ ИНВАЗИЕЙ OPISTHORCHIS FELINEUS
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Черногорюк Г.Э.
1
Рослякова Е.П.
2
Шепелева Е.Г.
1
Денисова О.А.
1
Михайлова А.А.
1
Тюкалова Л.И.
1
Варвянская Н.В.
1
Рачковский М.И.
1
Калюжина Е.В.
1
Гарганеева Н.П.
1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования «Сибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации
2 ОГАУЗ Томский областной онкологический диспансер
В исследовании показано, что при ХОБЛ, ассоциированной с хроническим описторхозом, ведущими клеточными маркерами воспаления, непосредственно инициирующими синдром бронхиальной обструкции, являются нейтрофилы и эозинофилы. При эозинофильной реакции на инвазию O. felineus количество эозинофилов в крови и индуцированной мокроте находится в прямом соотношении. Эозинофилия увеличивает в бронхах эозинофильный компонент воспаления, поддерживающий основной клинический синдром этой нозологии – бронхообструкцию. При хроническом описторхозе антигельминтная эозинофильная реакция сопровождается повышенной репликацией низкоплотностной субпопуляции эозинофилов, для которых свойственна повышенная экспрессия мембранных рецепторов, вследствие чего они могут легко активизироваться. Активирование эозинофилов характеризуется выделением ими цитотоксических протеинов, обладающих протеолитической активностью не только в отношении инородных субстанций, но и нормальных тканей. При хроническом описторхозе эозинофилы крови реагируют на иммунодоминантные белки O. felineus дегрануляцией и цитолизисом. Высвобождающиеся из эозинофилов биологически активные вещества могут повреждать эпителий бронхолегочной системы, действуя синергично с другими факторами, участвующими в патогенезе ХОБЛ.
эозинофилы
хроническая обструктивная болезнь легких
Opisthorchis felineus
1. Fernandes F.L. Eosinophils in COPD: why should I care? // J. Bras. Pneumol. — 2016. — Jul.-Aug. — Vol. 42 (4). — P. 237-238.
2. Gabor L.G. Differences in eosinophil migration into the lungs following inhalated antigen chellenge of parasite-naiv quinea pigs geneticalli determined differences in responsiveness to a gastrointestinal nematode parasite / L.G. Gabor, T.L. Rothwell // Int. Arch. Allergy Immunol. – 1994. – 103 (4). — P. 391-395.
3. Giembycz M.A. Pharmacology of the eosinophil / M.A. Giembycz, M.A. Lindsay // Pharmacological reviews. – 1999. — Jun. — Vol. 51. — Issue 2. — P. 213-240.
4. Hall L.R. An essential role for interleukin –5 and eosinophils in helminth-induced airway hyperresponsiveness / L.R. Hall, R.K. Mehlotra, A.W. Higgins et al. // Infect. Immunol. – 1998. – Sep. — Vol. 66 (90). — P. 4425-4430.
5. Holgate S.T. The role of the eosinophil in asthma / S.T. Holgate, W.R. Roche, M.K. Church // Am. Rev. Respir. Dis. – 1991. — 143. — P. 66-70.
6. Kuwahara Y. Involvement of urban living environments in atopy and enhanced eosinophil activity: potential risk factors of airway allergic symptoms / Y. Kuwahara, J. Kondoh, K. Tatara et al. // Allergy. — 2001. — Mar. — Vol. 56 (3). — P. 224-230.
Вполне понятен механизм патологии органов дыхания вследствие легочной эозинофилии, при тканевых гельминтозах, при которых либо личинки, либо зрелые паразиты проникают в легочную ткань, инициируя тем самым местную антигельминтную эозинофильную реакцию. В этих случаях агрессивные свойства эозинофилов реализуются в отношении не только гельминтов, но и нормальных структур легкого, сочетаясь со способностью вызывать в бронхах бронхоспазм, гиперсекрецию слизи, отек, микротромбозы сосудов и пр. [4]. Вместе с тем при кишечных гельминтозах также возможна миграция эозинофилов в легкие под воздействием гельминтных антигенов [2]. Эозинофилия утвердилась как весьма значимый маркер в характеристике ХОБЛ, определяющий фенотип и выбор лечения [1]. С этих позиций изучение влияния гельминтной эозинофилии на бронхообструкцию при ХОБЛ представляется нам актуальной задачей.
Цель исследования
Изучение влияния эозинофилии при хроническом описторхозе (ХО) на бронхиальную обструкцию у пациентов с ХОБЛ.
Материалы и методы исследования
Обследовано 46 пациентов – с хронической обструктивной болезнью легких в сочетании с хроническим описторхозом. Эозинофилией крови считали количество клеток, равное или превышающее 0,350 × 10 6/л, или 5% и более в лейкоцитарной формуле. Отвергали или подтверждали наличие эозинофилии после 2-8-кратного исследования крови в течение 2–6 недель. Диагноз ХО подтверждался обнаружением яиц гельминтов в кале. Диагноз описторхоза отвергался после трехкратной отрицательной копроовоскопии, при отрицательных серодиагностических пробах. Диагноз ХОБЛ основывался на клинической картине заболевания. Синдром бронхообструкции подтверждался данными спирографии.
Объекты исследования. Цитологические мазки индуцированной мокроты от 46 больных ХОБЛ в сочетании с хроническим описторхозом и от 18 пациентов с описторхозом без сопутствующих бронхолегочных заболеваний. Гепаринизированная венозная кровь от 60 пациентов с хроническим описторхозом и от 16 практически здоровых лиц для выделения эозинофилов на ступенчатых градиентах плотности перколла с последующей количественной оценкой плотностных фракций, а также компьютерным морфометрическим изучением эозинофилов, выделенных на различных градиентах плотности. Капиллярная кровь 49 пациентов с хроническим описторхозом для определения показателя повреждения эозинофилов в среде, содержащей антигены O. felineus.
Для оценки морфофункциональных характеристик эозинофилов использовали метод выделения эозинофилов на градиенте плотности перколла. Морфометрическое изучение эозинофилов крови, мокроты, а также оценку относительного количества катионных протеинов в цитоплазме эозинофилов, окрашенных прочным зеленым, проводили методом компьютерного анализа цифровых скенограмм. Реакцию эозинофилов на антигены описторхисов исследовали по показателю повреждения эозинофилов в среде с антигенами. В качестве антигенов использовали стандартные «Тиатоп-стрип» тестовые системы для иммуноферментной диагностики описторхоза (производства ЗАО «Вектор-бест», г. Новосибирск), содержащие очищенные фиксированные иммунодоминантные фракции белков O. felineus. Статистическая обработка результатов исследования проводилась непараметрическими методами. Нулевые гипотезы отвергались при достижении уровня значимости соответствующего статистического критерия р < 0,05.
Результаты исследования и их обсуждение
Для оценки характера воспаления в бронхах при ХОБЛ в сочетании с ХО исследовался клеточный состав индуцированной мокроты (таблица 1). При ХОБЛ преобладающим клеточным компонентом являются нейтрофилы. Описторхозная инвазия инициирует появление в бронхиальном регионе значительного количества эозинофилов. Эти же соотношения клеточного состава мокроты наблюдались и при сравнении абсолютного количества эозинофилов на единицу объема индуцированной мокроты. При эозинофильной реакции на инвазию O. felineus количество эозинофилов в крови и в индуцированной мокроте положительно связаны между собой: показатели корреляционного анализа по Спирмену: r =0,52; р < 0,05.
Таблица 1
Клеточный состав (%) индуцированной мокроты у больных хронической обструктивной болезнью легких в сочетании с хроническим описторхозом (M ± m)
Клетки индуциро-ванной мокроты | Группы пациентов | Р | ||
ХОБЛ, ХО, эозинофилия n =25 | ХОБЛ, ХО, количество эозинофилов в крови не увеличено n =21 | ХО, эозинофилия n =18 | ||
1 | 2 | 3 | ||
Нейтрофилы | 42,5 ± 5,8 | 63,9 ± 4,4 | 38,5 ± 2,7 | P 1-2 = 0,004 P 1-3 > 0,05 P 2-3 = 0,005 |
Эозинофилы | 25,4 ± 4,9 | 9,8 ± 2,9 | 8,4 ± 1,4 | P 1-2 = 0,049 P 1-3 = 0,009 P 2-3 > 0,05 |
Макрофаги | 17,8 ± 3,24 | 14,7 ± 3,6 | 39,9 ± 2,8 | P 1-2 > 0,05 P 1-3 = 0,002 P 2-3 = 0,014 |
Лимфоциты | 14,3 ± 3,9 | 11,6 ± 1,6 | 13,2 ± 1,7 | P > 0,05 |
Эозинофилы крови (%) | 11,7 ± 1,1 | 3,4 ± 0,55 | 7,3 ± 0,9 | P 1-2 = 0,0001 P 1-3 = 0,009 P 2-3 = 0,001 |
Таблица 2 демонстрирует обратную зависимость спирометрических показателей бронхиальной обструкции с количеством нейтрофилов и эозинофилов в индуцированной мокроте при ХОБЛ в сочетании с инвазией описторхисами. То есть большему количеству этих клеток в мокроте соответствует меньший спирометрический показатель по отношению к должному. При ХОБЛ без сочетания с глистной инвазией показатели бронхиальной обструкции коррелировали только с количеством нейтрофилов в индуцированной мокроте.
Таблица 2
Соотношение спирометрических показателей, характеризующих бронхообструкцию с клеточным составом индуцированной мокроты при ХОБЛ в сочетании с хроническим описторхозом (n= 46)
Сопоставляемые показатели | Результат корреляционного анализа | ||
r | p | ||
Нейтрофилы ИМ | ОФВ1/ФЖЕЛ | — 0,94 | 0,0001 |
МОС-25 | — 0,71 | 0,006 | |
МОС-50 | — 0,6 | 0,028 | |
МОС-75 | — 0,66 | 0,014 | |
ОФВ1 | — 0,6 | 0,012 | |
Эозинофилы ИМ | ОФВ1/ФЖЕЛ | — 0,72 | 0,002 |
ОФВ1 | -0, 48 | 0,01 | |
Отражением морфологических изменений, происходящих в активированных эозинофилах, является плотностная характеристика клеток, получаемая путем разделения клеточной взвеси на градиенте плотности перколла. К низкоплотностной фракции отнесли клетки, выделяющиеся на градиентах плотности перколла 1,070–1,081, к нормоплотностной – 1,090–1,105. В группе здоровых лиц низкоплотностная фракция эозинофилов была в пределах известной нормы – 3,8 ± 0,21%. У инвазированных с эозинофилией крови более трети эозинофилов концентрировались на низких градиентах плотности перколла – 34,6 ± 1,24% (Р = 0,0001). При хронической инвазии O. felineus, но без гемической эозинофилии процент низкоплотностной фракции эозинофилов крови превышает таковой у здоровых субъектов – 12,1 ± 0,31% (Р = 0,012). В крови пациентов с ХО и эозинофилией крови процентное содержание этих клеток на градиентах – 1,070, 1,081, соответственно 17,1 ± 1,36% и 19,8 ± 1,1%. У инвазированных лиц, но без эозинофильной реакции на гельминт – на градиенте 1,070 – 3,09 ± 0,38% (Р < 0,001), на градиенте 1,081 – 3,9 ± 0,85% (Р < 0,01). Количество низкоплотностных эозинофилов в крови лиц, инвазированных описторхисами, но без эозинофилии, сопоставимо с величиной этой фракции у здоровых лиц, у которых на градиенте 1,070 концентрируется в среднем весьма небольшое количество клеток 2,6 ± 0,5%, а на 1,081 – 1,2 ± 0,32%.
Методом компьютерного анализа цифровых скенограмм эозинофилов, полученных на различных градиентах плотности, нами были исследованы некоторые морфометрические характеристики этих клеток (табл. 3). Низкоплотностная фракция эозинофилов отличалась от нормоплотностных эозинофилов большей величиной клетки, соответственно и большей площадью цитоплазмы. Светопроницаемость цитоплазмы в зеленом спектре была значительно выше в клетках, относящихся к низкоплотностной фракции. Этот показатель позволяет косвенно оценивать количество гранул в цитоплазме эозинофилов и свидетельствует о появлении большего количества вакуолей и, следовательно, интенсивной дегрануляции эозинофилов.
Таблица 3
Морфологическая характеристика фракций эозинофилов крови, выделенных на градиентах плотности перколла при хроническом описторхозе (M ± m)
Морфометрические показатели эозинофилограммы | Фракции эозинофилов | р | |
Нормоплот-ностная (n = 34) | Низкоплот-ностная (n = 26) | ||
Площадь клетки (мкм2) | 70,02 ± 1,51 | 88,4 ± 3,4 | 0,001 |
Площадь ядра (мкм2) | 38,7 ± 1,34 | 42,5 ± 2,06 | > 0,05 |
Площадь цитоплазмы (мкм2) | 31,5 ± 1,26 | 45,9 ± 1,7 | 0,005 |
Светопроницаемость цитоплазмы эозинофилов (зеленый спектр) | |||
— мода | 162,4 ± 2,4 | 189,0 ± 2,1 | 0,001 |
— медиана | 123,0 ± 4,1 | 190,4 ± 4,8 | 0,015 |
Сопоставлены морфометрические показатели эозинофилов низкоплотностной фракции эозинофилов крови и индуцированной мокроты (табл. 4).
Таблица 4
Сопоставление морфометрических показателей низкоплотностной фракции эозинофилов крови и эозинофилов индуцированной мокроты у пациентов с ХОБЛ в сочетании с хроническим описторхозом (M ± m)
Показатели | Низкоплот-ностная фракция эозинофилов крови (n = 26) | Эозинофилы мокроты (n = 25) | р |
Площадь клетки (мкм2) | 88,4 ± 3,4 | 96,4± 4,8 | 0,048 |
Площадь ядра (мкм2) | 42,5 ± 2,06 | 48,0 ± 2,42 | > 0,05 |
Площадь цитоплазмы (мкм2) | 45,9 ± 1,7 | 48,4 ± 2,28 | > 0,05 |
Светопроницаемость цитоплазмы эозинофилов (зеленый спектр) | |||
— мода | 189,0 ± 2,1 | 178,06± 2,07 | 0,045 |
— медиана | 190,4 ± 4,8 | 159,04±10,17 | 0,004 |
Была выявлена большая величина эозинофилов мокроты. Замечено, что яркость свечения цитоплазмы эозинофилов ИМ меньше, чем низкоплотностных эозинофилов крови (мода, соответственно, 178,06 ± 2,07 и 189,0 ± 2,1; р = 0,045), но в то же время значительно интенсивнее по сравнению с нормоплотностными эозинофилами (мода, соответственно, 178,06 ± 2,07 и 162,4 ± 2,4; р = 0,013). То есть процессы дегрануляции эозинофилов в бронхолегочном регионе идут интенсивно и, вероятно, вследствие свойств этих клеток, инициируют патофизиологические эффекты, результатом которых является синдром бронхиальной обструкции.
В отношении гетерогенности эозинофилов в настоящее время нет единой гипотезы, которая бы адекватно объясняла генерацию низкоплотностных эозинофилов. Возможно, это мультифакторный процесс, который может быть сведен к нижеследующим положениям [3]:
- низкоплотностными нормоплотностные эозинофилы становятся только когда входят в экстраваскулярное пространство, где активизируются;
- эозинофилы становятся гиподенсными в период циркуляции в кровяном русле, после чего мигрируют в ткани;
- низкоплотностные эозинофилы отражают число молодых клеток, поступающих в кровяное русло из костного мозга;
- низкоплотностные эозинофилы появляются исключительно при тяжелых заболеваниях, и их характеризует определенное функциональное состояние этой клетки.
Механизм антигельминтного действия эозинофилов реализуется через их сенсибилизацию к антигенам паразитов, при контакте с которыми происходит высвобождение основного и катионного протеинов, пероксидазы, нейротоксина и пр. То есть веществ, способных разрушать кутикулу паразита. При рекрутировании эозинофилов в ткани повреждающее действие этих клеток на окружающие биоструктуры связано не только с появлением активных (гиподенсных) эозинофилов, но и способностью этих клеток в присутствии специфического и неспецифического IgE отвечать дегрануляцией на гельминтные антигены. Необходимо заметить, что антигены способны проникать в слизистые оболочки как желудочно-кишечного тракта, так и бронхолегочной системы [5; 6].
Реакцию эозинофилов на антигены описторхисов исследовали по показателю повреждения эозинофилов в среде с антигенами. Показатель повреждения эозинофилов при контакте с очищенными фиксированными иммунодоминантными фракциями белков O. felineus при хроническом описторхозе был наиболее высоким был у пациентов с ХОБЛ (табл. 5). Изменения эозинофилов при воздействии антигена гельминта носили преимущественно характер цитолиза: клетки, «разбухшие» в 2 и более раз, превышают размеры окружающих нейтрофилов, оболочка разорвана, рядом – гранулы; в некоторых препаратах наблюдался распад ядра на хроматиновые нити.
Таблица 5
Показатель повреждения эозинофилов под влиянием антигенов O. felineus при хроническом описторхозе (M ± m)
Группы пациентов | ППЭ | Р |
Хронический описторхоз, ХОБЛ (n = 19) | 27,11 ± 2,5 | P1-3 = 0,004 P1-2 = 0,001 P2-3 = 0,004 |
Хронический описторхоз (n = 18) | 11,43 ± 1,16 | |
Контроль (n = 16) | 5,61 ± 1,4 |
Изменения эозинофилов в тканях при ХО, возможно, обусловлены и действием антигенов гельминта. Многие авторы рассматривают эозинофильный цитолиз в тканях как большой активационный механизм, наблюдаемый вместе с дегрануляцией, который лежит в основе заболеваний, где клеткой-эффектором является эозинофил. Дегрануляция эозинофилов под влиянием антигенов гельминтов наблюдалась не у всех инвазированных. Возможно, это связано с различной способностью организма исследуемых реагировать в хронической стадии гельминтоза выработкой в достаточном количестве и IgG4, способного блокировать рецепторы FcεRΙΙ (возможно, FcεRΙ), в результате чего к этим рецепторам не присоедин?
