Изменение белкового состава при воспалении
Гипопротеинемия— снижение общего содержания белков в
плазме крови. Она может встречаться при
белковом голодании, заболеваниях
желудочно–кишечного тракта, печени,
почек.
Диспротеинемия— изменение соотношения отдельных
фракций белков (в норме альбумин-глобулиновый
коэффициент равен 1,5:1,9). В острой стадии
воспалительных заболеваний в плазме
увеличивается содержание глобулинов
α и β фракций. К белкам острой стадии
воспаления относятся, в частности,
гаптоглобин, орозомукоид, с– реактивный
белок. Считается, что белки острой фазы
воспаления оказывают защитное действие
на ткани, угнетают агрессивные
протеолитические ферменты тканей. При
хронических заболеваниях в плазме
увеличивается содержание иммуноглобулинов.
Парапротеинемия
— появление в плазме патологических
белков, таких как криоглобулины
(осаждаются при температуре ниже 37
о), пироглобулинов (осаждается при
60-80о С), фетопротеин (эмбриональный
белок).
11.3.2. Небелковые азотсодержащие вещества крови
Сумма низкомолекулярных
азотистых веществ, остающихся в крови
после осаждения белков, называется
остаточным азотом(RN).
В норме он составляет 15-25 ммоль/л. 50%
остаточного азота составляетмочевина,
концентрация которой равняется 3,3-8
ммоль/л, 25% остаточного азота приходится
нааминокислоты.В состав остаточного
азота крови входят такжепептиды,мочевая кислота (0,2-0,4 ммоль/л),аммиак(20-80 мкмоль/л),билирубин (2-8,20
мкмоль/л),креатинин (60-130 мкмоль/л).
Большинство
компонентов остаточного азота являются
конечными продуктами азотистого обмена,
которые выводятся через почки. В связи
с этим при патологии почек содержание
RNрезко увеличивается,
развивается симптом ретенционнойазотемии. Продукционная азотемия
встречается при увеличенном распаде
белков, онкологических заболеваниях.
11.3.2.1. Кининовая система крови.
Кинины представлены
пептидом брадикинином(9 аминокислотных
остатков),каллидином(10 остатков
аминокислот) илизил-метионил-брадикинином(содержит 11 аминокислот).
Б иологическое
иологическое
действие кининов моногообразно. Они
регулируют гемодинамику, увеличивают
работу сердца, расширяют сосуды, вызывают
спазм гладкой мускулатуры бронхов,
матки, являются медиаторами воспаления,
участвуют в регуляции свёртывающей и
антисвёртывающей системы крови, обладают
иммуномодуляторным действием.
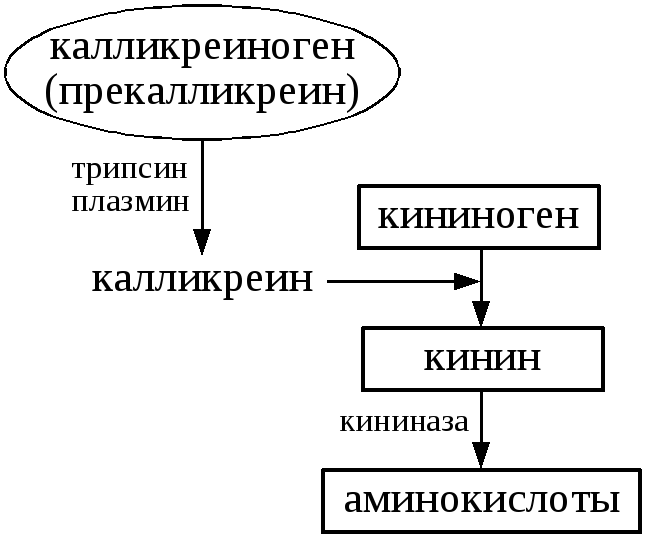
Кинины синтезируются
из неактивных белков предшественников
— кининогенов. В синтезе кининов участвуют
протеолитические ферменты каликренины.
Калликренины, в свою очередь, образуются
из не активных каликрииногенов
(прекалликреиногенов), при участии
трипсина, плазмина крови.Распад
кининов до аминокислот осуществляется
ферментами кининаазами.
11.3.3. Безазотистые органические вещества крови
К безазотистым
органическим веществам крови относятся
углеводы и липиды. Глюкоза содержится
в крови в концентрации 3,3-5,5 ммоль/л. В
крови присутствуют различные метаболиты
углеводного обмена (пируват, лактат, и
другие). Содержание сиаловых кислот
составляет 2,2-2,6 ммоль/л. Общее содержание
липидов у взрослых людей находится в
интервале 4-8 г/л. Концентрация
триацилглицеринов составляет 1,5-2,5
ммоль/л, фосфолипидов — 2,5-3,5 ммоль/л,
холестерина — 3,5-5,2 ммоль/л, свободных
жирных кислот — 0,4-0,8 ммоль/л. У детейсодержание всех видов жиров, кроме
свободных жирных кислот, ниже, чем у
взрослых.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
09.03.201623.62 Mб20Belov_Yu_V_Rukovodstvo_po_sosudistoy_khirurgii_s.djvu
- #
- #
- #
- #
- #
- #
- #
Источник
ИЗМЕНЕНИЯ БЕЛКОВОГО СОСТАВА ОРГАНИЗМА
Белковый состав организма здорового взрослого человека относительно постоянен, хотя возможны изменения количества отдельных белков в органах и тканях в зависимости от состава пищи и режима питания, от физиологической активности человека, биологических ритмов.
А. Изменение белкового состава клеток в процессе их дифференцировки
В процессе развития многоклеточного организма, особенно на стадиях дифференцировки клеток, белковый состав значительно изменяется. Для каждого типа специализированных клеток характерно появление специфических белков, которые определяют особенности их биологических функций. Так, только в эритроцитах есть гемоглобин, осуществляющий транспорт кислорода, к тканям, а в клетках сетчатки глаза — белок родопсин, необходимый для улавливания фотонов света. Кроме того, специализированные клетки отличаются и количеством белков, присутствующих практически во всех или во многих клетках организма.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии.
Б. Наследственные протеинопатии
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. Примеры наследственных протеинопатии — гемоглобинопатии, рассмотренные выше. В зависимости от роли дефектного белка в жизнедеятельности организма, от степени нарушения конформации и функции белков, от гомо- или гетерозиготности индивидуума по этому белку наследственные протеинопатии могут вызывать болезни, протекающие с различной степенью тяжести, вплоть до летального исхода ещё до рождения или в первые месяцы после рождения.
В. Приобретенные протеинопатии
Любая болезнь сопровождается изменением белкового состава организма, т.е. развивается приобретённая протеинопатия. При этом первичная структура белков не нарушается, а обычно происходит количественное изменение белков, особенно в тех органах и тканях, в которых развивается патологический процесс. Например, при панкреатитах снижается выработка ферментов, необходимых для переваривания пищевых веществ в ЖКТ. В некоторых случаях приобретённые протеинопатии развиваются в результате изменения условий, в которых функционируют белки. Так, при изменении рН среды в щелочную сторону (алкалозы различной природы) изменяется кон-формация гемоглобина, увеличивается его сродство к О2 и снижается доставка О2 тканям (гипоксия тканей).
Иногда в результате болезни повышается уровень метаболитов в клетках и сыворотке крови, что приводит к модификации некоторых белков и нарушению их функции. Так, повышенные концентрации глюкозы в крови при сахарном диабете приводят к неферментативному присоединению её к белкам (гликозилированию белков). Примером может служить повышение уровня гликозилированного гемоглобина в эритроцитах, что увеличивает его сродство к О2 и снижает транспорт О2 в ткани. Гликозилирование белков хрусталика глаза (кристалликов) приводит к его помутнению и развитию катаракты.
Кроме того, из клеток повреждённого органа в кровь могут выходить белки, которые в норме определяются там лишь в следовых количествах. При различных заболеваниях часто используют биохимические исследования белкового состава крови для уточнения клинического диагноза. Например, при панкреатите в крови повышается активность панкреатической амилазы (фермента, участвующего в расщеплении крахмала), которая в норме не должна попадать в кровь, а по протоку поджелудочной железы вьщеляется при пищеварении в двенадцатиперстную кишку
В некоторых случаях биохимические данные об изменении белкового состава крови или мочи могут стать ведущими при постановке диагноза. Например, при миеломе (злокачественном перерождении плазматических клеток, синтезирующих иммуноглобулины) в крови и моче появляются белки Бенс-Джонса, которые в низких концентрациях присутствуют и в крови здоровых людей. Эти белки представляют собой лёгкие цепи иммуноглобулина G, синтез которых усиливается в злокачественно перерождённых клетках.
Источник
Различия в белковом составе органов
Белковый состав различных органов складывается на стадии дифференцировки клеток многоклеточных организмов. Каждый тип специализированных клеток характеризуется определенным набором белков. Преобладающие белки-скелетных мышц — актин и миозин; в соединительной, хрящевой и костной тканях преобладает межклеточный матрикс, который содержит коллагены (19 различных типов, в зависимости от ткани или органа, что составляет 25-33% от общего количества белка), а также адгезивные белки и протеогликаны. Печень содержит множество специфических ферментов, обеспечивающих выполнение её метаболических, депонирующих, барьерных, экскреторных и гомеостатических функций. Ферритин, депонирующий железо в клетках, содержится почти во всех тканях, но преимущественно в печени, селезенке и костном мозге. Трансферрин — белок переносящий железо, содержится преимущественно в крови. Кровь также содержит белки-переносчики гормонов, которых нет во внутренних органах.
Изменения белкового состава организма человека в онтогенезе, при заболеваниях
Изменения в синтезе белков в онтогенезе выражаются в резком снижении н х образования в связи с падением темпов роста организма, в различной скорости накопления специфических белков в период роста и на поздних этапах онтогенеза. Этим, в основном, и обусловлены возрастные изменения в белковом спектре органов и тканей.
В первой половине онтогенеза резко уменьшается возможность обновления организма за счет размножения и смены клеток и ведущим становится обновление, обусловленное распадом и последующим ресинтезом отдельных белков. Обновление тотальных белков с возрастом в отдельных органах меняется неодинаково. Его замедление частично может быть вызвано более ограниченным использованием некоторых белков в метаболических процессах, но преимущественно — увеличением массы медленно обновляющихся белков. Наиболее важной чертой, характеризующей состояние анаболических процессов белкового обмена в онтогенезе, является разная степень количественных изменений синтеза отдельных белков.
С возрастом происходит изменение активности ферментов, поскольку происходит изменение их концентраций.
Активность лактазы изменяется в зависимости от возраста: она максимальна к моменту рождения, снижается к 3-5 годам, у взрослых она составляет 10% от уровня активности, характерной для детей (лишь немногие взрослые, преимущественно жители Северной Европы, сохраняют высокую активность лактазы в течении всей жизни). Лактазная недостаточность взрослых не является проявлением патологии, она отражает естественный процесс инволюции активности фермента.
При заболеваниях белковый состав органов и тканей изменяется. Муколипидоз (наследственное заболевание, которое проявляется в отставании умственного развития и костными деформациями), при этом концентрация ряда ферментов-гидролаз (сложные белки) в крови повышено во много раз, а их лизосомальная активность в клетках значительно снижена. Это связано с повреждением якорного участка фермента, отвечающего за связывание с мембранами лизосом, которые перестают распознавать и связывать гидролазы.
Большое количество заболеваний сопровождается воспалением. Воспаление представляет собой защитно-приспособительную реакцию организма, направленную на выведение патогена. Механизмы воспалительного процесса универсальны, и закономерности развития являются общими, независимо от структурно-функциональных различий тканей.
В воспаленной ткани тучные клетки выделяют медиаторы воспаления (гистамин, серотонин, гепарин и др.). Происходит секреция биологически активных полипептидов (брадикинин, каллидин) — регуляторов проницаемости сосудов.
Из различных клеток высвобождаются лизосомальные (гликолитические, липолитические и протеолитические) ферменты, активизирующие в ткани реакции гликолиза, липолиза и протеолиза. Биологически активные вещества (медиаторы, ферменты) оказывают болезнетворное воздействие, и вызывают дальнейшее разрушение (вторичную альтерацию, т.е. повреждение) клеток. При воспалении увеличивается синтез более чем 40 белков, называемых белками острой фазы. К ним относятся компоненты системы комплемента, участвующие в процессе накопления фагоцитов в очаге воспаления и уничтожения патогенных микроорганизмов. С-реактивный белок, основной белок острой фазы воспаления, связывает различные патогенные факторы и продукты распада поврежденных клеток, способствует опсонизации этих веществ и активирует систему комплемента.
На ранних этапах воспаления секретируются гормоны, способствующие развитию воспаления (соматотропный гормон, минералокортикоиды, гормоны щитовидной железы), а также ряд цитокинов (местные гормоны иммунной системы). Запуск ответной иммунной реакции зависит от секреции лимфоцитами интерлейкина-2 и гамма-интерферона.
Противовоспалительные медиаторы (адреналин, норадреналин, гепарин) ограничивают зону воспаления.
В период благоприятного завершения воспалительного процесса секретируются гормоны, препятствующие развитию воспаления (АКТГ, глюкокортикоиды, инсулин, стероидные гормоны). За торможение иммунной реакции отвечает цитокин TGF-бета.
Ферменты
Date: 2016-05-24; view: 1058; Нарушение авторских прав
Источник
— ↑α-глобулины=белки острой фазы.
Как изменяются фракции белков при хронизации воспаления?
— ↑γ-глобулины
Назвать белки острой фазы и дать им краткую характеристику
— большая группа белков сыворотки крови (в основном α-глобулинов), объединенных по признаку – быстрое и значит.увелич.конц. при бактер.,вирус., паразитарной инфекции, травме, злокач.новообразованиях и т.п.
увелич.
1) С-реактивный белок(СРБ) – самый чувствит. и быстрый индикатор повреждения тканей при воспалении, некрозе, травме; вступ. в реакцию преципитации с С-полисахаридом пневмококков. Стимулир.иммунные реакции, фагоцитоз, актив.классич.сист.комплемента.
У здорового человека отсутствует, синтезир.вгепатоцитах.
2) Белки сывороточного амилоида (БСА) – норм.белок сыворотки, синтезир.в печени; быстрый и сильный маркер «о.фазы», амилоидоза, инсульта.
3) Фибриноген-синтезир. в печени, участв. в свертывании
Альфа1-глобулины
3) α1-антитрипсин — ингибитор.протеиназ(тринсина, химотрипсина, калликреина, плазмина)
4) α1- гликопротеин (до 41% углеводов) – транспортир.прогестерн, тестостерон.
Альфа2-глобулины
5) церулоплазмин – оксиляет субстраты, содержит 90% всей меди плазмы.
6) гаптоглобин – соед с гемоглобином, осущ. его транспорт в ММС.
7) α2-макроглобулин – цинкосодержащий, синтезир. вне печен!; ингибир.протеазы (трипсин, химотрипсин, тромбин, каликреин)
уменьш—
1) альбумины – синтезир.печень; утилизир. в энтероцитах, почках, печени, коже, легких.
1. поддерживает Ронк (на75-80%)
2. резерв белка
3. транспорт СЖК, Са, Cl, лек-в, билирубина, гормоны.
2) трансферин–перенос всосавшегося железа к месту депонирования (печень, селезенка, кл.кост.мозга)
69) Больной находится на стационарном лечении в ревматологическом отделении. На 15 день госпитализации при исследовании белковых фракций в сыворотке крови обнаружено: альфа-1-глобулины – 5%, альфа-2-глобулины – 7%, бета-глобулины – 18%, гамма-глобулины – 23%. Содержание альбуминов в пределах нормы. Имеются ли нарушения в приведенных анализах? Алгоритм решения:
Каковы нормальные показатели белковых фракций в сыворотке крови?
α1 (6-7%), α2 (8-9%), β (13-14%), γ (11-12%)
В чем сущность метода электрофореза?
— позволяет разделить смесь белков в зависимости от их молекуляр.массы и электрич.заряда.
— исследуемую смесь белков на носителе(пластине) помещают в камеру для электрофореза, заполненную буферным р-ром и подключенную к источнику постоянного тока. В итоге получается 5 основных полос, которые сооответствуют фракциям альбумина; α1,α2,β,γ-глобулинов. Относит.содержаение каждой фракции можно оценить с помощью денситометра.
Как изменится соотношение фракций при остром и хроническом воспалении?
Острое, подострое, хронич.
воспаление: ↑α-глобулины=белки острой фазы.
Х.воспаление: ↑γ-глобулины
70) Больной жалуется на периодические и опоясывающие боли в животе, особенно сильные в левом подреберье. В последнее время появился частый и жидкий стул, особенно после принятия жирной пищи. В кале наличие жиров. Врач предполагает поражение поджелудочной железы. На чем основано это предположение?
Алгоритм решения:
1) Какой специфический фермент повышается в крови при остром поражении поджелудочной железы. К каком у классу и подклассу он относится.
— липаза – фермент, кот. синтезируется в поджелуд.железе, выделяется в просвет 12перст и тонкой кишки, где расщепляет жиры пищи(ТАГ→на глицерин и жир.—ты). При панкреатите повышается и сохраняется на таком ур-ня в теч 12 дней.
— гидролаза – эстеразы – липаза
Читайте также:
Рекомендуемые страницы:
©2015-2020 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2016-02-13
Нарушение авторских прав и Нарушение персональных данных
Источник
Для количественного определения белка используют колориметрические и спектрофотометрические методы, в некоторых случаях пользуются определением белка по содержанию общего азота в препарате.
Рефрактометрический метод определения концентрации белка. Принцип метода основан на способности белковых частиц преломлять луч света. Степень рефракции зависит от концентрации веществ в растворе, физического состояния растворѐнных частиц, природы веществ в растворе, длины волны света, температуры.
Количественное определение концентрации веществ с помощью фотоэлектроколориметра Принцип работы фотоэлектроколориметра основан на возникновении электрического тока в цепи под влиянием лучей света, проходящих через окрашенный раствор и попадающих на фотоэлемент.
В основе действия прибора лежит закон Ламберта-Бугера-Бэра о пропорциональности между интенсивностью окраски раствора и степенью поглощения им света.
Количественное определение концентрации белка биуретовым методом. Принцип метода основан на том, что белок сыворотки крови реагирует в щелочной среде с сернокислой медью с образованием соединений, окрашенных в фиолетовый цвет; Интенсивность развивающегося окрашивания прямо пропорциональна концентрации белка в растворе.
ИНДИВИДУАЛЬНЫЕ ОСОБЕННОСТИ,
Вопрос тканевой специфичности белков в основе своей повторяет их видовую специфичность. Белки мышечной .ткани отличаются от белков костей или печени. Это можно подтвердить на примере ферментов. Например, и в печени, и в сердечной мышце находится фермент лактатдегидрогеназа, катализирующий синтез молочной кислоты. При детальном изучении свойств ферментов оказалось, что, несмотря на их одинаковую функцию, они различаются по некоторым свойствам Таким образом, каждый вид, каждый представитель этого вида, как и любая ткань, а возможно и клетка, характеризуется наличием строго специфичных белков, определяющих их индивидуальность.
Изменения.
Самый простой пример — изменение в составе гемоглобина. Во время отногенеза он меняется несколько раз.
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2ξ2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F — фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 γ-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
И взрослый:
Гемоглобин А — основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β (2α2β).
Гемоглобин А2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
И нарушения могу быть наследственный и приобретенные.
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. Примеры наследственных протеинопатий — гемоглобинопатии.
Любая болезнь сопровождается изменением белкового состава организма, т.е. развивается приобретённая протеинопатия. При этом первичная структура белков не нарушается, а обычно происходит количественное изменение белков, особенно в тех органах и тканях, в которых развивается патологический процесс. Например, при панкреатитах снижается выработка ферментов, необходимых для переваривания пищевых веществ в ЖКТ.
Дата добавления: 2016-03-25; просмотров: 3202 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Источник
