Гиперосмия в очаге воспаления это

Оглавление темы «Изменения клеток при воспалении.»:
1. Изменение клеток при воспалении. Изменение морфологии и обмена веществ при воспалении.
2. Метаболизм углеводов при воспалении. Нарушение обмена углеводов при воспалении.
3. Метаболизм липидов при воспалении. Нарушение обмена липидов при воспалении.
4. Метаболизм белков при воспалении. Нарушение обмена белков при воспалении.
5. Метаболизм ионов и воды при воспалении. Нарушение обмена ионов и воды при воспалении.
6. Физико-химические изменения в очаге воспаления. Ацидоз.
7. Гиперосмия в очаге воспаления. Гиперонкия в очаге воспаления.
8. Изменение поверхностного натяжения мембран в очаге воспаления. Изменения коллоидного состояния цитозоля в очаге воспаления.
9. Медиаторы воспаления. Виды медиаторов воспаления.
10. Биогенные амины. Серотонин. Адреналин. Норадреналин.
В очаге воспаления в большей или меньшей мере повышается осмотическое давление.
Причины гиперосмии в очаге воспаления
• Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и др.).
• Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества.
• Поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Последствия гиперосмии в очаге воспаления
• Гипергидратация очага воспаления.
• Повышение проницаемости сосудистых стенок.
• Стимуляция эмиграции лейкоцитов.
• Изменение тонуса стенок сосудов и кровообращения в очаге воспаления.
• Формирование чувства боли.
Гиперонкия в очаге воспаления
Увеличение онкотического давления в воспалённой ткани — закономерный феномен.
Причины гиперонкии в очаге воспаления
• Увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов.
• Повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействии с ионами.
• Выход белков (в основном альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Последствия гиперонкии в очаге воспаления
Основное: развитие отёка в очаге воспаления.
Заряд и электрические потенциалы
Альтерация тканей при воспалении ведёт к нарушениям электрофизиологаческих процессов в клетках: изменению (как правило, снижению) поверхностного их заряда, а также к расстройствам электрогенеза в возбудимых клетках.
Причины нарушения электрофизиологаческих процессов в клетках
• Повреждение клеточных мембран.
• Нарушение энергообеспечения трансмембранного переноса ионов.
• Нарушения ионного баланса во внеклеточной жидкости. Последствия
• Изменение порога возбудимости клеток.
• Колебание чувствительности клеток к действию БАБ (цитокинов, гормонов, нейромедиаторов и др.).
• Потенцирование миграции фагоцитов за счёт электрокинеза.
• Стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой (у повреждённых и погибших клеток внешняя поверхность цитолеммы заряжена положительно в связи с избытком на ней К+, Н+ и других катионов).
— Читать далее «Изменение поверхностного натяжения мембран в очаге воспаления. Изменения коллоидного состояния цитозоля в очаге воспаления.»
Источник
Причинами гиперосмии являются:– повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других); – усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества; – поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Гиперосмия обусловливает:–гипергидратацию в очаге воспаления; – повышение проницаемости сосудистых стенок; – стимуляцию эмиграции в зону воспаления лейкоцитов; – изменение тонуса стенок сосудов и кровообращения ; – формирование чувства боли.
Гиперонкия
Увеличение онкотического давления в воспалённой ткани – закономерный феномен.
Причинами гиперонкии являются: –увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов; – повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами; – выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Основное последствиегиперонкии в очаге воспаления это развитие отёка.
Поверхностный заряд и электрические потенциалы клеток
Альтерация тканей при воспалении ведёт к изменению (как правило —снижению) их поверхностного заряда, а также – мембранных потенциалов возбудимых клеток.
Причинынарушений заряда и потенциалов мембран клеток:–повреждение клеточных мембран, –расстройства энергообеспечения трансмембранного переноса ионов, –ионный баланс во внеклеточной жидкости.
Основные последствияотклонения мембранных потенциалов клеток в очаге воспаления: – изменения порога возбудимости клеток; – колебание чувствительности клеток к действию БАВ (цитокинов, гормонов, нейромедиаторов и других); – потенцирование миграции фагоцитов за счёт электрокинеза (см. рис. 6–20); – стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой (у повреждённых и погибших клеток внешняя поверхность цитолеммы заряжена положительно в связи с избытком на ней К+, Н+ и др. катионов).
Поверхностное натяжение мембран клеток
Для очага воспаления характерно уменьшение поверхностного натяжения клеточных мембран.
Основная причина этого– значительное увеличение концентрации в очаге воспаления поверхностноактивных веществ (фосфолипидов, ВЖК, K+, Ca2+ и некоторых других).
Основными последствиямиуменьшения поверхностного натяжения клеточных мембран при воспалении являются: – облегчение подвижности лейкоцитов (уменьшение поверхностного натяжения плазмолеммы способствует образованию псевдоподий); – потенцирование процесса адгезии фагоцитов к объекту фагоцитоза; – облегчение контакта фагоцитов и лимфоцитов при развитии реакций иммунитета и аллергии.
Коллоидное состояние цитозоля и межклеточного вещества
Изменения коллоидного состояния цитозоля и межклеточного вещества выявляются уже на начальном этапе воспаления.
Причина этого– накопление избытка Н+, K+, Na+, жирных кислот, пептидов, аминокислот, других метаболитов и БАВ (наряду с изменением степени гидратации цитоплазмы) приводит к облегчению переходов цитозоля: «гель – золь». В наибольшей степени такая трансформация характерна для фагоцитов.
Основные механизмы изменения коллоидного состоянияв очаге воспаления: – колебание степени полимеризации макромолекул (гликозаминогликанов, белков, протеогликанов и других); – фазовые переходы состояния микрофиламентов интерстиция. Переход цитозоля в состояние геля происходит при образовании из нитей F–актина упорядоченной структуры (актиновая решётка). Такая структура формируется при перекрестном соединении нитей актина с участием актинсвязывающих белков и при низкой концентрации Ca2+. При увеличении в цитозоле содержания Ca2+ процесс формирования актиновой решётки подавляется, цитоплазма приобретает состояние золя.
Главные последствияизменений коллоидного состояния цитозоля и интерстиция заключается в: – изменении тканевой проницаемости (в основном –стенок микрососудов) и – потенцировании процесса миграции лейкоцитов к объекту фагоцитоза.
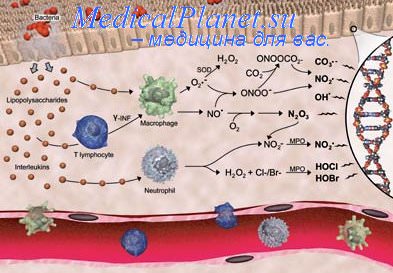
МедиаторЫ ВОСПАЛЕНИЯ
Образование и реализация эффектов БАВ – одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений, а также исходы воспаления. Именно поэтому БАВ нередко именуют как «пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
Ы ВЁРСТКА. Таблица: НЕ РВАТЬ, НЕ ПЕРЕМЕЩАТЬ
| МЕДИАТОРЫ ВОСПАЛЕНИЯ — | ||
| • БАВ, образующиеся при воспалении, | ||
| • обеспечивающие закономерный характер его развития и исходов, | ||
| • формирование его местных и общих признаков | ||
Все медиаторы воспаления и их неактивные предшественники образуются в клетках организма. Но их подразделяют на клеточные и плазменные (рис. 6–8).
Ы ВЁРСТКА вставить файл «ПФ Рис 06 08 Виды медиаторов воспаления по их происхождению»
Рис.6–8.Виды медиаторов воспаления.
Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но в не активном состоянии, а в виде предшественников.Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Предложено несколько классификаций групп медиаторов воспаления. Все они содержат в качестве классифицирующих несколько критериев. Рассматриваемые далее медиаторы воспаления подразделены на группы и подгруппы в соответствии со сложившимся на момент написания учебника представлениями. Некоторые пояснения приводятся в тексте этого раздела, а также в статьях «Цитокины», «Хемокины», «Факторы», «Интерлейкины», «Интерфероны», «Лейкоциты», «Макрофаги», «Тромбоциты» (см. «Справочник терминов» на компакт-диске).

Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Источник
Метаболический
ацидоз в
очаге воспаления обусловлен накоплением
избытка различных кислот: молочной,
пировиноградной, аминокислот, ВЖК и
КТ. ♦ Механизмы
развития: нарушение
удаления из очага воспаления образующихся
в большом количестве кислых продуктов
метаболизма. Это вызывает истощение
буферных систем (бикарбонатной, фосфатной,
белковой) клеток и межклеточной жидкости.
♦ Последствия:
—
Повышение проницаемости мембран, в том
числе лизосом, что приводит к выходу
гидролаз в цитозоль и межклеточное
вещество.
-Повышение
проницаемости стенок сосудов за счёт
усиления неферментного и ферментного
гидролиза компонентов межклеточного
матрикса, включая базальные мембраны.
-Формирование
ощущения боли в очаге воспаления в связи
с раздражением и повреждением
чувствительных нервных окончаний в
условиях избытка Н+.
— Изменения
чувствительности рецепторов клеток (в
том числе — стенок сосудов) к регуляторным
факторам (нейромедиаторам, гормонам,
медиаторам воспаления), что сопровождается
расстройством регуляции тонуса сосудистой
стенки.
Гиперосмия —
повышенное осмотическое давление в
регионе воспаления. Обусловлено
накоплением большого количества ионов
и низкомолекулярных соединений.
♦ Механизмы
развития: повышенное
ферментативное и неферментативное
разрушение макромолекул, усиленный в
условиях ацидоза гидролиз солей и
выделение осмотически активных соединений
из повреждённых клеток.
♦ Последствия: гипергидратация
очага воспаления, стимуляция эмиграции
лейкоцитов, изменение тонуса стенок
сосудов, формирование чувства боли.
Гиперкопния —
повышенное онкотическое давление в
ткани при ее воспалении.
♦ Механизмы
развития: увеличение
концентрации белка в очаге воспаления
в связи с усилением ферментативного и
неферментативного гидролиза пептидов
и выход белков (в основном — альбуминов)
из крови в очаг воспаления в связи с
повышением проницаемости сосудистой
стенки.
♦ Последствия: развитие
отёка в очаге воспаления.
Изменение
поверхностного заряда клеток
(как правило, снижение). Обусловлено
нарушением водно-электролитного баланса
в воспаленной ткани.
♦ Механизмы
развития: нарушение
энергообеспечения трансмембранного
переноса ионов и развитие электролитного
дисбаланса.
♦ Последствия: изменение
порога возбудимости клеток, потенцирование
миграции фагоцитов за счёт электрокинеза;
стимуляция кооперации клеток в связи
со снижением величины отрицательного
поверхностного их заряда, нейтрализацией
его или даже перезарядкой.
Изменения
коллоидного состояния межклеточного
вещества и гиалоплазмы клеток в очаге
воспаления.
♦ Механизмы
развития:
— Ферментативный
и неферментативный гидролиз макромолекул
(гликозаминогликанов, белков,
протеогликанов).
-Фазовые
изменения микрофиламентов, облегчающие
переход их состояния из геля в золь и
наоборот.
♦ Последствия (основное):
увеличение тканевой проницаемости.
Уменьшение
поверхностного натяжения клеточных
мембран. Обусловлено
изменениями структуры молекул плазмолеммы.
♦ Механизмы
развития: воздействие
на клеточные мембраны значительного
количества поверхностноактивных веществ
(фосфо-
липидов,
ВЖК, К+,
Са2+).
♦ Последствия: облегчение
подвижности клетки и потенцирование
адгезии клеток при фагоцитозе.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Рис. 5–7. Эффекты ацидоза в очаге воспаления.
Ацидоз
Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитием ацидоза.
Причина
Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений.
Механизмы развития метаболического ацидоза
• Образование большого количества «кислых» продуктов изменённого метаболизма вследствие:
† активации гликолиза, что сопровождается накоплением избытка молочной и пировиноградной кислот
† усиления протеолиза и липолиза с накоплением аминокислот, ВЖК и КТ.
• Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления.
• «Истощение» щелочных буферных систем (бикарбонатной, фосфатной, белковой и других) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений.
Особенности изменения [Н+] в очаге воспаления
• Чем острее протекает воспаление, тем более выражен ацидоз: из компенсированного он быстро трансформируется в некомпенсированный.
• Как правило, [Н+] наибольшая в зоне первичной альтерации, она меньше в прилегающей к ней зоне вторичной альтерации и постепенно снижается по направлению к неповреждённой ткани.
• В отдельных участках интенсивной деструкции и аутолиза тканей, где накапливаются восстановленные органические и неорганические соединения, продукты промежуточного белкового распада (аммиак и его производные), может развиваться более или менее выраженный преходящий алкалоз. Однако, в целом для очага воспаления характерен ацидоз.
Последствия ацидоза
Последствия метаболического ацидоза в очаге воспаления приведены на рис. 5–7.
• Повышение проницаемости клеточных мембран, в том числе плазмолеммы и лизосом приводит к выходу гидролаз в цитозоль и межклеточное вещество.
• Активация лизосомальных ферментов сопровождается усилением деструкции клеточных и неклеточных структур в очаге воспаления.
• Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны.
• Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н+.
• Усиление гидролиза солей и органических соединений ведёт к повышению осмотического и онкотического давления, изменяет коллоидное состояние цитозоля.
• Изменения чувствительности рецепторных структур клеток (в том числе — стенок микрососудов) к регуляторным факторам (гормонам, нейромедиаторам, другим БАВ) сопровождаются нарушениями регуляции тонуса сосудистой стенки. Так, на стадии альтерации в очаге воспаления, как правило, снижается чувствительность рецепторов к адреномиметикам (в частности, к норадреналину) и повышается к холиномиметическим агентам.
В очаге воспаления в большей или меньшей мере повышается осмотическое давление.
Причины
• Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других).
• Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества.
• Поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Последствия
• Гипергидратация очага воспаления.
• Повышение проницаемости сосудистых стенок.
• Стимуляция эмиграции лейкоцитов.
• Изменение тонуса стенок сосудов и кровообращения в очаге воспаления.
• Формирование чувства боли.
Источник
Причинами гиперосмии являются:– повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других); – усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества; – поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Гиперосмия обусловливает:–гипергидратацию в очаге воспаления; – повышение проницаемости сосудистых стенок; – стимуляцию эмиграции в зону воспаления лейкоцитов; – изменение тонуса стенок сосудов и кровообращения ; – формирование чувства боли.
Гиперонкия
Увеличение онкотического давления в воспалённой ткани – закономерный феномен.
Причинами гиперонкии являются: –увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов; – повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами; – выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Основное последствиегиперонкии в очаге воспаления это развитие отёка.
Поверхностный заряд и электрические потенциалы клеток
Альтерация тканей при воспалении ведёт к изменению (как правило —снижению) их поверхностного заряда, а также – мембранных потенциалов возбудимых клеток.
Причинынарушений заряда и потенциалов мембран клеток:–повреждение клеточных мембран, –расстройства энергообеспечения трансмембранного переноса ионов, –ионный баланс во внеклеточной жидкости.
Основные последствияотклонения мембранных потенциалов клеток в очаге воспаления: – изменения порога возбудимости клеток; – колебание чувствительности клеток к действию БАВ (цитокинов, гормонов, нейромедиаторов и других); – потенцирование миграции фагоцитов за счёт электрокинеза (см. рис. 6–20); – стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой (у повреждённых и погибших клеток внешняя поверхность цитолеммы заряжена положительно в связи с избытком на ней К+, Н+ и др. катионов).
Поверхностное натяжение мембран клеток
Для очага воспаления характерно уменьшение поверхностного натяжения клеточных мембран.
Основная причина этого– значительное увеличение концентрации в очаге воспаления поверхностноактивных веществ (фосфолипидов, ВЖК, K+, Ca2+ и некоторых других).
Основными последствиямиуменьшения поверхностного натяжения клеточных мембран при воспалении являются: – облегчение подвижности лейкоцитов (уменьшение поверхностного натяжения плазмолеммы способствует образованию псевдоподий); – потенцирование процесса адгезии фагоцитов к объекту фагоцитоза; – облегчение контакта фагоцитов и лимфоцитов при развитии реакций иммунитета и аллергии.
Коллоидное состояние цитозоля и межклеточного вещества
Изменения коллоидного состояния цитозоля и межклеточного вещества выявляются уже на начальном этапе воспаления.
Причина этого– накопление избытка Н+, K+, Na+, жирных кислот, пептидов, аминокислот, других метаболитов и БАВ (наряду с изменением степени гидратации цитоплазмы) приводит к облегчению переходов цитозоля: «гель – золь». В наибольшей степени такая трансформация характерна для фагоцитов.
Основные механизмы изменения коллоидного состоянияв очаге воспаления: – колебание степени полимеризации макромолекул (гликозаминогликанов, белков, протеогликанов и других); – фазовые переходы состояния микрофиламентов интерстиция. Переход цитозоля в состояние геля происходит при образовании из нитей F–актина упорядоченной структуры (актиновая решётка). Такая структура формируется при перекрестном соединении нитей актина с участием актинсвязывающих белков и при низкой концентрации Ca2+. При увеличении в цитозоле содержания Ca2+ процесс формирования актиновой решётки подавляется, цитоплазма приобретает состояние золя.
Главные последствияизменений коллоидного состояния цитозоля и интерстиция заключается в: – изменении тканевой проницаемости (в основном –стенок микрососудов) и – потенцировании процесса миграции лейкоцитов к объекту фагоцитоза.
МедиаторЫ ВОСПАЛЕНИЯ
Образование и реализация эффектов БАВ – одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений, а также исходы воспаления. Именно поэтому БАВ нередко именуют как «пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
Ы ВЁРСТКА. Таблица: НЕ РВАТЬ, НЕ ПЕРЕМЕЩАТЬ
| МЕДИАТОРЫ ВОСПАЛЕНИЯ — | ||
| • БАВ, образующиеся при воспалении, | ||
| • обеспечивающие закономерный характер его развития и исходов, | ||
| • формирование его местных и общих признаков | ||
Все медиаторы воспаления и их неактивные предшественники образуются в клетках организма. Но их подразделяют на клеточные и плазменные (рис. 6–8).
Ы ВЁРСТКА вставить файл «ПФ Рис 06 08 Виды медиаторов воспаления по их происхождению»
Рис.6–8.Виды медиаторов воспаления.
Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но в не активном состоянии, а в виде предшественников.Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Предложено несколько классификаций групп медиаторов воспаления. Все они содержат в качестве классифицирующих несколько критериев. Рассматриваемые далее медиаторы воспаления подразделены на группы и подгруппы в соответствии со сложившимся на момент написания учебника представлениями. Некоторые пояснения приводятся в тексте этого раздела, а также в статьях «Цитокины», «Хемокины», «Факторы», «Интерлейкины», «Интерфероны», «Лейкоциты», «Макрофаги», «Тромбоциты» (см. «Справочник терминов» на компакт-диске).
Источник

