Функции комплемента в воспалении
Комплемент представляет собой систему взаимосвязанных плазменных белков, играющих существенную роль в развитии иммунных и воспалительных реакций. Состоит по меньшей мере из 18 белков, в том числе из 9 компонентов собственно комплемента, обозначаемых буквой С с соответствующим номером — от С1 до С9. Некоторые компоненты состоят из нескольких отдельных фракций.
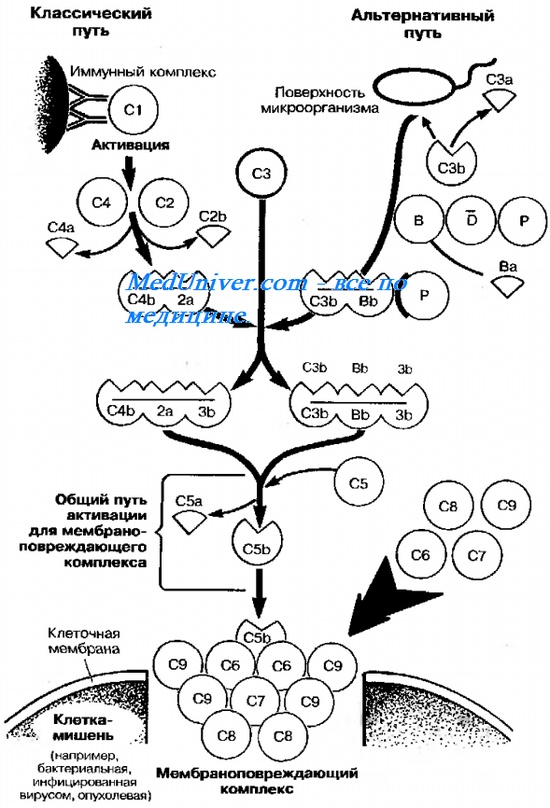
В здоровом организме система комплемента сама по себе неактивна. «Классический путь» ее активирования начинается чаще всего с взаимодействия Clq и иммунных комплексов (конкретно с взаимодействия фракции Clq и фрагмента Fc антитела, входящего в состав иммунного комплекса). Активаторами классического пути могут быть также агрегированный IgG, С-реактивный белок, некоторые вирусы, протеолитические ферменты в достаточной концентрации (плазмин, калликреин, трипсин). Затем происходит последовательное активирование остальных компонентов комплемента в следующем порядке: С1, С4, С2, С3, С5, С6, С7, С8, С9.
Ключевым пунктом считается активирование С3, который содержится в плазме в наибольшем количестве (1200 мкг/мл) и появление в результате этого активирования его важнейшего продукта расщепления С3а, который в свою очередь активирует следующие звенья системы.
Биологические эффекты, оказываемые системой комплемента, зависят от того, насколько далеко зашло ее активирование, и включают усиление фагоцитоза иммунных комплексов и бактерий, увеличенный выход ферментов из лизосом, стимуляцию гистаминообразования и дегрануляцию тучных клеток, повышение синтеза простагландинов и проницаемости капилляров, усиление хемотаксиса нейтрофилов и макрофагов, увеличение иммунного прилипания клеток, нейтрализацию ряда вирусов, сокращение гладких мышц, генерацию супероксидных радикалов, стимуляцию В-клеток.
При полном активировании всей системы комплемента наступает лизис тех клеток, на которых фиксирован активированный комплекс С56789 (схема 1.1). Таким образом, эти эффекты могут вызывать острое или хроническое воспаление, а также серьезно влиять на уже развившиеся воспалительные процессы. Массированное активирование комплемента способно вызывать угрожающий жизни синдром диссеминированного внутрисосудистого свертывания (ДВС).

Схема 1.1. Биологические эффекты активирования комплемента.
Помимо классического пути, существует так называемый альтернативный путь активирования комплемента, начинающийся с активации сразу СЗ, т. е. минуя предшествующую активацию С1, С4 и С2. При этом процесс начинается с взаимодействия С3 и циркулирующих в крови особых белков D, В и Р (пропердин). Активаторами данного пути бывают бактериальные токсины, зимозан, агрегированный IgM, яд кобры и т. д. Кроме того, в процессе классического активирования комплемента один из продуктов расщепления С3—СЗb образует с белком В комплекс, который активирует С3, а тем самым и в целом альтернативный путь (схема 1.2).
Роль комплемента в развитии воспалительного процесса при ревматических заболеваниях особенно убедительна для ревматоидного артрита. Так, у больных серопозитивным ревматоидным артритом в синовиальной жидкости воспаленных суставов снижено содержание общей активности комплемента и ряда его конкретных компонентов — С1, С4, С2, С3, а также двух белков его альтернативного пути — Р и В. Это снижение следует считать результатом повышенного потребления комплемента из-за образования иммунных комплексов, так как одновременно обнаруживались продукты расщепления С4, СЗ и В.
Таким образом, можно полагать, что при данном заболевании происходит активирование комплемента обоими путями — классическим и альтернативным. Достоверное участие комплемента в развитии синовита подтверждается присутствием в синовиальной жидкости также конкретных хемотаксических факторов С5а и С5, 6, 7, а в нейтрофилах суставной полости — иммуноглобулинов в сочетании с Clq, С4 и С3.
При электронной микроскопии изменения мембраны синовиальных клеток больных очень напоминают изменения, полученные в эксперименте в результате полной активации комплемента.
Ранее полагали, что активация комплемента может быть ответственна за острое и подострое суставное воспаление при ревматоидном артрите. Позже было установлено, что продукты системы

Схема 1.2. Классический и альтернативный пути активирования комплемента.
Общие эффекторные реакции обоих путей активирования комплемента способны влиять также на функции лимфоцитов и макрофагов, имеющих существенное значение в развитии хронического иммунного воспаления. Обращает внимание, что врожденный дефицит некоторых компонентов комплемента предрасполагает к развитию некоторых соединительнотканных и инфекционных заболеваний. Так, дефицит С1, С4 и особенно С2 относительно часто сочетается с системной красной волчанкой (СКВ), нефритом, хроническими артритами у детей и васкулитом. Лица с дефицитом «завершающих» компонентов (С5—8) особенно склонны к развитию гонококковой и менингококковой инфекции.
Сопоставление трех рассмотренных биологических систем генерации воспаления позволяет выделить в них ряд общих функциональных компонентов. В каждой из этих систем имееются распознающие белки, факторы проницаемости, хемотаксические факторы и регулирующие вещества. Белками, распознающими адекватный для данной системы пусковой агент, являются Clq—для классического и С3b — для альтернативного пути активирования комплемента, фактор Хагемана — для сопряженной кинингенерирующей, свертывающей и фибринолитической системы, IgE — для системы тучных клеток.
Веществами, повышающими проницаемость сосудов, соответственно являются С3а и С5а, брадикинин, гистамин и SRSA. Они способствуют поступлению в воспаленную область плазменных белков, облегчающих и повышающих дальнейшую генерацию медиаторов воспаления. Выраженными хемотаксическими свойствами в системе комплемента обладают С5а и С5, 6, 7, в системе фактора Хагемана — калликреин, в системе тучных клеток — белковые, липидные и пептидные стимуляторы хемотаксиса нейтрофилов и эозинофилов. Вследствие влияния этих факторов в очаг воспаления привлекаются прежде всего нейтрофилы, играющие огромную роль в дальнейшем поддержании воспаления и в реализации воспалительного повреждения тканей.
Повышение активности одной из систем может приводить к активированию остальных. В частности, С3а, С5а и брадикинин стимулируют выделение гепарина, а плазмин активирует комплемент.
Особый интерес привлекают регулирующие («модулирующие») факторы рассмотренных систем генерации воспаления. Они не только демонстрируют сложность и взаимозависимость этих систем между собой и с другими медиаторами воспаления, но и трудность суждения о каждой из них, исходя только из оценки ее частных показателей. Обращает также внимание, что некоторые из регулирующих факторов действуют по принципу обратной связи.
Так, эффект гистамина усиливается рядом простагландинов. В то же время гистамин по механизму отрицательной обратной связи тормозит освобождение из тучных клеток новых количеств гистамина, что позволяет регулировать его биологические эффекты. Аналогичным образом гистамин стимулирует выделение надпочечниками адреналина, чье сосудосуживающее влияние противодействует его собственному сосудорасширяющему эффекту. К этому следует добавить, что в эксперименте гистамин угнетает проявления кожных иммунных реакций замедленного типа, a in vitro — клеточную цитотоксичность, пролиферацию лимфоцитов (в том числе Т-супрессоров под влиянием конконаваллина А) и продукцию ими лимфокинов.
В кининобразующей системе регулирующую роль выполняют комплекс антитромбин III-гепарин, b2-макроглобулин и a1-антитрипсин, угнетающие активность фактора Хагемана, плазмина и калликреина. Активность брадикинина тормозится кининазой 1, обеспечивающей его эффект преимущественно в местах образования. Если повышенные количества попадают в общий кровоток, то они инактивируются в легких тем же ферментом, который переводит неактивный ангиотензин I в активный ангиотензин II. Последний вызывает генерализованную сосудосуживающую реакцию и стимулирует выделение в кровь альдостерона, т. е. обеспечивает эффекты, противодействующие вазодилатационному влиянию брадикинина.
В системе комплемента для классического пути контролирующую роль играют ингибитор Cl-эстеразы (C1INH) и белок, связывающийся с С4, а для альтернативного пути — белки Н и I, влияющие на активность альтернативной С3-конвертазы. Своеобразно также, что комплемент, который наиболее часто активируется иммунными комплексами, может, напротив, приводить к растворению отложенных в тканях иммунных комплексов. Последние становятся при этом биологически инертными и постепенно катаболизируются.
Для реализации данного феномена требуется избыток комплемента; непосредственное повышение растворимости иммунных комплексов осуществляет СЗb. Все изложенное подчеркивает многоступенчатую и разветвленную взаимосвязь систем, вызывающих и (или) регулирующих воспаление. Очевидно также, что определение активности или содержания одного либо нескольких компонентов этих систем (что, как правило, практикуется в клинических условиях) отнюдь не всегда свидетельствует об однозначном суммарном эффекте функционирования всей системы в целом.
Важнейшая роль клеточных элементов в развитии острого и хронического воспаления заслуживает специального рассмотрения.
Опубликовал Константин Моканов
Источник
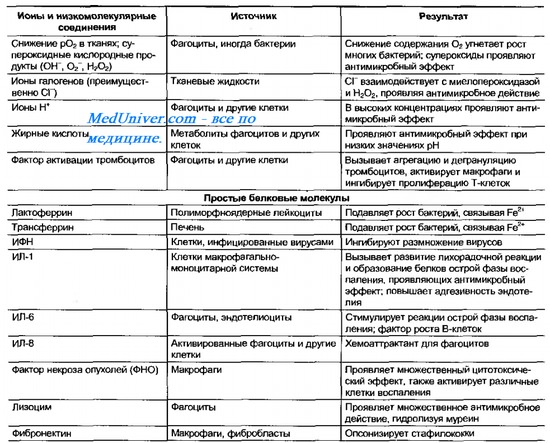
Оглавление темы «Видовой иммунитет. Факторы защиты организма. Фагоцитирующие клетки.»: Факторы иммунобиологической резистентности. Система комплемента. Функции компонентов комплемента. Активация комплемента по классическому пути.Если возбудитель преодолевает поверхностные барьеры, его встречают факторы второй иммунобиологической линии неспецифических защитных механизмов. Такие защитные механизмы принято делить на гуморальные и клеточные. Комплекс конституциональных механизмов защиты тканей — эволюционно древняя форма организованной защиты — предшественник индуцированных (иммунных) реакций. Подтверждением этому служит факт, что значительная часть конституциональных компонентов защиты индуцибельна и находится в тканях в неактивной форме. Их активацию вызывают различные вещества — медиаторы воспаления. Ключевую роль в неспецифической защите внутренней среды организма играют комплемент и фагоцитирующие клетки. Их активность во многом дополняют различные БАВ(табл. 10-2). Таблица 10-3. Компоненты системы комплемента Система комплемента. Функции компонентов комплементаСистема комплемента — группа по меньшей мере 26 сывороточных белков (компонентов комплемента), опосредующих воспалительные реакции при участии гранулоцитов и макрофагов (табл. 10-3). Компоненты системы участвуют в реакциях свёртывания крови, способствуют межклеточным взаимодействиям, необходимым для процессинга Аг, вызывают лизис бактерий и клеток, инфицированных вирусами. В норме компоненты системы находятся в неактивной форме. Активация комплемента приводит к поочередному (каскадному) появлению его активных компонентов в серии протеолитических реакций, стимулирующих защитные процессы (рис. 10-1). Основные функции компонентов комплемента в защитных реакциях — стимуляция фагоцитоза, нарушение целостности клеточных стенок микроорганизмов мембранопов-реждающим комплексом (особенно у видов, устойчивых к фагоцитозу, например гонококков) и индукция синтеза медиаторов воспалительного ответа (например, ИЛ-1; табл. 10-4). Кроме того, система комплемента стимулирует воспалительные реакции (некоторые компоненты — хемоаттрактанты для фагоцитов), участвует в развитии иммунных (через активацию макрофагов) и анафилактических реакций. Таблица 10-2. Основные гуморальные факторы иммунобиологической резистентности организма Активация компонентов комплемента может происходит по классическому и альтернативному путям. Активация комплемента по классическому путиАктивация комплемента по классическому пути комплексами Аг-АТ. Включает поочередное образование всех 9 компонентов (от О до С9). Компоненты классического пути обозначают латинской буквой «С» и арабскими цифрами (C1, C2…C9), для субкомпонентов комплемента и продуктов расщепления к соответствующему обозначению добавляют строчные латинские буквы (Clq, C3b и т.д.). Активированные компоненты выделяют чертой над литерой (например, С2), инактивированные компоненты — буквой «i» (например, iC3b). Первоначально с комплексом Аг-АТ взаимодействует О (субкомпоненты Clq, Clr, С Is), затем к ним присоединяются ранние компоненты С4, С2 и СЗ. Они активируют компонент С5, прикрепляющийся к мембране клетки-мишени (бактерии, опухолевые или инфицированные вирусами клетки) и запускающий образование литического комплекса (С5Ь, С6, С7, С8 и С9). Иначе ок называется мембранопоереждающий (мембраноатакующий) комплекс, так как его образование на мембране вызывает разрушение клетки. Примеры микробных продуктов, активирующих систему комплемента по классическому пути, — ДНК и белок А стафилококков. Рис. 10-1. Активация системы комплемента. Пояснения в тексте. — Также рекомендуем «Активация комплемента по альтернативному пути. Альтернативный путь активации комплемента.» |
Источник
| Фрагмент | Эффекты |
| С5а |
|
| С3а | Анафилатоксин средней силы. Эффекты сходны с С5а, но хемоаттрактантое действие очень слабое. Не активирует ЛОГ. |
| С4а | Слабый анафилатоксин. Эффекты аналогичны С3а. |
| С3b, iC3b |
|
| С4b | То же, что C3b |
| Bb | Способствует маргинации, ингибирует миграцию макрофагов. Активация макрофагов. |
| C2a |
|
Дефициты системы комплемента :
Дефекты системы комплемента могут быть наследственными (дефицит P, I,INH, C1) и приобретенными. Но их клинические проявления, как правило, сходны. Они включают:
Снижение устойчивости к бактериальным инфекциям (нарушение литических и опсонизирующих функций комплемента).
Развитие иммунокомплексных заболеваний (нарушение клиренса ИК).
Например, при системной красной волчанке:
· У пациентов дефецит СR1 (complement recеptor – это ингибитор образования конвертазы альтернативного пути ). Но такой же дефицит и у их клинически здоровых родственников.
· У больных наблюдается вторичный недостаток С3, С2, С4.
· И нарушение протективного действия витронектина ( белок S). Он ингибирует литическую активность комплемента и оказывает антикоагулирующий эффект.
Системная активация комплемента происходит при бактериемии Гр- возбудителями, особенно сальмонеллами,менингококками. Это важный элемент патогенеза инфекционно- токсического шока.
Велика роль расстройств функций комплемента в развитии нефропатий.
Отсутствие DAF и HRF ингибиторов литических функций комплемента на мембранах мутантного клона эритроцитов наблюдается при пароксизмальной ночной гемоглобинурии ( болезнь Маркиафава –Микели). и вызывает кризовый гемолиз.
Дефекты системы комплемента:
| Дефектные факторы комплемента | Клинические проявления и приобретенные причины. |
| С1q,r,s; С4, CR1 | Волчаночный синдром, гломерулонефриты, васкулиты, артриты,эндокардиты, синдром Фелти (ИК-синдромы). Гноеродная инфекция, крупозная пневмония. Системный гипокомплементемический васкулит с волдырной сипью. Приобретенные причины: системная красная волчанка, гломерулонефриты, малярия, СПИД, тромбоэмболическая болезнь, нефротический синдром, гипогаммаглобелинемии. |
| C2 | ИК заболевания. Гноеродная инфекция менее характерна. Приобретенные причины: системная красная волчанка, гломерулонефриты, малярия, вв введение неионных контрастных веществ. |
| ингибитор C1, INH | Семейная аутос.дом. форма ангионевротического отека. Проявляется зональными, стойкими спонтанными и провоцируемыми микротравмой, отеками глубоких слое коди и подкожной клетчатки на конечностях, лице, половых органах. В отличие от анафилаксии нет волдырей. Часто развиваются отек гортани и отеки ЖК. Ингибитор С1 отсутствует ( 1-й тип) или не активен (2-1 тип). Приобретенные причины: лимфопролиеративные заболевания, из-за наличия аутоантител к данному ингибитору. |
| С3 | ИК- заболевания. Гноеродные инфекции, поражения пневмококком, сальмонеллой, синегнойной палочкой. Приобретенные причины: серповидно-клеточная анемия, септический шок, мембранозно-пролиферативная форма хронического гломерулонефрита, кожная замедленная форма порфирии ( активация комплемента и образование анафилатоксинов под действием порфиринов и света), хроническая печеночная недостаточность, нефротический синдром. |
| D | Гноеродная инфекция. Приобретенные причины: ожоги. |
| P | Менингококковая инфекция. Приобретенные причины: ожоги. |
| B | ИК-заболевания. Приобретенные причины : нефротический синдром, спленэктомия, β –талассемия. |
| C5,6,7,8 | Рецидивирующая менингококковая инфекция, ИК заболевания. Приобретенные причины: вирусный гепатит. |
| C9 | Рецидивирующая менингококковая инфекция. Приобретенные причины: вирусный гепатит. |
| MBL (маннан связывающий летктин) | Рецидивирующие бактериальные инфекции. Приобретенные причины: сепсис. |
50. Физико-химические и биофизические изменения в очаге воспаления. Значения работ Г. Шаде в развитии учения о воспалении. Роль эндогенных окислителей как медиаторов воспаления. Формирование воспаления в фило и онтогенезе. Особенности воспаления на разных стадия онтогенеза.
Г. Шаде (1923) изучил молекулярные изменения в очаге воспаления, после того как И.И. Мечников, Ж. Борде (1894) и П. Эрлих (1904) изучили иммунные аспекты воспаления. Шаде охарактеризовал следующие изменения в очаге воспаления:
Местный ацидоз
гиперосмолярность
накопление ионов калия в интерстиции
увеличение тканевого гидростатического давления
С позиции Шаде узловую роль играет «пожар обмена» — резкая активация метаболизма в очаге воспаления. Гиперметаболизм приводит к:
повышению местной температуры
гидролизу крупных молекул, ведущее к повышению осмолярности (возрастает число молекул)
Эндогенные окислители принимают активное участие во вторичной альтерации, где и являются медиаторами, к ним относят кислородные и кислород-галогеновые радикалы, лизосомальные гидралазы, оксид азота. Эти в-ва оказывают мощный неселективный цитотоксический эффект как на клетки паразитов и бактерий, так и на собственные клетки, защита которых определяется потенциалом актиоксидантной системы. В основе их действия лежат механизмы свободно-радикального некробиоза. Являются физиологическими метаболитами, образуются в ЭПР с участием цитохрома P450, при функционировании митохондрий с участием убисемиихинона, в лизосомах и пероксисомах под действием мембранных НАДФH-зависимых оксидаз. АКР (активные кислородсодержащие радикалы) могут взаимодействовать с сульфгидрильными группами белков, изменяя биологические функции ферментов и рецепторов. Благодаря этому они могут изменять активность факторов транскрипции и тирозиновых протеинкиназ, влиять на скорость связывания цитоплазматического кальция с кальмодулином и на активность кальциевой АТФазы.
Также АКР способны окислять арахидоновую кислоту, что приводит к образованию эйкозаноидных медиаторов воспаления. Ферменты — Циклооксигеназа (простогландинов тромбоксана), Липооксигеназа (лейкотриены, HETE — гидроксиэйкозатетраеновая кислота). Также через образование АКР действуют ФНО и другие цитотоксические агенты. Ферменты — Супероксиддисмутаза, миелопероксидаза фагоцитов.
Еще АКР причина реперфузионных нарушений при инфаркте миокарда.
Филогенез:
Развитие «орудий» воспаления восходит к бессосудистым существам. Воспалительная реакция здесь складывалась как чисто пролиферативная; ее и следует считать филогенетически древнейшей.
Ho и при появлении сосудов (дождевой червь, тритон, аксолотль, улитка), воспалительная реакция продолжала оставаться такой же, т.е. протекала без видимого участия сосудов. Только в дальнейшем, когда дифференцировались основные структурные элементы сосудов, эндотелий и происходящие из него адвентициальные клетки (у головоногих), развивается феномен эмиграции, способность к нагноениюи т.д. Дальнейшее усовершенствование воспалительной реакции осуществлялось не только за счет увеличения числа «орудий» (пролиферация и эксудация нарастали лишь в отношении их интенсивности), но и за счет ускорения темпов всего процесса, повышения «готовности» организма развитию воспаления и умножения вариантов его течения (нормергия, гипо-и ги- перергия). Bce это богатство вариаций отмечается уже у теплокровных и обусловлено усовершенствованием иннервации, а также повышением общей реактивности всех структур благодаря возрастающей лабильности клеточных, сосудистых и гуморальных реакций. По существу же, как указывал И. И. Мечников, это все «разные ступени одного непрерывного процесса».
Сравнивая скорость развертывания воспалительной реакции и ее относительную яркость у млекопитающих с таковыми у более ранних филогенетических форм, Рессле характеризует эту реакцию в последнем случае как искуственно, кинематографически растянутую.
Усложнение воспалительного процесса в филогенезе шло не только за счет увеличения «орудий», с помощью которых процесс осуществляется (клеточная пролиферация, эксудация, иннервационные, в основном вазомоторные механизмы, обменные, ферментативные реакции и т. д.), но и за счет образования новых, более тесных связей между «местным», т.е. очагом воспаления, и «общим», т. e. организмом. Эти связи не нарушают принципа автоматизма развития процесса воспаления на месте. Скорее они его обеспечивают, придавая индивидуальные черты каждой ответной реакции организма на возникшее повреждение. Очевидно, что у млекопитающих, а тем более у человека, диапазон этих черт должен быть особенно разнообразен, отражая разнообразие факторов внешней среды и все разнообразие функциональных систем организмов.
Онтогенез:
Продуктивный компонент воспалительной реакции, особенно со стороны мезенхимальных элементов кроветворного и стромального ряда, начинает формироваться в конце эмбриогенеза и в раннем периоде фетогенеза, когда происходит дальнейшая дифференциация тканей органов. Воздействие инфекционных патогенных факторов на материнский организм и плод приводит в этом периоде к формированию так называемых мезенхиматозов в виде пролиферации миелоидной ткани, диффузного фиброза селезенки и печени при врожденном сифилисе, фиброэластоза миокарда, фиброза стромы поджелудочной железы в сочетании с разрастанием жировой ткани.
В позднем фетальном периоде, соответствующем 28 неделям беременности, когда завершается формирование большинства органов плода, воспаление характеризуется не только альтеративно-пролиферативным характером, но и присоединением реакции микроциркуляторного русла.
Характерной особенностью воспалительного процесса в фетальном периоде является отсутствие эффективных местных механизмов защиты, обеспечивающих формирование барьеров, в связи с чем возникают быстрая генерализация инфекции и ареактивные некрозы в различных органах и на слизистых оболочках с развитием множественных эрозий слизистых. Образование обширных некрозов с последующим возникновением диффузного глиоза в головном мозге отмечается при инфицировании плода вирусом герпеса 2-го типа, а при возникновении токсоплазмоза в мозге формируются многочисленные кисты, содержащие зернистые шары и псевдоцисты. В то же время при названных инфекциях обнаруживаются признаки генерализации процес-сса в виде очагов некроза в паренхиматозных органах.
Инфицирование плода нередко характеризуется и формированием гранулем, не имеющих, как правило, «специфического» характера (Серов В.В., Пауков В.С., 1995). При врожденном туберкулезе гранулемы не содержат типичных клеток Лангханса и эпителиоидных клеток, характеризуются интенсивным казеозным распадом, по периферии гранулем формируются миело-цитарный и моноцитарный барьеры. При врожденном сифилисе развитие мезенхиматоза сочетается с образованием милиарных гранулем, лишенных гигантских и плазматических клеток.
Таким образом, воспалительная реакция начинает формироваться в раннем фетальном периоде в виде так называемых «пролиферативных» мезенхиматозов в сочетании с врожденными пороками развития.
В позднем фетальном периоде преобладают альтеративно-проли-феративные сдвиги в зоне воспаления, возникают очаги некроза, формируются гранулемы, содержащие значительные количества возбудителей. В этот период развития плода еще не сформированы в достаточной мере специфические иммунологические механизмы защиты, местные механизмы резистентности. Фагоцитоз носит незавершенный характер, в связи с чем зона воспаления не выполняет барьерной функции, не обеспечивает элиминации возбудителя, что приводит к быстрой генерализации инфекции, развитию множественных очагов некроза в различных органах и тканях (Гуревич П.С., Барсуков В.С.,1982).
Касаясь особенностей развития воспаления у новорожденных, следует отметить уникальную нозологическую форму патологии, так называемую флегмону новорожденных. Заболевание индуцируется стрептококковой и стафилококковой микрофлорой, болеют дети первого месяца жизни. Процесс локализуется в поясничной, крестцовой областях, на груди, спине, в подмышечной и затылочной областях. Воспаление начинается в глубине дермы, вокруг потовых желез, затем переходит на окружающие ткани. На коже возникает быстро распространяющийся участок гиперемии, приобретающий вскоре синюшный оттенок, эпидермис на значительном протяжении отслаивается и подвергается некрозу. Воспалительная реакция носит некротический характер, некрозы распространяются на мышечную ткань, а затем на надкостницу и костную ткань. Отмечается незначительная лейкоцитарная инфиль-рация тканей, гнойный экссудат отсутствует.
У детей первых 2-3 месяцев жизни отмечается недостаточность фагоцитоза в связи с незрелостью рецепторного аппарата мембран фагоцитов, отсутствием достаточного количества опсонинов и хемоаттрактантов, в роли которых выступают, в частности, комплемент и иммуноглобулины (Стефани Д.В., Вельтищев Ю.Е., 1996). В связи с этим не формируются нейтрофиль-ный и моноцитарный барьеры, обеспечивающие элиминацию инфекционных возбудителей за счет процессов киллинга и переваривания в фаголизосомах, в отличие от таковых барьеров у взрослого человека.
У детей первых месяцев жизни недостаточен синтез в печени плазменных факторов свертывания крови, преобладают антикоагулянтные механизмы, поэтому отсутствуют явления тромбоза в кровеносных сосудах и, соответственно, фиксация патогенного агента в зоне его инокуляции.
Таким образом, особенностями воспалительного процесса у детей первых месяцев жизни, преимущественно у недоношенных, являются склонность к генерализации процесса в связи с недостаточностью местных механизмов защиты, преобладание альтеративного и продуктивного компонентов воспаления, недостаточность процессов экссудации и связанных с ней механизмов защиты.
Недостаточность формирования местных механизмов защиты, склонность к генерализации инфекции, развитию септического состояния при развитии воспаления могут сохраняться в течение первых лет жизни.
В отроческом периоде, характеризующемся сменой молочных зубов на постоянные, происходят определенные сдвиги иммунного и гормонального статуса ребенка, что и приводит к развитию гиперергических воспалительных реакций типа крапивницы, отека Квинке, бронхиальной астмы и других.
В пубертатном периоде перестройки нервной, эндокринной, иммунной систем организма нередко зона воспаления также в достаточной мере не выполняет своей барьерной функции, что приводит к учащению развития заболеваний инфекционно-аллергической или аутоиммунной природы.
В пожилом и старческом возрасте постепенно подавляются все сферы деятельности человека, преобладают атрофические, дистрофические и склеротические процессы во внутренних органах, снижаются иммунологические механизмы защиты и неспецифическая резистентность. Так, у людей пожилого и старческого возраста возникает недостаточность опсонизирующих факторов, подавляются миграционная способность нейтрофилов, их бактерицидная активность в связи с возрастной недостаточностью ферментативных систем. Снижение фагоцитарной активности по тем же причинам свойственно и мононуклеарной фагоцитирующей системе. Недостаточность фагоцитоза становится причиной длительной персистенции в организме вирусных и бактериальных антигенов, иммунных комплексов, что обусловливает длительное течение воспалительного процесса, приобретающего нередко иммунокомплексную природу.
51. Сосудистые изменения в очаге воспаления. Причины, последовательность и механизмы развития. Патогенез красноты и местного повышения температуры при воспалении. Полипептидные медиаторы воспаления. Группы. Источники, механизмы активации. Кининовая система и нейропептиды. Основные эффекты и роль при воспалении.
Источник