Фактор хагемана в остром воспалении
Фактор Хагемана (XII фактор свертывания крови) представляет собой белок, который участвует в двух важнейших биологических процессах — гемокоагуляции и образовании кининов. Кинины можно рассматривать как относительно низкомолекулярные активные медиаторы воспаления, обладающие одновременно и другими биологическими свойствами (например, способностью вызывать бронхоспазм). Фактор Хагемана оказывается связующим звеном между процессами воспаления и свертывания крови; до его открытия связь этих процессов была гипотетической.
В крови фактор Хагемана циркулирует в неактивной форме. Он активируется при контакте с отрицательно заряженными поверхностями, к которым, в частности, относятся стекло, эластин, почечная основная мембрана и, что особенно важно для ревматологии, суставной хрящ, урат натрия, пирофосфат кальция.
Активированный фактор превращает циркулирующий в крови малоактивный прекалликреин в активный фермент калликреин, который взаимодействует с находящимися в плазме неактивными предшественниками кининов — низкомолекулярным и высокомолекулярным кининогенами. Из последних в результате такого химического взаимодействия образуются кинины, наиболее известным представителем которых является брадикинин.
Кроме того, активированный фактор Хагемана взаимодействует с добавочным количеством его неактивированных молекул, и за счет этого происходит активирование плазменного предшественника тромбопластина (ППТ), который переводит определенное количество протромбина в тромбин и в конечном итоге превращает фибриноген в фибрин, т. е. таким образом осуществляется процесс свертывания крови. Система фактора Хагемана эффективнее активирует калликреин, чем ППТ.
Существуют многообразные пути взаимодействия как между системами кининобразования и свертывания крови, так и внутри каждой из этих систем. Так, калликреин не только участвует в генерации кининов, но и способствует превращению плазминогена в протеолитический фермент плазмин (фибринолизин), расщепляющий, в частности, молекулы недавно образовавшегося фибрина. Считается, что в организме плазмин не образуется без активации фактора Хагемана.
Последний, таким образом, участвует не только в процессе свертывания крови, но и в продукции одного из активных противосвертывающих факторов. Плазмин в свою очередь способен активировать фактор Хагемана. Таким же свойством обладают калликреин (причем эта реакция ускоряется высокомолекулярным кининогеном) и комплекс прекалликреина с высокомолекулярным кининогеном. Примечательно, что активированный плазменный предшественник тромбопластина (ППТа), усиливая процессы свертывания, в то же время превращает плазминоген в плазмин, т. е. уменьшает коагуляционные свойства крови. Этим, по-видимому, объясняются большие возможности для саморегулирования процесса гемокоагуляции.
Система фактора Хагемана генерирует ряд продуктов, имеющих непосредственное отношение к развитию воспалительного процесса. Основным кинином считается брадикинин, который повышает проницаемость капилляров, расширяет артериолы, способствует освобождению гистамина из тучных клеток и повышает синтез простагландинов, рассматриваемых в настоящее время как важные медиаторы воспаления. Калликреин и фибринопептиды, возникающие в результате ферментативного расщепления фибриногена плазмином, усиливают хемотаксис лейкоцитов. Плазмин, кроме того, активирует первый компонент комплемента, расщепляет его третий компонент, превращает проколлагеназу синовиальных клеток в коллагеназу, обладающую деструктивным влиянием на ткани.
Известны физиологические антагонисты ряда биологически активных веществ, участвующих в рассматриваемой системе. Комплекс антитромбина III с гепарином угнетает фактор Хагемана и ППТа. Циркулирующий в крови a2-макроглобулин ингибирует плазмин и калликреин, а a1-антитрипсин—плазмин и ППТа. Активность брадикинина тормозится ферментом кининазой I (она угнетает также активность таких компонентов комплемента, как СЗа и С5а).
Изложенные факты демонстрируют предпосылки для возможных сочетаний воспалительного процесса с расстройствами гемокоагуляции. Последние в виде тромбирования микроциркуляторного русла часто наблюдаются в очагах воспаления. В норме деятельность систем кининообразования и гемокоагуляции протекает сбалансированно, но при качественных или даже чисто количественных изменениях их компонентов равновесие нарушается.
Опубликовал Константин Моканов
Источник
Анестезиолог-реаниматолог Юлия Егорова о синдроме нарушения свертывания крови, который повышает риск тромбозов и спонтанных выкидышей
Дефицит фактора Хагемана (XII фактор свертывания крови) — это редкое (около 1:1 000 000 населения) и наследственно обусловленное нарушение коагуляционного гемостаза. Наследуется этот дефект преимущественно аутосомно-рецессивно, но в единичных случаях — более тяжелых — выявляется аутосомно-доминантное наследование. В иммунологических исследованиях было показано, что синдром Хагемана характеризуется сниженным синтезом фактора Хагемана, а не образованием его аномальных молекул.
В 1954 году в Кливленде (США) гематолог Оскар Ратнов наблюдал пациента Джона Хагемана 37 лет со значительно увеличенным временем кровотечения. Обратив внимание на то, что, несмотря на изменения в коагуляции, пациент перенес хирургическую операцию без значительного кровотечения, Ратнов совместно с биохимиком Эрлом Дэйви установил, какого именно белка не хватало в плазме у этого пациента, заподозрив в этом причину нарушения свертываемости крови. Этот сложный белок и был назван фактором Хагемана, а после того как английский гематолог Роберт Макфарлан в 1964 г. сформулировал каскадную теорию гемостаза, занял в ней место как 12‑й фактор свертывания.
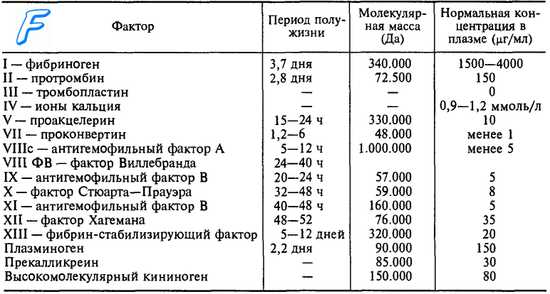
Кровотечение — одно из самых опасных для организма состояний, защита организма от него должна быть как надежной, так и саморегулирующейся, чтобы остановка кровотечения не переходила в распространенный тромбоз. Эту роль выполняют сразу несколько систем — клеточная (тромбоцитарный гемостаз) и сложная система белков плазмы, состоящая из многих взаимосвязанных факторов свертывания:
- I — Фибриноген
- II — Протромбин
- III — Тканевой тромбопластин
- IV — Ионы кальция
- V — Проакцелерин
- VI — Акцелерин — изъят из классификации, так как является
активированным V фактором - VII — Проконвертин
- VIII — Антигемофильный фактор
- IX — Фактор Кристмаса
- X — Фактор Стюарта—Прауэра
- XI — Плазменный предшественник тромбопластина
- XII — Фактор Хагемана
- XIII — Фибринстабилизирующий фактор
- Фактор Флетчера — плазменный прекалликреин
- Фактор Фитцжеральда — высокомолекулярный кининоген
- Фактор Виллебранда — опосредует связывание тромбоцитов с субэндотелием
Фактор Хагемана — сиалогликопротеин — сложное органическое соединение, помимо белковой части включающее в себя олигосахарид и сиаловые кислоты. Сиалогликопротеин синтезируется в печени, далее свободно и «без дела» циркулирует в плазме крови, пока не соприкоснется с отрицательно заряженными поверхностями, например, коллагеном поврежденной ткани или с калликреином, о котором стоит рассказать подробнее.
Калликреин — один из основных функциональных элементов сложной калликреин-кининовой системы, регулирующей процессы воспаления, свертывания крови, микроциркуляции и функции сосудистой стенки.
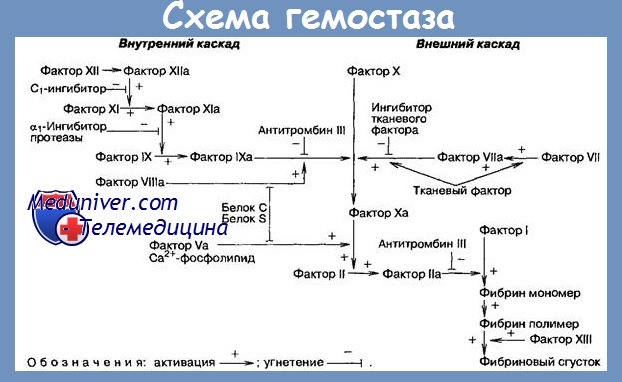
Фактор Хагемана, активированный повреждением ткани, участвует в запуске калликреин-кининовой системы, превращая прекалликреин в калликреин, а калликреин в свою очередь активирует все новые молекулы фактора Хагемана.
Получается петля для каскадного нарастания процесса. За счет этого небольшое количество поврежденных тканей вызывает реакцию в значительной части плазмы крови.
Кроме того, на 12 фактор (Хагемана) в активной форме действует 13 фактор (фибринстабилизирующий фактор), что запускает каскад биохимических реакций среди молекул, исходно присутствовавших в крови, — внутренний путь коагуляции. В отличие от внутреннего пути, внешний запускается попаданием в кровь тканевого тромбопластина из поврежденных тканей.
Таким образом, фактор Хагемана оказывается связующим звеном между процессами воспаления и свертывания крови; до его открытия связь этих процессов была гипотетической.
Клиническая картина
Клинически дефицит 12 фактора свертывания крови проявляется удлинением времени кровотечения без каких‑либо других симптомов нарушения гемостаза. Выраженность удлинения времени кровотечения зависит от типа наследования генетического дефекта. При доминантном типе дефицит выражен сильнее, при рецессивном — частично компенсируется другими факторами свертывания. Время кровотечения увеличено из‑за замедленной инициации каскадной системы свертывания крови. Склонности к патологическим кровотечениям пациенты не проявляют, поэтому заболевание часто не обнаруживают или обнаруживают случайно при лабораторном обследовании или предоперационном скрининге.
Немного парадоксальным кажется то, что при дефиците фактора свертывания проявляют себя не кровотечения, а тромбозы. Например, Джон Хагеман, по имени которого назван фактор свертывания, впоследствии погиб от тромбоэмболии, которой осложнился перелом костей таза. Современные опубликованные клинические случаи оперативных вмешательств у пациентов с синдромом Хагемана, к счастью, заканчивались благополучно. Тромбофилические нарушения связаны с тем, что XII фактор участвует в разрушении тромбов путем активации калликреин-кининовой системы. Активный калликреин не только запускает генерацию кининов, регулирующих воспаление, сосудистый тонус и болевые реакции, но и превращает неактивный белок плазминоген в активный фермент плазмин (фибринолизин), который и растворяет фибриновую часть тромба. Поэтому с дефицитом фактора Хагемана ассоциированы:
- тромбозы
- мигрирующие тромбофлебиты
- тромбоэмболии
- инфаркты
- спонтанные аборты
Диагноз и прогноз
Кроме лабораторных исследований установить диагноз помогут анамнестические данные: склонность к длительным кровотечениям и тромботическим осложнениям у пациента и его родственников, а также положительный симптом Румпеля — Лееде (появление мелкоточечных кровоизлияний дистально от наложенного на плечо жгута). Прогноз при дефиците фактора Хагемана в большинстве случаев благоприятный, лечение не требуется. Коррекции это состояние требует только в связи с хирургическими вмешательствами. В качестве подготовки к операции может быть назначено переливание небольших доз свежезамороженной плазмы.
Период выведения донорского XII фактора — 48–56 ч. Также при наличии этой коагулопатии следует уделять большее внимание профилактике тромботических осложнений: профилактическая компрессия нижних конечностей, УЗИ-контроль состояния вен нижних конечностей и малого таза, особенно при длительном постельном режиме. В послеоперационном периоде для профилактики тромбозов необходимо назначение низкомолекулярных гепаринов, а для терапии кровотечений — отказ от применения ингибиторов фибринолиза, таких как аминокапроновая и транексамовая кислота.
Источник
1. Гомазков О. А., Мещеряков Г. Н.
2. Zweckberger K., Plesnila N.Anatibant, a selective non-peptide bradykinin B2 receptor antagonist, reduces intracranial hypertension and histopathological damage after experimental traumatic brain injury. Neurosci. Lett. 2009; 454 (2): 115—117.
3. Яровая Г. А.Калликреин-кининовая система: новые факты и концепции (обзор). Вопросы медицин. химии 2001; 47 (1): 20—42.
4. Muller F., Renne T.Novel roles for factor XII-driven plasma contact activation system. Curr. Opin. Hematol. 2008; 15 (5): 516—521.
5. Johne J., Blume C., Benz P. M. et al.Platelets promote coagulation factor XII-mediated proteolytic cascade systems in plasma. Biol. Chem. 2006; 387 (2): 173—178.
6. Bossi F., Fischetti F., Pellis V. et al.Platelet-activating factor and kinin-dependent vascular leakage as a novel functional activity of the soluble terminal complement complex. J. Immunol. 2004; 173 (11): 6921—6927.
7. Рябикина Е. В., Черногубова Е. А., Женило В. М., Микашинович З. И.Оптимизация трансфузионной терапии при перитоните. Общая реаниматология 2009; V (1): 24—2
8. Коновалов А. Н., Лихтерман Л. Б., Потапов А. А.Клиническое руководство по черепно-мозговой травме. М.: Антидор; 199 1.
9. Renne T., Gailani D.Role of factor XII in hemostasis and thrombosis: clinical implications. Expert. Rev. Cardiovasc. Ther. 2007; 5 (4): 733—741.
10. Schmaier A. H.Assembly, activation, and physiologic influence of the plasma allikrein/kinin system. Int. Immunopharmacol. 2008; 8 (2): 161—165.
11. Павленко А. А., Епифанцева Н. Н., Чурляев Ю. А., Ситников П. Г.Ан-титромботические механизмы в остром периоде тяжелой черепно-мозговой травмы. Анестезиология и реаниматология 2004; 6: 29—31.
12. BackJ., LangM. H., Elgue G. et al.Distinctive regulation of contact activation by antithrombin and C1-inhibitor on activated platelets and material surfaces. Biomaterials 2009; 30 (34): 6573—6580.
13. Веремеенко К. Н., Голобородько О. П., Кизим А. И.Протеолиз в норме и при патологии. К.: Здоров’я; 1988.
14. Воинов А. Ю., Голевцова З. Ш., Семченко В. В., Говорова Н. В.Повреждение сосудистого эндотелия и нарушение системы гемостаза у больных с тяжелой черепно-мозговой травмой. Омский научн. вестн. 2003; 24 (приложение): 76—80.
15. Davis A. E., Mejia P., Lu F.Biological activities of C1 inhibitor. Mol. Immunol. 2008; 45 (16): 4057—4063.
16. Caliezi C., Wuillemin W. A., Zeerleder S. et al.C1-esterase inhibitor: an anti-inflammatory agent and its potential use in the treatment of diseases other than hereditary angioedema. Pharmacol. Rev. 2000; 52 (1): 91—112.
17. Долгов В. В., Шевченко О. П., Шарышев А. А., Бондарь В. А.Турбиди-метрия в лабораторной практике. М.: Реафарм; 2007.
18. Гуманенко Е. К., Немченко Н. С., Бояринцев В. В. и соавт.С-реактив-ный белок и цитокины при политравме. Общая реаниматология 2007; III (5—6): 19—23.
19. Шевченко К. В., Четвертных В. А., Кравцов Ю. И.Баланс цитокинов при тяжелой черепно-мозговой травме. Анналы неврологии 2009; 3 (2): 14—16.
20. Непорада Е. Л., Воробьева Н. А., Недашковский Э. В.Коррекция дефицита антитромбина III при синдроме диссеминированного внут-рисосудистого свертывания. Общая реаниматология 2008; IV (5): 49—54.
21. Назаров П. Г.Реактанты острой фазы воспаления. СПб.: Наука; 2001.
22. Бокерия Л. А., Климович Л. Г., Потехина А. В. и соавт.Механизмы вовлечения ингибиторов свертывания в развитие воспалительной реакции и перспективные направления антикоагулянтной терапии. Клин. физиология кровообращения. 2004; 1: 46—55.
Источник
Дефект Хагемана — диагностика, лечениеДефект Хагемана врожденное расстройство, передающееся аутосомально-рецессивно, которое происходит благодаря недостатку фактора XII и лишено клинического выражения. Первоначально оно было включено в общее расстройство, носящее название гемофилиоидного синдрома, которое в свою очередь отделилось из общего понятия гемофилии. В 1954 г. Spaet увидел в нем нозологическую сущность, а в 1955 г. Ratnof обособил это расстройство дав ему имя пациента, на котором он его изучил и описал. Оно называется также недостатком контактного фактора. До настоящего времени цитируются в литературе 140 случаев. Частота этого дефекта оценивается в 0,01/100 000. Не сообщилось ни одного случая приобретенного дефекта Хагемана. Патофизиология дефекта Хагемана. Основной дефект этого заболевания состоит в ингибиции генов, индуцирующих синтез Ф. XII и помещающихся на соматических хромозомах. В результате происходит недостаточный синтез Ф. XII, что биологически выражается пертурбацией известных лабораторных тестов, но клинически не дает никаких симптомов. Этот парадокс, кажущийся необъяснимым, повидимому все же имеет свое объяснение: физиологическое значение Ф. XII гораздо больше при коагуляции in vitro чем in vivo, где его удовлетворительно может замещать Ф. XI. (Последний, для активации in vivo нуждается в коллагене и лишь в минимальном количестве Ф. XII; для активации in vitro, он нуждается в гораздо большем количестве Ф. XII, будучи лишенным коллагена).
Генетическая передача — автосомально рецессивная, причем гены имеют малую пенетрацию, что объясняет отсутствие клинического проявления этого заболевания. Встречается в одинаковой пропорции у мужчин и у женщин и не имеет семейного характера. В двух случаях с геморрагическим синдромом мы отметили единокровность родителей. Клиника дефекта Хагемана. В данном случае нельзя говорить о болезни в клиническом смысле этого слова, так как 97% носителей этого расстройства не страдают геморрагиями; более того, многие подвергались малым и средним хирургическим вмешательствам, не проявляя склонности к геморрагиям. Следует однако отметить, что существовало несколько случаев, которые, вследствие крупных хирургических вмешательств представляли необычайно сильные геморрагии. Лабораторное исследование для диагностики дефекта Хагемана показывает:
Положительный диагноз дефекта Хагемана ставится только на основании лабораторных тестов. Чаще всего он бывает результатом простой случайности, когда речь идет о больных, исследуемых по совсем иному поводу. Диагноз основывается на результатах вышеуказанных лабораторных тестов. Дифференциальная диагностика производится идентичным образом, как и при недостатке Ф. XI. Индивидуализация в отношении дефекта Розенталя делается при помощи теста Носселя с «celite-plasma». Эволюция дефекта Хагемана самая благоприятная и лишенная осложнений, из всех известных геморрагических диатезов. Лечение дефекта Хагемана. Практически нельзя говорить о лечении дефекта Гагемана, так как соответствующие пациенты не страдают в клиническом понимании заболевания. Для чрезвычайно редких случаев, в которых может появляться то или иное геморрагическое явление (вследствие операции или очень тяжелой травмы), мы применяем такое же лечение, как и при дефекте Розенталя, с той единственной разницей, что имея в виду, что продолжительность полужизни Ф. XII 52 часа, а биологический эффект одной перфузии держится 48 часов, порядок введения должен быть по одной перфузии через 2 дня. Продолжительность лечения зависит от эволюции данного случая, обычно 6—10 дней. — Также рекомендуем «Дефект фибрин-стабилизирующего фактора (FSF) — диагностика, лечение» Оглавление темы «Коагулопатии»:
|
Источник