Диспротеинемия при остром воспалении на электрофореграмме проявляется
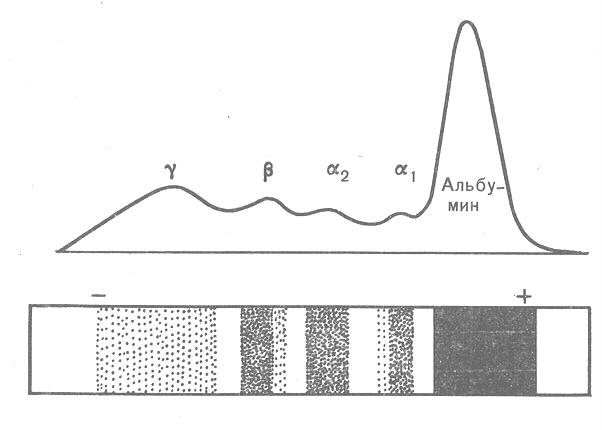
Многие заболевания сопровождаются изменениями белков крови, проявляющимися нарушением их соотношения и
физико-химических свойств. При клинической оценке изменений белкового спектра необходимо принимать во внимание следующие основные принципы (Riva, 1961): 1. Нормальная протеинограмма не является доказательством отсутствия какого-либо, иногда даже тяжелого заболевания. 2. Обнаруженная диспротеинемия даже без клинических признаков свидетельствует о наличии патологического процесса в организме. 3. Протеинограмма имеет диагностическое значение при врожденной аномалии белков, дефектной диспротеинемии и парапротеинемии. 4. Симптоматическая диспротеинемия имеет не диагностическое, а только ориентировочное значение. Это значит, что могут быть выделены отдельные типы протеинограммы (констелляционные типы), которые чаще встречаются при каком-либо заболевании или патологическом процессе. Однако у отдельных больных с одинаковым заболеванием могут наблюдаться изменения белкового спектра различного типа.
Диспротеинемия может быть обнаружена при помощи ряда различных методов исследования белков, информативность которых отличается по объему обнаруживаемых изменений и в отношении характеристики различных параметров измененного белкового спектра.
Патогенез диспротеинемии и парапротеинемии. В зависимости от уровня общего белка сыворотки выделяют нормо-, гипо-и гиперпротеинемию. Гипо- и гиперпротеинемия обычно указывают на изменения в протеинограмме, однако на основании нормопротеинемии нельзя судить об отсутствии изменений в белковом спектре сыворотки. Гиперпротеинемия обычно зависит от увеличения глобулиновых фракций или наличия парапротеинемии. Гипопротеинемия, как правило, обусловлена гипоальбуминемией или гипоглобулинемией. Диспротеинемия постоянно сопровождается снижением уровня альбумина, которое компенсируется гиперглобулинемней и, наоборот, увеличение глобулинов вызывает компенсаторную гипоальбуминемию. В этих случаях снижается альбумино-глобулиновое соотношение. Основные причины, вызывающие изменения белкового спектра крови, можно сгруппировать следующим образом:
1. Факторы, вызывающие гипопротеинемию и снижение отдельных белковых фракций: недостаточное поступление белковых веществ вследствие белкового голодания или нарушенного всасывания белков при хронических заболеваниях пищевого канала; потеря белка из организма вследствие протеинурии, при кровопотере, с экссудатами и транссудатами, с калом при заболеваниях кишечника; повышенный распад тканевого белка при гиперфункции щитовидной железы, злокачественных процессах, истощающих лихорадочных заболеваниях, под влиянием радиации; повреждение органов, участвующих в белковом синтезе (заболевания печени, нарушения лимфоидной системы и системы фагоцитирующих клеток); генетические факторы, вызывающие отсутствие или снижение белковых фракций.
2. Факторы, вызывающие гиперпротеинемию или увеличение одной из белковых фракций: без качественных изменений белковых фракций (диспротеинемия) ― повышенная функция лимфоидной системы и системы фагоцитирующих мононуклеаров при грибковых, бактериальных, вирусных, воспалительных заболеваниях, при иммунологических процессах, аллергии и аутоиммунных заболеваниях, при некротических и дегенеративных процессах, злокачественных новообразованиях, освобождении белковых веществ из разрушенных тканей; появление аномальных белков ― крио- и пироглобулинемия, парапротеинемические гемобластозы (миеломная болезнь, макроглобулинемия, болезнь тяжелых цепей), первичный амилоидоз.
Диагностическое значение электрофоретически определяемых типов диспротеинемии. Изучение сывороточных белков в динамике заболевания дает возможность во многих случаях установить активность и тяжесть патологического процесса. Поэтому электрофоретическое исследование белковых фракций является стандартным лабораторным методом. Чем ниже уровень альбуминов и альбумино-глобулиновый коэффициент, тем тяжелее диспротеинемия и, по-видимому, тяжелее основного заболевания. При некоторых заболеваниях анализ протеинограммы помогает обнаружить скрытые осложнения и указывает на характер патологического процесса. В связи с этим протеинограмма имеет важное значение для суждения о течении и прогнозе заболевания. При большинстве заболеваний диспротеинемия не является строго специфической для данной нозологической формы. У отдельных больных с каким-либо заболеванием могут быть различные изменения белкового спектра сыворотки, что является следствием особенностейиндивидуальной реакции организма, эволюции патологического процесса, сосуществования нескольких заболеваний, при которых происходит интерференция белковой картины.
На основании изучения измененийэлекрофоретических фракций белков плазмы, иногда совместно с флокуляционными пробами, ряд авторов сделали попытки выделить наиболее характерные типы (констелляционные типы) диспротеинемии, чаще всего встречающиеся при отдельных патологических процессах. Ниже приводятся две классификации – одна более сложная (Wuhrmonn, Wunolerly 1957), с изменениями, и вторая простая и легкозапоминающаяся (Riva, 1961), которые, на наш взгляд, имеют наибольшее практическое значение и применение которых вполне достаточно для правильной оценки протеинограмм при различных заболеваниях. Wuhramonn и Wunolerli (1957) предлагают выделить 8 констелляционных типов диспротеинемий: 1.тип острого воспаления — наблюдается при острой инфекции, инфекционных процессах в ранней стадии, пневмонии, экссудативных формах легочного таберкулеза, остром полиартрите, гнойных процессах, сепсисе, остром инфаркте миокарда и некрозе. 2. Тип подострого и хронического воспалительного или пролиферативного процесса – при затихающих инфекционных заболеваниях, пневмонии, хроническом легочном туберкулезе и других хронических инфекционных заболеваниях, хронических цистите, пиелите, холецистите, хроническом эндокардите. 3. Тип хронического воспаления с выраженными процессами иммунизации – встречается при коллагенозах (системная красная волчанка, склеродермия, дерматомиозит, узелковый периартериит), тяжелых аутоиммунных заболеваниях, подостром септическом эндокардите, иногда при тяжелых хронических инфекциях; случаи воспалительных процессов с признаками этого типа воспаления прогностически неблагоприятны. 4. Тип гепатита – развивается при остром гепатите, токсическом поражение печени, гемолитической анемии, а также в некоторых случаях дерматозов, полиартрита и гемобластозов. 5. Тип цирроза печени – характерный для хронического гепатита, билиарного, постнекротического и портального цирроза печени, а также для других заболеваний с преобладанием фиброзных процессов – фиброзно-кавернозного туберкулеза легких, бруцеллеза и других хронических инфекций, некоторых форм полиартритов. 6. Тип механической желтухи — возникает при механической желтухе различного происхождения (желчные камни, опухоли желчных путей или поджелудочной железы, воспалительные или рубцовые процессы). 7. Тип нефроза – свойственный амилоидному или липоидному нефрозу, а также гломерулонефриту, нефросклерозу или диабетической нефропатии с выраженным нефротическим синдромом. 8. Тип злокачественной опухоли – наблюдается при саркоме и раке различной локализации, особенно в стадии метастазирования.
Rivo (1961) в зависимости от преобладания увеличения белковых фракций выделяет 4 типа диспротеинемий: 1)тип — увеличение а или а и в-глобулинов; характерный для нефротического синдрома, амилоидоза, беременности и ее осложнений, острых воспалительных заболеваний; 2) в-тип – увеличение в-глобулинов; наблюдается при остром гепатите; 3)гамма-тип – увеличение гамма- или в- и а-глобулинов; возникает при хронических воспалительных процессах, заболевании печени; 4) смешанный тип – увеличение а- и гамма- или а-,в- и гамма-глобулинов; выявляется при злокачественных новообразованиях.
В практике часто возникают затруднения при попытке отнести протеинограмму к какому-либо типу. Следует помнить, что представленные типы диспротеинемий служат лишь для ориентировки в характерных случаях. В практике «чистые» типы встречаются так же часто, как в клинике «чистые» случаи заболеваний.
Источник
- Термином “диспротеинемия” обозначается группа расстройств, которые развиваются вследствие секреции патологических иммуноглобулинов клоном опухолевых плазматических клеток, происходящих из В клеток. К другим, часто используемым терминам для обозначения диспротеинемий относятся: дискразия плазматических клеток, гаммопатии, парапротеинемии, имглобулинопатии и моноклональные гаммопати. Диспротеинемия диагностируется при определении зубца гомогенного иммуноглобулина на электрофореграмме белков сыворотки (ЭФБс). Повышенный уровень сывороточного глобулина или низкий анионный уровень является обычно ключом к диагностике.
- При исследовании костного мозга можно выявить плазмоцитоз с патологическим НрВР клоном плазматических клеток с разрушением костного вещества. Окончательный диагноз множественной миеломы, болезни “тяжелых цепей” и макроглобулинемии Вальденстрема основывается на наличии этого плазмоцитоза. Доброкачественные гаммопатии не характеризуются вовлечением в процесс костного мозга, и костный мозг обычно остается в норме.
- Для определения класса иммуноглобулина, образующего моноклональный зубец, или М-градиент на ЭФБс, необходимо выполнить иммуноэлектрофорез сыворотки (ИЭФс). М-г радиент может образовываться иммуноглобулинами IgG, IgM, IgD, IgA и IgE; только “легкими цепями” (малой молекулярной массы) или только “тяжелыми цепями” (большой молекулярной массы). Тяжелые и легкие цепи, входящие в состав Шшуноглобулинов, часто синтезируются в неравных количествах опухолевым клоном клеток.
- Легкие цепи синтезируются в избытке и могут выводиться с мочой вследствие своего низкого молекулярного веса Моноклональные легкие цепи, которые обнаруживают в моче в связи с бластной трансформацией плазматических клеток, известны как белки Бенс-Джонса. Развернутый анализ мочи не позволяет определть белок Бенс-Джонса. Его можно обнаружить только при использовании специальной методики, при которой характеристики растворимости белка зависят от нагревания и охлаждения мочи. Электрофорез белков мочи (ЭФБм), вероятно, является лучшим методом определения наличия белка Бенс-Джонса.
- При макроглобулинемии IgM образует градиент на ИЭФс. Первичная макрогло- булинемия или макроглобулинемия Вальденстрема развивается вследствие первичной дискразии плазматических клеток. Протеинурия Бенс-Джонса сопровождает макроглобулинемию Вальденстрема примерно у 10-30% пациентов. Диагноз макроглобулинемии Вальденстрема ставится при наличии характерных клинических признаков: симптомов повышенной вязкости, обусловленной циркуляцией IgM, концентрации IgM, превышающей 3 г/дл, значительного количества плазматических клеток и плазматических лимфоцитов при исследовании костного мозга. К типичным клиническим признакам макроглобулинемии Вальденстрема относятся утомляемость и кровоточен ия, а также неврологические симптомы, главным образом обусловленные повышением IgM вязкости.
- Диагноз множественной миеломы основан на выявлении плазмоцитоза в костном мозге, разрушении опухолевыми клетками окружающих тканей (например, лизиса кости или поражений мягких тканей) и достоверного М-градиента на ЭФБс. IgG составляет М-градиент более чем в 50% случаев миеломы. IgA составляет М-градиент в 25% случаев, и свободные легкие цепи — в 20% случаев. IgM, IgD nlgE образуют М-градиент реже чем в 5% случаев множественной миеломы.
- Иммуноглобулины, обнаруживаемые при миеломе, встречаются так же часто, как они обнаруживаются в крови в норме. Кроме того, примерно у 1% пациентов развиваются плазмоклеточные опухоли, вырабатывающие два или более моноклональных белка, так называемые биклоновые гаммопатии. Наиболее часто при биклональной гаммопатии обнаруживается сочетание IgG и IgA, что встречается примерно в 30% этих случаев.
- Менее чем у 1% пациентов, у которых миелома подозревается по клиническим признакам, но нет лабораторного подтверждения, имеет место миелома “легких цепей”, которые выводятся почками. Миелому бывает трудно диагностировать, если это миелома “легких цепей”, поскольку отсутствует заметный моноклональный пик на ИЭФс. У двух третей пациентов с IgG или IgA миеломой также обнаруживается белок Бенс-Джонса в моче. Этот белок у пациентов с миеломой “легких цепей” можно определить менее чем в 50% случаев. Белок Бенс-Джонса также можно определить в моче пациентов с первичным амилоидозом и примерно у 20% пациентов с макроглобулинемией (см. п. 10).
- Болезнь “тяжелых цепей” представляет собой редкое заболевание, обусловленное секрецией тяжелых цепей или фрагментов тяжелых цепей иммуноглобулина клоном опухолевых клеток. Синтез тяжелых цепей соответствует пяти подклассам иммуноглобулинов. Наличие тяжелых цепей в моче невозможно определить тестом на растворимость, используемым для выявления белка Бенс-Джонса, но ЭФБм помогает обнаружить наличие тяжелых цепей.
- Термином “вторичная макроглобулинемия” обозначается макроглобулинемия, случайно обнаруженная при лимфоме, карциноме, инфекциях и других воспалительных состояниях. Уровень IgM бывает значительно ниже, чем при макроглобулинемии Вальденстрема.

Источник
Содержание белков
в плазме составляет 200-300
г(65-85
г/л), из них 52-65%
составляют
альбумины (М.м.
40-70 тыс. Д),
35,5 % – глобулины и 4 % – фибриноген.
Альбумино-глобулиновый
коэффициент (А/Г) составляет 1,5-2,3.
Альбумины
участвуют
в поддержании коллоидно-осмотического
давления (1
молекула альбумина удерживает в
сосудистом русле 20 г воды) и
сохранении объема циркулирующей крови
(ОЦК), а также используются для построения
белка, то есть выполняют пластическую
функцию и частично транспортную
(переносят кальций, магний, тироксин,
билирубин и др.), 1
молекула альбумина обеспечивает
транспорт 25-50 молекул билирубина).
Глобулины
составляют
23-35%. Среди глобулинов выделяют фракции:α1,
α2,
β,
γ.
Альфа-
и бетта-глобулины выполняют в основном
транспортную функцию. Они образуют
комплексные соединения с липидами,
витаминами, гормонами, лекарственными
веществами.
α1
-глобулины
являютсяуглеводсодержащими
белками (глико-, мукопротеины), гепарин,
гиалуроновая кислота, ферменты, гормоны,
ЛПВП;
кα2
-глобулинам
относятся
церулоплазмин (участвует в транспорте
меди), тироксинсвязывающий белок,
протромбин.
β-глобулины
участвуют
в трантспорте фосфолипидов, холестерола,
триглицеридов, железа (трансферрин).
В составе
γ-глобулиновой
фракции циркулируют иммуноглобулины,
выполняющие защитную функцию, а также
антитела, определяющие групповую
принадлежность крови.
Белки плазмы
принимают также участие в регуляции
кислотно-основного состояния.

Рис.23. Электрофореграмма
белков плазмы крови.
Необходимо
отметить, что 1 г плазменных белков
соответствует 30 г тканевых белков или
150 г веса.
Количественные и
качественные изменения в белковом
составе плазмы (диспротеинемии)
могут проявляться в виде: гипопротеинемии,
гиперпротеинемии и собственно
диспротеинемии.
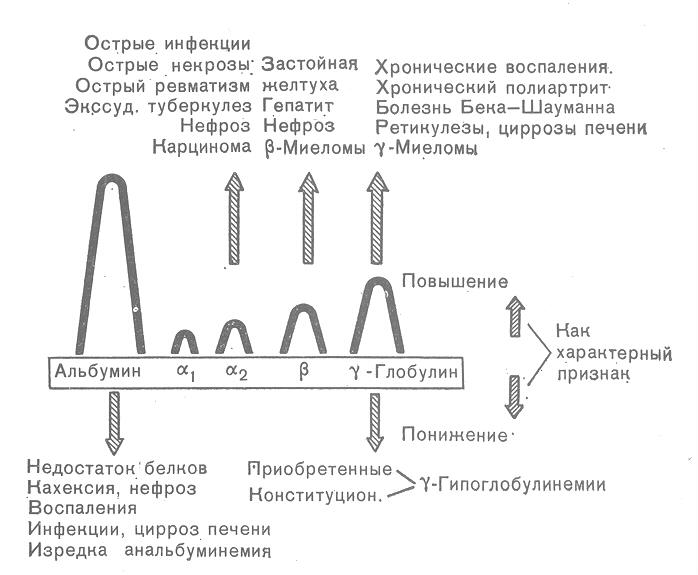
Рис.24.Изменения
электрофореграммы белков плазмы крови
при диспротеинемиях.
Гипопротеинемия
характеризуется пониженным содержанием
белков; гиперпротеинемия – повышенным.
Однако эти показатели не всегда отражают
имеющиеся изменения в белковом составе.
В случаях разнонаправленных изменений
белковых фракций, а также при дефектах
синтеза отдельных белков, концентрация
которых в плазме невелика, суммарное
содержание белков остается неизменным.
В связи с этим получил широкое
распространение термин диспротеинемия.
Причинами
гипопротеинемий может быть недостаточное
поступление белка в организм при
голодании, повреждении желудочно-кишечного
тракта, при гиповитоминозах (В2
и В
6 и др.),
заболеваниях печени (снижение синтеза
альбумина, альфа-глобулина, фибриногена,
протромбина), врожденное или приобретенное
нарушение синтеза отдельных белков
(антигемофильного глобулина и др.),
ускоренный распад белков при лихорадке,
злокачественных новообразованиях,
потеря белков в результате повышения
сосудистой проницаемости при ожогах,
воспалении, при нефрозах и нефритах.
При выраженной
гипопротеинемии возможно образование
отеков.
Характер клинических
симптомов при гипопротеинемиях обусловлен
недостаточным содержанием тех или иных
белков, выполняющих специфическую
функцию. Например, недостаток
антигемофильных глобулинов А или В
приводит к развитию гемофилии, недостаток
трансферрина – к железодефицитной
анемии, недостаток церулоплазмина
нарушает транспорт меди, что приводит
к развитию болезни Вильсона-Коновалова,
характеризующейся отложением меди в
мозге и в печени. Болезнь проявляется
слабоумием и жировой дистрофией печени.
Недостаточное содержание гамма-глобулинов
приводит к иммунодефицитным состояниям.
Относительная
гиперпротеинемия наблюдается при
сгущении крови. Абсолютная гиперпротеинемия
чаще всего обусловлена повышением
гамма-глобулинов, что бывает в период
выздоровления после инфекционных
заболеваний и как компенсаторная реакция
при нарушении синтеза альбумина.
Диспротеинемии.
Этот термин используется не только для
оценки суммарного количества белков в
крови, но и при изменении соотношения
в содержании отдельных белковых фракций
и характеризуется нарушением А/Г
коэффициента.
Диспротеинемии
делятся на три группы:
дисглобулинемия;
дисгаммаглобулинемия;
дисиммуноглобулинемия
(Ig
G,
M,
A,
D,
E).
Дисглобулинемии
характеризуются
изменением соотношения различных
классов глобулинов (α,
β,
γ).
Возможно
увеличение фракции α2-глобулинов
(острые воспалительные процессы,
дифффузные заболевания соединительной
ткани), уменьшение α
и β-глобулинов
отмечается при патологии печени,
уменьшение или увеличение уровня
фибриногена – при острых и хронических
воспалительных процессах.
Дисгаммаглобулинемии
характеризуются
появлением в плазме крови аномальных
белков парапротеинов и криоглобулинов.
Проявление в крови
белков с измененной структурой, не
свойственной здоровому организму,
обозначается как ПАРАПРОТЕИНЕМИЯ.
Парапротеинемия развивается при болезни
Вальденстрема, миеломной болезни.
Макроглобулинемия
Вальденстрема
характеризуется гиперплазией лимфоидного
аппарата в костном мозге, печени,
селезенке, лимфатических узлах и
накоплением в сыворотке крови
высокомолекулярных IgМ.
Молекулярная масса макроглобулина
свыше 1 000 000, что ведет к повышению
вязкости крови и затруднению работы
сердца. Первым и ведущим признаком
болезни часто бывает геморрагический
синдром. Избыток макроглобулина блокирует
гемостаз на разных этапах, ингибируя
факторы свертывания крови. Повышенная
вязкость крови может приводить к
парапротеинемической коме, связанной
с нарушением кровоснабжения в артериолах
и капиллярах головного мозга.
К парапротеинам
относятся С-реактивный белок, который
дает реакцию преципитации с полисахаридом
пневмококков. Этот белок появляется в
крови в острой стадии ревматизма, при
инфаркте миокарда, острых панкреатитах
и является реакцией клеток системы
фагоцитирующих макрофагов на продукты
распада тканей.
Миеломная
болезнь (плазмоцитома)
относится к опухолевым заболеваниям
крови и костного мозга – гемобластозам.
Пролиферирующие в костном мозге клетки
продуцируют остеокластактивирующий
фактор, что приводит к разрушению
костного вещества. Содержание белка в
плазме крови возрастает до 120-180 г/л, в
большинстве случаев ускоряется СОЭ
(60–80 мм/час).
При миеломной
болезни значительно страдают почки
(парапротеинемический синдром). Возникает
упорная протеинурия и явления почечной
недостаточности, в основе которой лежит
реабсорбция парапротеинов и выпадение
их в канальцах. Это наиболее частое и
серьезное проявление парапротеинемии.
Криоглобулин,
выпадающий в осадок при температуре
ниже 40◦С,
появляется в крови при миеломной болезни,
нефрозе, циррозе печени, аутоиммунных
заболеваниях и злокачественных
новообразованиях. Появление в крови
этого белка и выпадение его в осадок
способствует тромбообразованию и
представляет опасность для жизнедеятельности
организма.
Дисиммуноглобулинемия
характеризуется
изменением содержания и соотношения
отдельных классов иммуноглобулинов.
Уменьшение всех классов иммуноглобулинов
(IgG,M,A,D,E)
отмечается при агаммаглобулинемии
(болезнь Брутона). Возможно уменьшение
образования иммуноглобулинов IgM,
IgA
и одновременном повышении образования
IgG
(при селективных гипоиммуноглобулинемиях).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
