Дегенеративные изменения уротелия на фоне хронического воспаления

Выделяют отдельную группу заболеваний мочевого пузыря, которые могут быть результатом острого или хронического воспаления. К ним относятся уротелиальная гиперплазия, реактивные и метапластические изменения уротелия. Гиперплазия уротелия и плоскоклеточная метаплазия характерны для мочепузырного треугольника. Эпителиальная гиперплазия – это доброкачественная пролиферация уротелия в ответ на воспаление или раздражение, характеризуется гистологически нормальным уротелием и увеличением числа слоев клеток уротелия. Реактивные изменения уротелия всегда связываются с острым или хроническим воспламенением в собственной пластинке слизистой и вызываются бактериями, травмой, химическими или токсическими агентами. Клетки уротелия при этом теряют полярность, их размеры и форма не меняются, испытывают недостаток в ядерном хроматине, повреждается ядерная мембрана. Пациенты с реактивными изменениями уротелия не находятся в группе риска перерождения в уротелиальную неоплазию.
Плоскоклеточная метаплазия – это доброкачественное пролиферативное и метапластическое образование, в котором нормальный уротелий замещен неороговевающим плоским эпителием. Она наиболее часто проявляется в виде белесых округлых участков в области треугольника мочевого пузыря у женщин. Является вариантом нормы. При цистоскопии участки плоскоклеточной метаплазии без ороговения выглядят как бледные серовато-белые островки с неровными контурами, чаще всего локализуются в области треугольника и иногда окружены зоной гиперемии. Другой вариант плоскоклеточной метаплазии уротелия характеризуется выраженными признаками ороговения и является лейкоплакией. Лейкоплакия мочевого пузыря обычно развивается как защитная реакция на хроническое воспаление или длительное воздействие повреждающих факторов (конкрементов, катетеров, дренажных трубок). По международной классификации лейкоплакию относят к неопухолевым изменениям эпителия. Тем не менее многие исследователи склонны считать плоскоклеточную метаплазию с ороговением «фоновым процессом для карциномы мочевого пузыря». При лейкоплакии риск развития рака возрастает при условии развития акантоза и дисплазии уротелия. Цистоскопическая картина сформировавшихся очагов лейкоплакии характеризуется наличием серовато-белых или желтого цвета бляшек, возвышающихся над уровнем слизистой оболочки. Применяемые методы оперативного лечения хронического цистита с лейкоплакией мочевого пузыря – трансуретральная резекция, электрокоагуляция, вапоризация.
Практически неотличимые от рака мочевого пузыря по цистоскопической картине изменения могут быть обусловлены так называемой нефрогенной метаплазией уротелия. Речь идет о процессе, морфологическим отражением которого является формирование в стенке мочевого пузыря очагов, напоминающих при микроскопическом исследовании дистальные извитые канальцы почки. Развитие нефрогенной метаплазии принято связывать с травмой мочевыводящих путей, хирургическими вмешательствами на органах таза, проведением внутрипузырной химиотерапии и иммунотерапии (тиофосфамид, вакцина BCG). Клинически нефрогенная метаплазия может протекать бессимптомно или проявляться гематурией и дизурией. Единственным методом исследования, позволяющим достоверно диагностировать нефрогенную метаплазию и отличить ее от опухоли, является биопсия пораженного участка стенки мочевого пузыря. При бессимптомном течении рекомендует ограничиться наблюдением с ежегодным цистоскопическим контролем и цитологическим исследованием мочи, при наличии клинических проявлений выполняют трансуретральную резекцию.
Несмотря на то, что изучению хронического цистита посвящено множество исследований, эпидемиология заболевания свидетельствует об актуальности проблемы. Существует настоятельная необходимость углубленного изучения симптомов, клинических проявлений воспалительных заболеваний мочевого пузыря для усовершенствования диагностики больных хроническим циститом. Выявление корреляции клинических и морфологических проявлений воспалительных заболеваний мочевого пузыря позволит оценить гистоморфологические изменения стенки мочевого пузыря в зависимости от вида воспалительного процесса. Необходимо определить прогностическую значимость биопсии мочевого пузыря у больных неспецифическим циститом и хронической тазовой болью. Понимание патогенеза и клинических проявлений воспалительных заболеваний мочевого пузыря невозможно без детального изучения морфологических изменений.
Источник
Перепечин Д.В., Чернышев И.В., Лощилов Ю.А., Никонова Л.М.
Введение. Уротелиальный рак, рак мочевого пузыря, лоханки и мочеточника является актуальной проблемой современной онкоурологии, что обусловлено высокой заболеваемостью, тяжестью течения, высокой степенью инвалидизации и тенденции к росту распространенности [1,2].
Эффективность лечения уротелиального рака зависит от ранней диагностики, адекватности хирургического лечения, своевременной диагностики рецидивов.
Идеальный метод лабораторной диагностики должен иметь высокую диагностическую точность, высокую воспроизводимость, прогностическую ценность, быть недорогим, простым в исполнении, подходить для раннего выявления опухоли [3,4].
Для диагностики уротелиального рака используется комплекс лабораторных исследований: исследование онкологических маркеров, цитологическое исследование мочи [5,6].
В ряде случаев у больных отмечается наличие сопутствующего хронического воспаления уротелия за счет наличия мочекаменной болезни. Для осуществления дифференциальной диагностики необходимо определить лабораторные изменения, которые могут быть характерными при наличии уротелиального рака [7,8].
Цель исследования. Определить особенности цитологического исследования мочи при коралловидном нефролитиазе.
Материалы и методы. В качестве модели хронического воспаления были взяты пациенты с мочекаменной болезнью при наличии коралловидных конкрементов (N-30). Медиана возраста составила 52 (18-65) года.
У всех пациентов были коралловидные конкременты: конкременты правой почку – у 12 больных, конкременты левой почки у 12, двухсторонний нефролитиаз был в 8 случаях. Ни у кого из пациентов не было онкологических заболеваний в анамнезе.
Всем пациентам было выполнено цитологическое исследование мочи, общий анализ мочи и посев мочи, компьютерная томография (КТ) брюшной полости с контрастированием, ультразвуковое исследование (УЗИ) брюшной полости и забрюшинного пространства перед операцией.
Всем пациентам проводилось перкутанная нефролитолапаксия, методика, которой включает цистоскопию и пиелокаликоскопию. Признаки наличия опухоли были критерием исключения.
Цитологический анализ осадка мочи проводили в препаратах, окрашенных по Романовскому-Гимзе в автоматическом режиме на аппарате эмкостейкер–авто (АФОМК8-Г-01). Затем окрашенные препараты анализировали на светооптическом микроскопе с регистрацией изображения цифровой фотокамерой Leica DFC 320, в соответствии с международными стандартами.
Посев мочи был положительный в 10 случаях; титр возбудителя варьировал 104-107. Высеянные возбудители – e.coli; e.faecium, proteus mirabilis, psevdomonas aureginosa, serratia marcescens, kl. рneumoniae.
Медиана среднего количества эритроцитов в мл мочи составляла 35 (8-3000), лейкоцитов 998,3 (12 — 17581), клеток уротелия 3 (1-30) соответственно.
Результаты и обсуждение. Анализ цитологических препаратов показал, что в осадке мочи исследуемой группы больных обращает внимание постоянное присутствие дисморфных, нередко увеличенных размеров, эритроциты.
В большинстве случаев эритроциты имеют характер так называемых «выщелоченных» клеток. Во всех препаратах присутствуют лейкоциты, с преобладанием лизированных нейтрофилов.
Значительно присутствие пикноморфных клеток, т.н. «сморщенных» нейтрофилов, которые необходимо дифференцировать от клеток лимфоидного ряда.
Переходный эпителий (уротелий) реагирует на патологические изменения в органе (нефролитиаз) дистрофическими нарушениями. Главным образом это отёк и вакуолизация цитоплазмы клеток.
Изменяются и тинкториальные свойства эпителиоцитов. Появляется гиперхромия цитоплазмы, сочетающаяся с нарушением ядерно-цитоплазматических отношений. Происходит увеличение размеров ядер, однако кариолемма сохраняет ровные, округлые очертания. Достаточно часто встречаются 2-х и 3-х ядерные клетки, что косвенно свидетельствует о пролиферативных изменениях в уротелии (рис. 1).
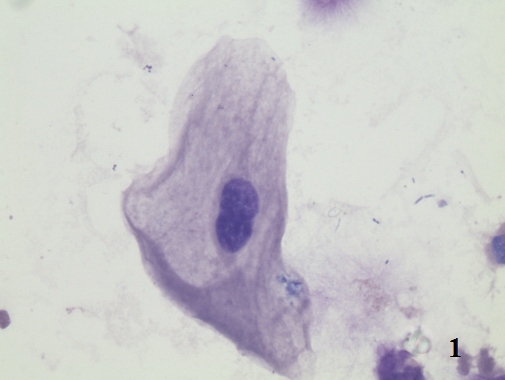
Рис. 1. Цитологический препарат окрашен по Романовскому-Гимзе. Увеличение ок. 10х, об. 100х. Двухядерный эпителиоцит в осадке мочи
Проводя сопоставление результатов цитологического исследования с параллельными клинико-лабораторными методами, возникла необходимость определения присутствия в препаратах атипических эпителиоцитов с признаками дисплазии.
Морфологически процесс дисплазии аналогичен процессу гиперплазии с последующим нарушением дифференцировки и атипией клеток. Это, прежде всего, выражается в «аномальных» изменениях ядер, ядерно-цитоплазматических отношений и изменении тинкториальных свойств клеток. Всё это происходит без признаков дистрофических нарушений и воспаления.
Следует различать дисплазию, как первичную атипическую гиперплазию и дисплазию, как результат регенераторных процессов [9]. В смысле атипической первичной гиперплазии, дисплазия является «предстадией» рака. В нашем исследовании у ряда больных нефролитиазом определялись типичные признаки дисплазии (рис. 2,3).
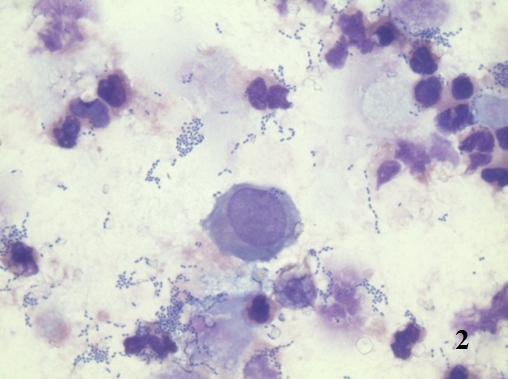
Рис. 2. Цитологический препарат окрашен по Романовскому-Гиммзе. Увеличение ок. 10х, об. 100х. Эпителиоцит с явлениями вакуолярной дистрофии цитоплазмы и пикнозом ядра по типу апоптоза
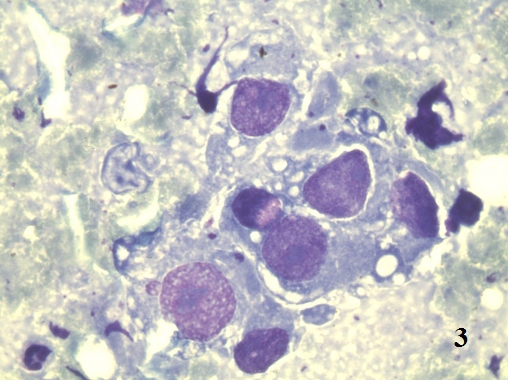
Рис. 3. Цитологический препарат окрашен по Романовскому-Гимзе. Увеличение ок. 10х, об. 100х. Изменение ядерно-цитоплазматического соотношения
В осадке мочи, исследуемой группы больных мы наблюдали небольшие комплексы из клеток переходного эпителия с признаками зрелой метаплазии. Это свидетельствует о компенсаторно-приспособительных изменениях эпителия, через так называемую гистологическую аккомодацию ткани органа.
В настоящее время большинством исследователей принято считать, что плоскоклеточная метаплазия не относится к предраковым состояниям. В цитологических препаратах мы также постоянно обнаруживали элементы солей, чаще всего оксалаты кальция.
Также постоянно и присутствие микрофлоры с преобладанием мелких, кокковых элементов. Часто обнаруживали элементы гриба. Обычно в виде псевдомицелия и бластоспор гриба рода Кандида.
Заключение. Проведённое цитологическое исследование позволяет сделать заключение, что при данном виде нефролитиаза формируется хроническое воспаление, которое сопровождается дистрофическими, десквамативными и метапластическими изменениями уротелия.
В ряде случаев формируются признаки дисплазии уротелия, которую следует рассматривать в комплексе с компенсаторно-приспособительными и воспалительными изменениями уротелия.
Источник
Разработка новых методов диагностики и лечения опухолей мочевого пузыря требует от патологоанатома не только определения нозологической принадлежности новообразования, но и точного установления степени дифференцировки и уровня инвазии опухоли.
От этого зависит прогноз заболевания, а следовательно, и выбор тактики лечения пациента.
Гистологическая классификация ВОЗ опухолей мочевого пузыря, изданная в 2004 г, представляет собой переработанный и дополненный вариант классификации 1999 г.
Значимость классификации заключается в четком определении критериев каждого типа и подтипа опухоли, что позволяет установить направление и уровень дифференцировки клеток.
Выделяют эпителиальные опухоли мочевого пузыря и новообразования мезенхимального происхождения. Доброкачественные новообразования в мочевом пузыре встречаются относительно редко — не более 10%. Злокачественное поражение органа — довольно часто встречающаяся онкоурологическая патология.
У мужчин опухоли мочевого пузыря выявляются в 4 раза чаще, чем у женщин. Новообразования мочевого пузыря составляют 1.5-3% всех злокачественных опухолей и 30-50% опухолей мочеполовых органов. Наиболее часто встречаются в возрасте 40-60 лет.
Гистологическая классификация эпителиальных опухолей мочевого пузыря ВОЗ 2004 г. приведена в табл. 2.1.
Таблица 2.1. Классификация эпителиальных опухолей мочевого пузыря

Слизистая оболочка мочевого пузыря покрыта многослойным эпителием из относительно плоских клеток, похожих на плоский эпителий. В отличие от него поверхностные элементы (зонтичные клетки) крупные и секретируют незначительное количество муцина, как в железистом эпителии. Возможно, по этой причине термин «переходный эпителий» прочно вошел в медицинский лексикон.
Предпочтительный термин для слизистой оболочки мочевого пузыря — «уротелий». Число пластов в нормальном уротелии варьирует от 3 до 7. Увеличение количества клеточных пластов само по себе не есть признак неоплазии, однако чаще встречается в сочетании с атипией ядер и не вызывает проблем при постановке диагноза карциномы.
Собственная пластинка слизистой оболочки — это слой рыхлой соединительной ткани, обычно содержащий немного лимфоцитов и сеть тонкостенных кровеносных сосудов. В правильно ориентированных фрагментах ткани собственная пластинка может быть разделена на внутреннюю и внешнюю зоны, где отделены тонкостенные сосуды и пучки мышечных волокон, принадлежащих мышечной пластинке слизистой оболочки.
Корректная идентификация этих слоев важна для точного стадирования опухолевого процесса. Все поражения мочевого пузыря условно можно разделить на плоские и папиллярные (сосочковые).
Уротелиальная гиперплазия. Urothelial hyperplasia
Гиперплазия — реактивный процесс, сопровождающий воспаление или другие виды повреждения. При гиперплазии отмечается увеличение количества клеточных слоев покровного уротелия (более 7) без атипии клеток. Изредка могут появляться ложные сосочковые структуры. Иногда возникают трудности в дифференциальной диагностике с раком.
Реактивная атипия. Reactive atypia
При остром или хроническом воспалении, инфекции, инструментальных вмешательствах или лечении с внутрипузырным введением различных веществ возникают различные атипические изменения уротелия реактивного характера. Реактивная атипия может сопровождаться утолщением эпителиального пласта или нет. Ядра клеток немного увеличены, мономорфны, могут быть заметные центрально расположенные ядрышки.
Митозы типичные, наблюдаются лишь в базальных отделах эпителиального пласта. Характерна воспалительная инфильтрация, как интраэпителиальная, так и субэпителиальная. Атипия клеток носит реактивный характер и не считается проявлением неопластического процесса.
Атипия/дисплазия. Urothelial dysplasia
Синоним: интрауротелиальная неоплазия низкой степени злокачественности (low-grade intra-urothelial neoplasia).
Любой из этих терминов применяется к атипичному уротелию, в котором цитологические и структурные изменения недостаточны для диагноза карциномы in situ. Иногда данные изменения ошибочно оцениваются как реактивная воспалительная атипия. Первично возникшая дисплазия уротелия может проявляться симптомами раздражения мочевого пузыря с/или без гематурии. Макроскопически чаще отмечается эритема или эрозирование.
Световая микроскопия выявляет клетки с эозинофильной цитоплазмой, неровными ядерными мембранами, единичными ядрышками, редкими митозами. Более выраженный ядерный полиморфизм с заметными ядрышками и наличием митозов должен склонять врача в пользу диагноза карциномы in situ. Градация уротепиальной дисплазии не принята. При иммуногистохимическом (ИГХ) исследовании наблюдается гиперэкспрессия р53 и Ki-67.
Риск рака на фоне дисплазии составляет 15-19% в срок от 4 до 8 лет. Первичная дисплазия уротелия выявляется у пациентов, у которых отсутствует опухоль мочевого пузыря, и в общей популяции встречается довольно редко (6.8% — у мужчин, 5.7% — у женщин). Частота вторичной дисплазии у пациентов с инвазивной уротелиальной карциномой колеблется от 22 до 86%.
Уротелиальная (переходноклеточная) карцинома in situ. Urothelial carcinoma in situ. 8120/2
Синоним: интрауротелиальная неоплазия высокой степени злокачественности (high-grade intra-urothelial neoplasia)
Непапиллярное, т. е. плоское, поражение, в котором покровный эпителий содержит клетки с цитологическими признаками злокачественности. Изолированная карцинома in situ выявляется менее чем в 1-3% случаев уротелиальных опухолей, однако в виде фона карцинома in situ встречается в 45-65% инвазивных уротелиальных карцином.
Характеризуется высоким риском прогрессии. Неопластическая трансформация не всегда поражает всю толщину эпителиального пласта, иногда присутствует только в поверхностном либо базальном слое в виде единичных клеток или групп, рассыпанных среди нормальных уротелиальных элементов.
Карцинома in situ можег вовлекать гнезда фон Брунна или структуры кистозного цистита, что может ошибочно трактоваться как инвазивный рак. Карцинома in situ весьма разнообразна по морфологическим характеристикам и может содержать различные участки.
Выделяют следующие варианты мелкоклеточная, крупноклеточная, педжетоидная, с железистой и плоскоклеточной метаплазией. Эпителий довольно хрупкий и нередко повреждается спонтанно или при взятии биоптата. В этом случае остаются только резидуальные раковые клетки на поверхности, так называемая прильнувшая карцинома in situ (рис. 2.1).

Рис. 2.1. «Прильнувшая» карцинома in situ мочевого пузыря. Резидуальные раковые клетки на поверхности. Окраска гематоксилином и эозином. х400
Собственная пластинка слизистой оболочки обычно инфильтрирована воспалительными элементами, в строме обнаруживается отек и полнокровие сосудов При ИГХ-исследовании отмечают ненормальное (по всей толщине эпителиального пласта) распределение цитокератина (СК)20. Повышенная экспрессия р53 может быть связана с прогрессией карциномы in situ. Анализ ДНК выявляет анеуплоидные клеточные популяции. Возникшая de novo карцинома in situ значительно реже переходит в инвазивный рак (7-15%), чем вторичная (45-65%).
Уротелиальная (переходноклеточная) папиллома. Urothelial papilloma. 8120/0
Уротелиальная папиллома составляет 1-4% всех папиллярных поражений мочевого пузыря, возраст пациентов, как правило, более 50 лет. Опухоль имеет крайне низкий риск рецидива и малигнизации, рецидивирует лишь в 8% случаев. Редко может быть распространенной (диффузный папилломатоз).
Микроскопически представляет собой сосочковую опухоль с рыхлой фиброваскулярной стромой, покровом из уротелия, практически неотличимого от нормального, с хорошо определяемыми зонтичными клетками. Могут встречаться редкие типичные митозы с локализацией в базальных отделах эпителия. Иммуногистохимически выявляется СК20, который локализуется в поверхностных (зонтичных) клетках, как и в нормальном уротелии. Альтерации гена ТР53 не наблюдается.
Уротелиальная (переходноклеточная) папиллома, погружной тип. Inverted urothelial papilloma. 8121/0
Синонимы: эндофитная папиллома, инвертированная папиллома
Опухоль обладает теми же характеристиками, что и уротелиальная папиллома, но эндофитный компонент преобладает над экзофитным. Составляет менее 1 % всех новообразований мочевого пузыря, обычно выявляется у пациентов в возрасте 60-70 лет, характеризуется доброкачественным клиническим течением, рецидивирует менее чем в 1 % случаев, чрезвычайно редко озлокачествляется. Большинство этих образований одиночное, на ножке или на широком основании, с преимущественной локализацией в области шейки мочевого пузыря или треугольника.
Покровный эпителий чаще нормального гистологического строения. Имеются инвагинаты эпителия в основу и отдельные отшнурованные комплексы пролиферирующего уротелия (рис. 2.2).

Рис. 2.2. Инвертированная урателиальная папиллома мочевого пузыря. Инвагинаты и отшнурованные комплексы пролиферирующего уротелия в основе. Окраска гематоксилином и эозином. х50
Эти комплексы могут залегать глубже собственной пластинки слизистой оболочки, но не в мышечном слое стенки. В центре комплексов эпителий обычно веретеновидный, могут встречаться плоскоэпителиальные участки, реже — железистые структуры с перстневидными клетками. Митозы крайне редки. Некоторые опухоли бикомпонентны и представлены структурами как экзофитной, так и инвертированной папилломы. Описаны трабекулярный и железистый подтипы инвертированной папилломы.
Плоскоклеточная папиллома. Squamous cell papilloma. 8052/0
Очень редкое доброкачественное одиночное сосочковое образование мочевого пузыря, встречается у женщин пожилого возраста без специфических симптомов. Не отличается по строению от плоскоклеточных папиллом других локализаций, обычно не связано с папилломавирусной инфекцией, но иногда может иметь морфологические признаки остроконечной кондиломы в виде койлоцитов.
В этих случаях при гибридизации in situ выявляют ДНК вируса папилломы человека 6 го или 11-го типа, как правило, сочетаются с кондиломатозом уретры или связаны с длительно существующей цистостомой и катетером в мочевом пузыре.
Ворсинчатая аденома. Villous adenoma. 8261/0
Синоним: виллезная аденома
Доброкачественная экзофитная опухоль с папиллярными структурами, представленными железистым эпителием кишечного типа, идентична по строению ворсинчатой аденоме толстой кишки. Ядра клеток темные, вытянутой формы, расположены базально. Появление стромальной инвазии свидетельствует об озлокачествлении.
В отличие от других форм железистой метаплазии обладает злокачественным потенциалом Обычно выявляется у пожилых пациентов (средний возраст 65 лет), чаще локализуется по ходу урахуса или в области треугольника. Иммуногистохимически в ворсинчатой аденоме выявляется СК20 (100% случаев), СК7 (56%), раково эмбриональный антиген (СЕА) (89%), эпителиальный мембранный антиген (ЕМА) (22%).
Нефрогенная аденома. Nephrogenic adenoma
В большинстве случаев развитие опухоли связано с оперативным вмешательством, травмой, циститами и мочекаменной болезнью. При цистоскопии нефрогенная аденома может ошибочно приниматься за рак, так как в большинстве случаев представлена папиллярным или полиповидным образованием. Размер редко превышает 4 см.
При микроскопическом исследовании выявляются тубулярные и кистозные или папиллярные и полиповидные структуры (рис. 2.3-2.6). Ядерной атипии и митозов обычно не наблюдается, хотя при дегенеративных изменениях атипия возможна.

Рис. 2.3. Нефрогенная аденома мочевого пузыря Кистозные структуры в аденоме. Окраска гематоксилином и эозином. х50

Рис. 2.4. Нефрогенная аденома мочевого пузыря. Тубулярно-кистозные структуры в аденоме. Окраска гематоксилином и эозином. х50

Рис. 2.5. Нефрогенная аденома мочевого пузыря. Тубулярно-кистозные структуры в аденоме Окраска гематоксилином и эозином. х200

Рис. 2.6. Нефрогенная аденома мочевого пузыря. Тубулярные структуры. Окраска гематоксилином и эозином. х200
Папиллярная уротелиальная (переходноклеточная) опухоль низкой степени злокачественности. Non-mvasive papillary urothelial neoplasm ol low malignant potential. 8130/1
Синоним: переходноклеточная опухоль G1
Представляет собой папиллярную опухоль уротелия, сходную с типичной папилломой, но с выраженной клеточной пролиферацией, превышающей 6 слоев в эпителиальном пласте. Хотя подсчет клеточных слоев приблизителен, в этой опухоли их число явно превышает нормальный уротелий; структурная и клеточная атипия минимальны: может быть незначительное нарушение полярности, иногда — митозы, обычно в базальных отделах; зонтичные клетки чаще присутствуют.
В большинстве случаев при цитологическом исследовании атипические клетки не обнаруживают. Эти опухоли, как правило, не переходят в рак. однако у пациентов повышается риск новых папиллярных образований с более высокой тенденцией к малигнизации. В серии 95 наблюдений 35% пациентов имели рецидивы, но без опухолевой прогрессии.
Если у пациентов не обнаруживался рецидив при первой контрольной цистоскопии, то 68% из них жили без рецидива 5 лет. В этих опухолях, как и в папиллярных карциномах, могут быть погружные (инвертированные) структуры. Выявляется в 3 случаях на 100 000 человек в год. При цистоскопии обычно определяется типичное сосочковое образование диаметром 1-2 см.
Опухоль чаще локализуется на боковой и задней стенках мочевого пузыря или около устья мочеточника. Категорический диагноз может быть поставлен только при полном удалении образования, например при трансуретральной резекции, так как биопсия не может дать полного представления обо всех участках новообразования.
Андреева Ю.Ю., Франк Г.А.
Опубликовал Константин Моканов
Источник
