Цитокины и хемокины медиаторы воспаления


Медиаторы воспаления. Цитокины: классификация, механизм действия. Выполнил: Хорьков П. С Преподаватель: Сырнев В. А Екатеринбург, 2012

Медиаторы воспаления. • Биологически активные вещества, которые синтезируются в клетках или в жидкостях организма и оказывают непосредственное влияние на воспалительный процесс. • Клеточные: синтезируются в клетках; Высвобождаются в очаге воспаления; как правило, в активированном состоянии. • Плазменные: синтезируются в клетках; Высвобождаются в плазму крови или в межклеточную жидкость в неактивированном состоянии; активируются непосредственно в очаге поражения.

Клеточные медиаторы воспаления. Клеточные медиаторы Производные жирных кислот и липидов: 1. Простагландины 2. Лейкотреины 3. Липопераксиды Биогенные амины: 1. Гистамин 2. Серотонин Пептиды и белки: 1. Лейкокины 2. Цитокины 3. Ферменты

Пептиды и белки. Цитокины. • • Цитокины — небольшие пептидные информационные молекулы. Цитокины играют важную роль в защитном ответе организма (в том числе иммунном, аллергическом и при воспалении), регулируют дифференцировку, пролиферативную активность и экспрессию фенотипа клеток‑мишеней. К цитокинам отнесены факторы роста, интерлейкины (ИЛ), факторы некроза опухоли, колониестимулирующие факторы, интерфероны (ИФН), хемокины и некоторые другие. • Цитокины не имеют антигенной специфичности биологического действия. Они влияют на функциональную активность клеток, принимающих участие в реакциях врожденного и приобретенного иммунитета. Тем не менее, воздействуя на Т- и В-лимфоциты, цитокины способны стимулировать антигензависимые процессы в иммунной системе.

Общий механизм действия. • Влияние цитокина осуществляется путем его взаимодействия со специфическим мембранным рецептором клетки-мишени. Для цитокинов характерно плейотропное действие, которое объясняется наличием специфических рецепторов на поверхности клеток различного гистогенеза. В большинстве случаев рецепторы для цитокинов представлены одной, двумя или тремя пептидными или гликопротеидными цепями, встроенными в клеточную мембрану. При этом цитокин взаимодействует с внешней, экстрацеллюлярной, частью рецептора. Сигнал о такого рода взаимодействии передается внутрь клетки интрацеллюлярной частью рецептора, которая обладает ферментативной активностью. Эффективность действия рецептора зависит от его аффинности, т. е. от того, какое минимальное количество лиганда необходимо для образования прочного комплекса и как следствие для передачи специфического сигнала внутрь клетки. Как правило, аффинность зависит от числа белковых цепей, входящих в состав рецептора. При этом вторая цепь может быть общей у ряда рецепторов с разной специфичностью.

Провоспалительные цитокины. • • Белки, секретируемые макрофагами и другими клетками в ответ на их активацию микроорганизмами, их продуктами, а также собственно цитакинами. Цитокины способствуют эмиграции лейкоцитов из кровотока в очаг воспаления, а также определяют местные и системные проявления воспалительной реакции.
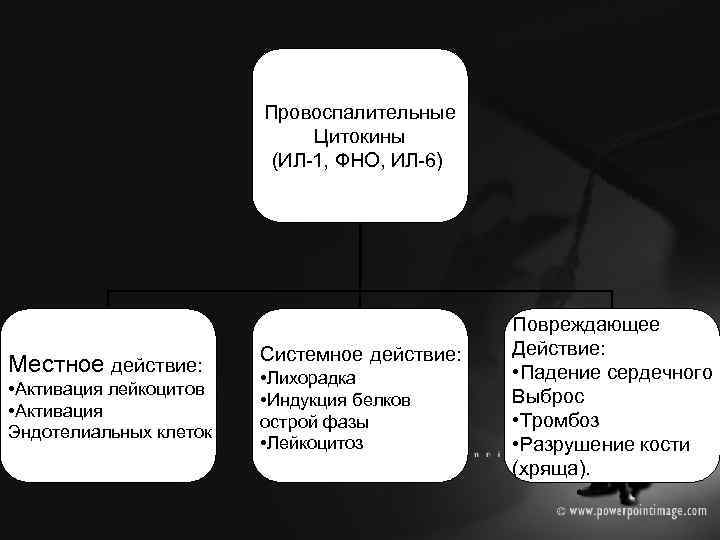
Провоспалительные Цитокины (ИЛ-1, ФНО, ИЛ-6) Местное действие: • Активация лейкоцитов • Активация Эндотелиальных клеток Системное действие: • Лихорадка • Индукция белков острой фазы • Лейкоцитоз Повреждающее Действие: • Падение сердечного Выброс • Тромбоз • Разрушение кости (хряща).
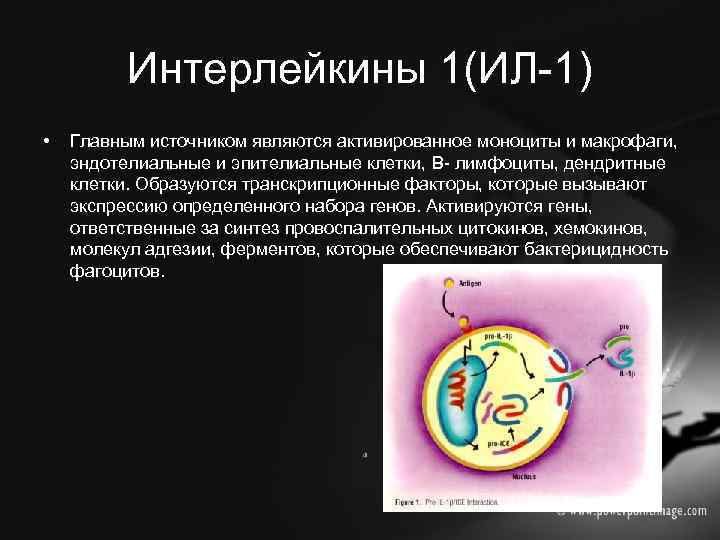
Интерлейкины 1(ИЛ-1) • Главным источником являются активированное моноциты и макрофаги, эндотелиальные и эпителиальные клетки, B- лимфоциты, дендритные клетки. Образуются транскрипционные факторы, которые вызывают экспрессию определенного набора генов. Активируются гены, ответственные за синтез провоспалительных цитокинов, хемокинов, молекул адгезии, ферментов, которые обеспечивают бактерицидность фагоцитов.

Фактор некроз опухоли(ФНО). Основным продуцентом является также служат моноциты и макрофаги. Также принимают участия T и B- лимфоциты, при их вовлечении в воспалительный процесс. • Два типа рецепторов: TNFRI и TNFRII. В зависимости от типа связующего рецептора могут развиваться два типа реакций: апоптоз клетки ее активация, сопровождающаяся экспрессией провоспалительных генов.

Интерлейкины-6(ИЛ-6). • • • Провоспалительный цитокин широкого спектра действия. Способен вызывать комплекс местных проявлений воспаления, усиливая процесс эмиграции и активации фагоцитов. Менее выражен по сравнению с ИЛ-1 и ФНО, но по сравнению с ними, угнетает выработку провоспалительных цитокинов и хемокинов клетками, вовлеченных в воспалительный процесс. Является основным фактором, индуцирующим гены белков острой фазы в гепатоцитах и выработку данных белков.

Хемокины. • • • Представляют собой разновидность цитокинов, обладающих хемотаксической активностью. Действие на фагоциты способствует полимеризации сократительного компонента цитоскелета и направленному движению клетки- хемотаксису. В очаге секретируют резидентными макрофагами после их стимуляции патогеном. Диффундируя в сторону каппиляров и венул, они фиксируются на пептидогликанах, что служит первоначальным сигналом к перемещению лейкоцитов к стенке сосудов.
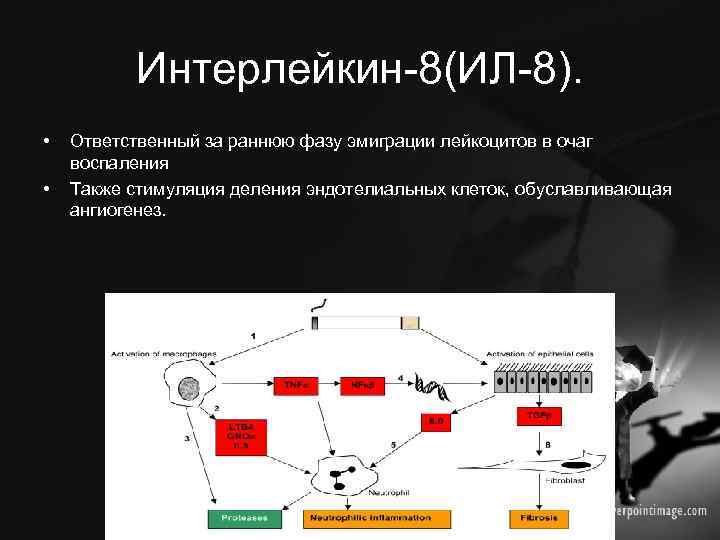
Интерлейкин-8(ИЛ-8). • • Ответственный за раннюю фазу эмиграции лейкоцитов в очаг воспаления Также стимуляция деления эндотелиальных клеток, обуславливающая ангиогенез.

Источник
Хемокины — семейство мелких (от 8 до 10 кДа) белков, которые действуют в основном как хемоаттрактанты для определенных типов лейкоцитов. Идентифицировано около 40 разных хемокинов и 20 разных рецепторов к ним. Хемокины распределены в группы в соответствии с расположением остатков цистеина в матричных белках:
— CXC-хемокины (а-хемокины). Имеют один аминокислотный остаток, разделяющий два первых цистеиновых остатка. СХС-хемокины первично действуют на нейтрофилы. IL-8 — типичный представитель этой группы. Он секретируется активированными макрофагами, эндотелиальными клетками и вызывает активацию и хемотаксис нейтрофилов при лимитированной активности моноцитов и эозинофилов. Самые важные индукторы IL-8 — микробные продукты и другие цитокины, в основном IL-1 и TNF;
— СС-хемокины (b-хемокины). Имеют два первых смежных цистеиновых остатка. К этой группе относятся моноцитарный хемоаттрактантный белок 1 (МСР-1), эотаксин, воспалительный белок макрофагов 1а (М1Р-1а) и хемокин RANTES, экспрессируемый и секретируемый Т-клетками при активации.
СС-хемокины обычно привлекают моноциты, эозинофилы, базофилы и лимфоциты, но не нейтрофилы. Большинство хемокинов этого класса имеют перекрывающиеся эффекты, кроме эотаксина, который селективно мобилизует эозинофилы;
— С-хемокины (у-хемокины). В их структуре отсутствуют два (первый и третий) из четырех ци-стеинов. С-хемокины относительно специфичны для лимфоцитов (например, лимфотактин);
— CX3C-хемокины. Содержат три аминокислоты между двумя цистеинами. Единственным известным членом этого класса является фрактал-кин, существующий в двух формах. Клеточная белковая мембраносвязанная форма может появиться на эндотелиальных клетках под действием воспалительных цитокинов и обеспечивает сильную адгезию моноцитов и Т-клеток.
Вторая форма, растворимая, образуется при протеолизе мембраносвязанного белка и имеет потенциальную хемоаттрактантную активность в отношении тех же клеток.
Хемокины опосредуют свои эффекты через взаимодействие с 7-трансмембранными G-белок-связанными рецепторами. Эти рецепторы (CXCR и CCR для СХС-и СС-хемокинов соответственно) высокоспецифичны, и лейкоцит обычно экспрессирует несколько типов таких рецепторов.
Определенные хемокиновые рецепторы (CXCR4, CCR5) работают как корецепторы для вирусного гликопротеина оболочки вируса иммунодефицита человека типа I и вовлечены в процессы связывания и проникновения вируса в клетку.
Хемокины выполняют две основные функции: стимулируют мобилизацию лейкоцитов в очаг воспаления и контролируют нормальную миграцию клеток в различные ткани. Некоторые хемокины образуются быстро в ответ на стимул воспаления и запускают мобилизацию лейкоцитов в очаг воспаления.
Другие хемокины образуются в тканях постоянно и ответственны за анатомическую сегрегацию различных популяций клеток в тканях. В обоих случаях хемокины могут образовываться в высоких концентрациях, прикрепляясь к протеогликанам на поверхности эндотелиальных клеток и в ВКМ.

— Рекомендуем ознакомиться со следующей статьей «Типы ферментов лизосом лейкоцитов и их функции»
Оглавление темы «Патогенез воспаления»:
- Цитокины участвующие в воспалении
- Хемокины участвующие в воспалении
- Типы ферментов лизосом лейкоцитов и их функции
- Образование нейропептидов и их функции при воспалении
- Система комплемента как плазменно-белковый медиатор воспаления
- Участие системы коагуляции и кининов как медиаторов воспаления
- Исходы острого воспаления
- Фазы острого воспаления и их морфология
- Причины хронического воспаления и его определение
- Морфология (гистология) хронического воспаления
Источник
а) Цитокины. Цитокины — это белки, продуцируемые многими типами клеток (в основном активированными лимфоцитами, макрофагами, эндотелиальными и эпителиальными клетками, а также клетками соединительной ткани) и действующие на другие клетки, модулируя их функции.
Цитокины давно известны как участники клеточного иммунного ответа, обладающие дополнительными эффектами и играющие важную роль в развитии и острого, и хронического воспаления. Их общие свойства и функции обсуждены в главе 6. Здесь мы рассмотрим свойства цитокинов, которые участвуют в развитии острого воспаления.
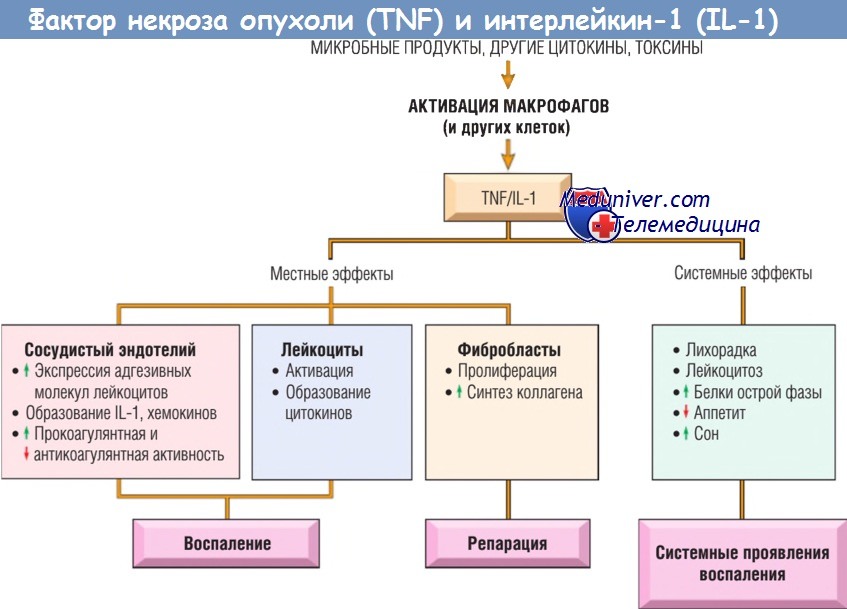
б) Фактор некроза опухоли и интерлейкин-1. TNF и IL-1 — два основных цитокина, опосредующих воспаление. Они продуцируются в основном активированными макрофагами. Секреция TNF и IL-1 может быть простимулирована эндотоксином и другими микробными продуктами, иммунными комплексами, физическим повреждением и различными стимулами воспалительной реакции.
Самая важная функция TNF и IL-1 при воспалении — влияние на эндотелий, лейкоциты и фибробласты, а также индукция системной реакции острой фазы. Они вызывают в эндотелии ряд изменений, называемый активацией эндотелия. В частности, TNF и IL-1 индуцируют экспрессию молекул эндотелиальной адгезии, синтез химических медиаторов (включая другие цитокины, хемокины, факторы роста, эйкозаноиды и NO), продукцию ферментов, ассоциированных с ремоделированием матрикса, и повышают тромбогенность на поверхности эндотелия. TNF усиливает активацию нейтрофилов под действием бактериального эндотоксина.
Продукция IL-1 контролируется мультибелковым клеточным комплексом, называемым инфламмасомой, который реагирует на стимулы микробного происхождения и мертвые клетки. Этот комплекс активирует протеазы, являющиеся членами семейства каспаз и обеспечивающие расщепление вновь синтезированных неактивных предшественников IL-1 до биологически активного цитокина. Мутации в генах, кодирующих члены этого белкового комплекса, являются причиной наследственных воспалительных синдромов, из которых самый известный — семейная средиземноморская лихорадка.

Мутантные белки либо существенно активируют воспалительные каспазы, либо препятствуют негативной регуляции этого ферментативного процесса. Конечным результатом является нерегулируемая продукция IL-1.
При этом заболевании появляются лихорадка и другие системные признаки воспаления без явных на то причин. Со временем у некоторых пациентов развивается амилоидоз — заболевание, характеризующееся внеклеточным отложением белка вследствие персистирующего воспаления. При лечении этих заболеваний эффективны антагонисты IL-1, которые являются примером молекулярной таргетной терапии.
Инфламмасомный комплекс также могут активировать кристаллы мочевой кислоты при подагре (при этом заболевании воспаление частично опосредовано IL-1).
IL-1 и TNF индуцируют системные ответы острой фазы, ассоциированные с инфекционным повреждением. TNF также регулирует энергетический баланс через запуск липидной и белковой мобилизации и подавление аппетита. Длительная продукция TNF приводит к развитию кахексии — патологического состояния, характеризующегося потерей массы тела и анорексией, которое сопровождает некоторые хронические инфекции и злокачественные опухоли.
Другие цитокины, участвующие в остром воспалении. Перечень цитокинов очень длинный и постоянно пополняется. Сейчас проявляется интерес к двум из них: IL-6, продуцируемому макрофагами и другими клетками, вовлеченному в местный и системный воспалительный ответ, а также IL-17, в основном продуцируемому Т-лимфоцитами и запускающему мобилизацию нейтрофилов. Антагонисты обоих цитокинов сейчас изучают в клинических исследованиях.
— Рекомендуем ознакомиться со следующей статьей «Хемокины участвующие в воспалении»
Оглавление темы «Патогенез воспаления»:
- Цитокины участвующие в воспалении
- Хемокины участвующие в воспалении
- Типы ферментов лизосом лейкоцитов и их функции
- Образование нейропептидов и их функции при воспалении
- Система комплемента как плазменно-белковый медиатор воспаления
- Участие системы коагуляции и кининов как медиаторов воспаления
- Исходы острого воспаления
- Фазы острого воспаления и их морфология
- Причины хронического воспаления и его определение
- Морфология (гистология) хронического воспаления
Источник
Белки, больше известные как цитокины, выполняют разнообразные биологические функции и обеспечивают нормальное функционирование организма [44, 101].
История изучения цитокинов началась в середине XX века, когда был обнаружен единственный биологический эффект [101]. Вещество, ответственное за его появление, было названо медиатором [20, 97]. В дальнейшем тщательные исследования были направлены на точное описание биологических эффектов и молекулярного строения этих веществ, которые были названы цитокинами.
Цитокины включают в себя множество медиаторов, но даже сейчас большинство молекул, описанных за последнее время, нумеруются в общепринятой последовательности и не обладают сходными функциональными возможностями. В противоположность цитокины разделяют на провоспалительные, цитокины лимфоцитарного роста, факторы дифференциации и регуляторные цитокины [10].
Зачастую разные типы клеток секретируют один и тот же цитокин, причем один цитокин может воздействовать на несколько разных типов клеток, такой эффект называется плейотропия [145, 158, 172, 180]. Цитокины могут оказывать специфичное или однотипное воздействие на клетки [53, 95]. Синтез цитокинов происходит в рамках каскада метаболических реакций, один тип цитокина стимулирует клетки -мишени, которые продуцируют новые цитокины [59, 90].
Действие цитокинов при этом может быть антагонистичным или обладать определенным потенциалом синергизма [17, 133].
Таким образом, термин цитокин отражает группу белков, которые включают интерлейкины от 1 до 33, интерфероны (IFN), типа I и типа II, эритропоэтин, тромбопоэтин, пролактин, гормон роста, гранулоцитарный колониестимулирующий фактор, гранулоцитарно -макрофагального колониестимулирующегофактора (GM-CSF), лептин, лейкемия ингибирующий фактор (LIF), онкостатин, цилиарный нейротрофический фактор, фактор некроза опухоли (TNF) и некоторые другие [4, 8, 9, 12, 13, 85, 92, 96, 152, 175]. Также следует учитывать, что многие цитокины могут быть полноценно расценены как биомаркеры [154].
Цитокины – эндогенные полипептидные медиаторы, обеспечивающие межклеточное взаимодействие [153]. Цитокины регулируют эмбриональное развитие, некоторые нормальные физиологические функции организма, защитные реакции в случае патогенной инвазии и роста опухоли, обеспечива ют аллергический, аутоиммунный и другие иммунопатологические процессы, учавствуют в репарационных механизмах после травм [60, 67, 91, 102, 113, 117, 120, 148, 163, 174, 196]. Цитокины могут формировать отдельную регуляторную систему, которая наряду с нервной и эндокринной системой помогает поддержать гомеостаз [39]. И эти три системы между собой взаимосвязаны и взаимозависимы [108, 104]. В настоящее время известны более 240 отдельных субстанций, относящихся к цитокиновой системе [101]. Деление цитокинов на группы основано на особенностях их молекулярно-структурной организации. К цитокинам относят интерфероны, интерлейкины, факторы роста и колониестимулирующие факторы, хемокины, медиаторы из группы факторов некроза опухоли, трансформирующие факторы роста и некоторые др угие молекулы [74].
Механическое воздействие на клеточные структуры играет важную роль при изменении уровней цитокинов во внеклеточном пространстве через механогенные вторичные мессенджеры [150, 183].
Исследователями было показано изменение уровней провоспалительных цитокинов при механическом воздействии на различные клеточные культуры [170, 185]. Такое воздействие может быть оказано и при воздействии лазерного излучения на ткани глаза.
По одной из классификаций цитокины подразделяют на 4 группы [101]:
• Факторы гемопоэза (CSF-G, -M, -GM, IL-3 и IL-7, эритропоэтин) – стимуляторы роста и формирования клеток кроветворения.
• Регуляторы естественного иммунитета – провоспалительные цитокины (IFN-α, IFN-β, IL-1 и IL-6, TNF-α, хемокины – IL-8, и др.). Они участвуют в неспецифической защите организма от бактериальных и вирусных инфекций. Их основными мишенями являются клетки-фагоциты – макрофаги и гранулоциты.
• Регуляторы специфических иммунных реакций (IL-2 и IL-4, трансформирующие фактор роста (TGF-β) и др.). Основная функция – участие в активации, пролиферации и дифференцировке функционально зрелых лимфоцитов.
• Регуляторы воспалительной реакции – цитокины, формирующиеся в качестве ответа неспецифической иммунной реакции (INF-γ, лимфотоксин, IL-5, IL-10 и др.). Основная функция этой группы цитокинов заключается в активации неспецифических эффекторных клеток, а именно естественных киллеров и цитотоксических макрофагов.
Оценка уровня цитокинов и корреляционных взаимосвязей концентрации различных цитокинов может решить вопросы необходимости применения той или иной терапии для профилактики возникновения воспалительной реакции и снижения рисков появления или активации триггеров миоза зрачка, осложняющих интраоперационные условия для хирургии катаракты. Понимание изменения уровней цитокинов при разных формах хирургии может предсказать развитие ранних или отдаленных послеоперационных осложнений и привести к правильному выбору медикаментозной терапии в кратчайшие сроки.
В исследованиях Chen Н. и соавт. (2015) ВГЖ исследовалась после проведения ФЛС, где энергия передней капсулотомии составила 6 мкДж , диаметр 5 мм, фрагментация ядра 10 мкДж и роговичные разрезы формировали при использовании энергии 6 мкДж [50]. Для фрагментации ядра хрусталика использовали три радиальных реза и два циллиндрических реза диаметром 5,2 и 3,0 мм соответственно. Исследовали различные цитокины, хемокины и факторы роста. По результатам исследования концентрация FGF-2, IL-1ra, IL-18, LIF и TNF-α была значительно выше в группе пациентов с применением фемтосекундного лазера. Причем IL-9, TNF-β, эотаксин и FGF-β концентрации веществ были значительно ниже в группе с применением ФЛС, чем в контрольной группе. Разницы концентрации других медиаторов между контрольной и исследуемой группой не было выявлено. При проведении корреляционного анализа не выявлена значимая взаимосвязь между временем действия вакуума и концентраций медиаторов в фемто -группе (p > 0,05), а также не найдена взаимосвязь между временем работы лазера и повышением концентрации медиаторов во внутриглазной жидкости.
Тем самым результаты исследования показывают дисбаланс в уровнях цитокинов, хемокинов и факторов роста опухоли в группе после проведенного ФЛС.
Среди девяти цитокинов, уровни концентраций которых были статистически различны между исследуемыми группами, FGF-2, LIF и TNF -α являются факторами, предрасполагающими к развитию вторичной катаракты [141]. Повышение концентрации этих веществ индуциру ет процессы митоза эпителиальных клеток, миграции и трансдифференциации в ранних фазах, а также синтеза коллагена эпителиальными клетками [142]. FGF-2 играет важную роль в пролиферации, миграции и дифференциации нормальных эпителиальных клеток хрусталика [171]. В то время как экспрессия TNF-α в эпителиальных клетках была найдена и в образцах капсулы, полученных после проведения катарактальной хирургии [23] и может индуцировать послеоперационное воспаление и пролиферацию эпителиальных клеток хрусталика.
Показано, что LIF также потенциирует регенерационный и пролиферативный ответ и может индуцировать пролиферац ию эпителиальных клеток хрусталика [43]. Такие результаты дают основание полагать, что увеличение концентрации этих веществ во внутриглазной жидкости увеличивает вероятность развития вторичной катаракты или даже третичной катаракты, но, несмотря на это, первые клинические результаты показали безопасность применения ФЛСФЭ относительно частоты развития пролиферативных процессов в области задней капсулы хрусталика в сроки до 18 месяцев послеоперационно [115].
Дальнейшие исследования в более отдаленные послеоперационные сроки требуются для оценки частоты развития вторичной катаракты и оценки выраженности пролиферации эпителиальных клеток в ответ на повышение уровней медиаторов после ФЛСФЭ.
IL-1ra и IL-18 провоспалительные факторы также были обнаружены во внутриглазной жидкости после ФЛСФЭ. IL-1ra является противовоспалительным цитокином и обеспечивает модуляцию иммунного ответа и регулирует эффекты агониста IL-1 [81]. В экспериментальных исследованиях на крысиной роговице IL-1ra ингибировал активность миофибробластов в процессах заживления [47].
Поэтому справедливо предположить, что высокий уровень IL-1ra во внутриглазной жидкости у пациентов после ФЛСФЭ может привести к ингибированию проведения сигналов от IL-1 и снизить восприимчивость интраокулярных структур к воспалительным процессам, тем самым привести к более низкому проценту возникновения осложнений, связанных с вялотекущими воспалительными явлениями, к примеру, к такому осложнению , как фимоз передней капсулы или структурным изменениям, связанным с фибропластическими явлениями в задней капсуле. По клиническим наблюдениям Panthier и соавт. (2017) пациентов после ФЛСФЭ в отдаленные послеоперационные сроки после проведения ФЛСФЭ было показано, что изменения задней капсулы менее выражено с применением лазерной т ехнологии в сравнении со стандартным капсулорексисом [146]. В противоположность этому, IL-18, провоспалительный цитокин, является Т-лимфоцитом хемокина и может оказывать сильное влияние на нейтрофилы [116].
Было зарегистрированно снижение уровня IL-9, эотаксином, TGF и TNF-β во ВГЖ в группе ФЛСФЭ. IL-9 принадлежит к семейству цитокинов, которые индуцируют пролиферацию активированных Т-клеток, эпителиальных клеток и В-клеток и широко способствуют лимфоцитарной пролиферации, дифференцировкt и выживаемости [79]. Таким образом, некоторые противовоспалительные реакции на Т-клетки могут быть потеряны с понижающей регуляцией этого функционального цитокинового семейства.
Не менее важно, что другие воспалительные цитокины, такие как TNF-β, эотаксин и PDGF-β, также снижались у больных в группе с фемтосекундным лазерным лечением. TNF-β участвует в посредничестве воспалительных реакций и эндотелиальной функции [51]. Эотаксин является хемоаттрактантом для эозинофилов, повышенный уровень которых зачастую выявляют при аллергических заболеваниях и некоторых системных воспалительных заболеваниях [98].
Исследование Hui Chen и соавт. (2015) показало, что пониженные уровни связанных с воспалением медиаторов отражают функциональное нарушение иммунного ответа, связанного с разрушением гемато-офтальмического барьера, увеальной реакции и системной реакции, которые провоцирует ФЛСФЭ [50] и могут потенциировать тем самым миоз.
Таким образом, можно констатировать, что н а сегодняшний день не разработана экспериментальная модель простагландин-индуцируемого миоза, которая необходима для выявления наиболее эффективных схем медикаментозной профилактики интраоперационного миоза, возникающего при выбросе проспалительных факторов во ВГЖ. В контексте применения ФЛСФЭ исследованы уровни концентрации про-, противоспалительных и иммуномодулирующих факторов во ВГЖ, обладающих различными биологическими эффектами. Метаболические же взаимосвязи с участием широкого спектра про-, противовоспалительных и иммуномодулирующих факторов, которые могут помочь определить истинную роль исследуемых цитокинов у пациентов, подвергшихся ФЛСФЭ не изучены. Каково может быть влияние метаболических взаимосвязей на возникновение интраоперационного миоза при ФЛСФЭ, также не описано в доступой литературе. Помимо этого, вследствии того, что интраоперационный миоз может влиять на ход операции, увеличивая ее травматичность и осложняя интраокулярные микрохирургические манипуляции, необходимо детальное изучение влияния ширины зрачка на ход ФЭ после ФЛС, а именно требуется сравнительная оценка гидродинамических параметров, используемых при эмульсификации и аспирации хрусталика глаза при применении различных схем медикаментозной профилактики интраоперационного миоза и дальнейшее подтверждение эффективности проводимого хирургического лечения с помощью верификации сроков медицинской реабилитации пациентов и улучшения клинико-функциональных показателей оперированных глаз.
Источник

