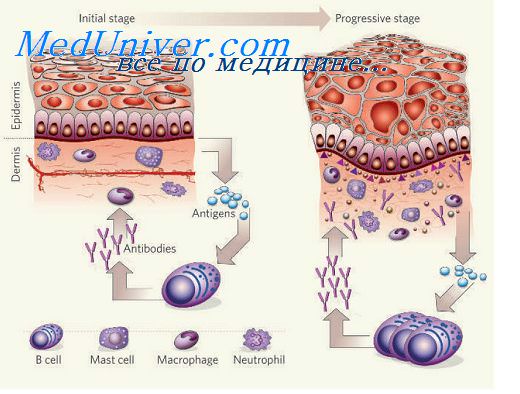
Цитокины адгезии при воспалении

Молекулы адгезии. Роль молекул адгезии при воспалении.Движение лейкоцитов в очаг воспаления начинается с серии адгезионных событий, каждое из которых касается лейкоцитов определенного типа: нейтрофилов, моноцитов или лимфоцитов. Циркулирующие лейкоциты обычно вступают лишь в мимолетные контакты с эндотелиальными клетками посткапиллярных венул: лейкоциты как бы «скользят» по поверхности эндотелия сосудистой стенки. Эта фаза обеспечивается взаимодействием вначале Р-, а затем L- и Е-селектинов с углеводными компонентами мембран клеток. L-селектин экспрессирован на большинстве лейкоцитов. селектин эндотелиальных клеток опосредует адгезию нейтрофилов и моноцитов к эндотелию. Е-селектин экспрессируется на активированных эндотелиальных клетках и поддерживает адгезию лимфоцитов. Лигандами селектинов служат сиалил-фукозилированные олигосахариды в составе многих гликопротеинов и гликолипидов мембран клеток, например, муциноподобные молекулы. Муциноподобный домен содержит клеточная адгезионная молекула — мукозный адрессин (MAdCAM-1), которая за счет взаимодействия с L-селектином обеспечивает возврат лимфоцитов в мукозноассоциированную лимфоидную ткань. Фаза скольжения происходит без активации лейкоцитов, однако скользящие лейкоциты при контактах с поверхностью эндотелия получают сигналы активации, что ведет к их иммобилизации. Наступает вторая фаза прочной адгезии, опосредованная усилением способности лейкоцитарных интегринов связываться с лигандами из суперсемейства иммуноглобулинов на эндотелиальных клетках. В качестве сигналов активации могут служить воздействия цитокинов (хемокинов): MIP-ip, MCP-1, IL-8, MIF, PAF, С5а-фракции комплемента, которые способны связываться с глюкозамингликанами поверхности эндотелиальных клеток и действовать на «скользящие» лейкоциты.
Интегрины — это большое семейство молекул клеточной поверхности, представители которых обнаружены на большинстве типов клеток. Интегрины опосредуют взаимодействие клеток с их микроокружением, обеспечивая адгезию клетка — клетка и клетка — матрикс. Интегрины — это гетеродимеры гликопротеинов, состоящие из различных комбинаций а- и (J- цепей. Описано более 20 разных представителей интегринов. На лейкоцитах экспрессированы: LFA-1, Macl, pl50,95. Лигандами для LFA-1 являются : ICAM-1, ICAM-2, ICAM-3, для Macl -ICAM-1. Эти интегрины опосредуют адгезию к эндотелию нейтрофилов, базофилов, эозинофилов, моноцитов и лимфоцитов. В отличие от нейтрофилов остальные типы клеток могут адгезироваться к цитокин-активированным эндотелиальным клеткам через интегрины VLA-4 к лигандам VCAM-1. На поверхности эндотелиальных клеток лигандами интегринов служат молекулы, имеющие структурную гомологию с иммуноглобулинами. К ним относятся интерклеточные адгезионные молекулы: ICAM-1, ICAM-2, ICAM-3, васкулярно-клеточная адгезионная молекула — VCAM1. Последняя эксирессируется преимущественно на активированных эндотелиальных клетках. Следующая после прочной адгезии стадия трансмиграции лейкоцитов через эндотелий контролируется частично теми же интегринами, взаимодействующими с молекулами ICAM-1, расположенными и на внутренней, и на латеральной, и на базальной поверхности эндотелиальных клеток. Описаны и другие молекулы, облегчающие трансмиграцию лейкоцитов: например CD31 (РЕСАМ-1), обнаруженные и на эндотелиальных клетках, и на тромбоцитах, нейтрофилах, моноцитах, лимфоцитах. За трансмиграцию моноцитов отвечает интегрин CD18, но после активации эндотелиальных клеток под влиянием IL-1 и TNF-a трансмиграция идет при участии интегринов а, взаимодействующих с молекулой VCAM-1. Все стадии адгезии и трансмиграции зависят от активации эндотелиальных клеток, которая проявляется усилением экспрессии на них адгезионных молекул. Экспрессия Е-селектина усиливается в самые ранние стадии воспаления тромбином, гистамином или активированной системой комплемента, и не требует синтеза белка de novo. Роль стимуляторов на этой стадии могут играть различные оксиданты. — Также рекомендуем «Молекулы адгезии в подострой фазе воспаления.» Оглавление темы «Воспаление легких.»: |
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июля 2019;
проверки требует 1 правка.
Цитокины — небольшие пептидные информационные молекулы.
Цитокины имеют молекулярную массу, не превышающую 30 кD.
Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом, от клетки А к клетке В передается сигнал, который запускает в клетке В дальнейшие реакции.
Их основными продуцентами являются лимфоциты.
Кроме лимфоцитов их секретируют макрофаги, гранулоциты, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Термин предложен Стэнли Коэном (англ. S. Cohen) в 1974 г.[1]
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
- провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
- противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
- регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины — антигеннеспецифические факторы, поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники:[2] например, Интерлейкин 1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
См. также[править | править код]
- Фактор некроза опухоли (ФНО, англ. TNF)
- Остеопонтин
Примечания[править | править код]
Ссылки[править | править код]
- Научно-практический журнал «Цитокины и Воспаление»
- Цитокины — причина парадонтита (недоступная ссылка)
- Все о цитокинах — Иммунинфо
Источник
Цитокины при воспалении. Миграцию ингибирующий фактор.Миграцию ингибирующий фактор (MIF) был впервые описан в 60-е годы как продукт активированных Т-лимфоцитов. Только через 25 лет удалось клонировать соответствующий ген, получить рекомбинантный белок и специфические моноклональные антитела. Биологическая активность MIF может быть охарактеризована как негативный хемотаксический эффект: торможение миграции фагоцитирующих клеток (гранулоцитов, моноцитов, макрофагов). Благодаря такому действию этот цитокин участвует в мобилизации фагоцитирующих клеток в очаг инфекции или воспаления на последнем этапе аккумуляции клеток в очаге. Кроме того, у MIF описаны и другие свойства провоспалительного цитокина. Наряду с TNF-a и IL-1 он участвует в каскаде реакций эндотоксического шока, возможно, контролируя уровень TNF-a. Этот цитокин участвует в качестве эффекторной молекулы в развитии клеточного иммунного ответа, реакций ГЗТ. Уровень продукции MIF, как правило, повышается при инфекциях и воспалительных процессах.
Изучение способности мононуклеаров крови к усиленной продукции MIF давно используется в качестве одного из тестов для оценки функциональной активности Т-лимфоцитов и специфической сенсибилизации клеток (реакция торможения миграции лейкоцитов -РТМЛ). В последние годы показано, что продуцентами MIF кроме активированных Т-лимфоцитов могут быть моноциты и макрофаги, которые отвечают продукцией и секрецией MIF, наряду с другими провоспалительными цитокинами, на индукцию ЛПС. Кроме того, пресинтезированный MIF был обнаружен в передней доле гипофиза и была показана способность клеток передней доли гипофиза отвечать продукцией MIF на индукцию ЛПС. Усиленную секрецию цитокина in vivo вызывал кортикотропин-релизинг фактор (CRF), что было расценено как компонент стрессорной реакции. В связи с. этим возникло предположение о том, что MIF может выполнять функции контр-регулятора иммунного ответа по отношению к глюкокортикоидам, которые известны как наиболее сильные ингибиторы воспаления и клеточного иммунного ответа. В физиологических концентрациях глюкокортикоиды индуцируют секрецию MIF макрофагами и Т-лимфоцитами, хотя секрецию других провоспалительных цитокинов те же глюкокортикоиды подавляют. Очевидно, MIF контролирует противовоспалительные эффекты глюкокортикоидов. Так, например, MIF блокировал протективный эффект дексаметазона на модели эндотоксического шока. Показана способность MIF противостоять ингибирующему действию глюкокортикоидов на секрецию макрофагами провоспалительных цитокинов: TNF-а, IL-1, IL-6, IL-8. Уровень MIF может повышаться как следствие глюкокортикоидной терапии. Повышенный уровень MIF контролирует иммуносупрессирующие эффекты глюкокортикоидов: эндогенных или введенных для лечения. Отсюда анти — MIF стратегия может быть полезна для повышения иммуносупрессивного и противовоспалительного действия глюкокортикоидов. — Также рекомендуем «Интерферон — гамма. Значение и функции интерферона гамма при воспалении.» Оглавление темы «Воспаление легких.»: |
Источник
Основные статьи: Цитокины, Воспаление
Действие цитокинов лишь на начальном этапе воспаления ограничивается очагом, а позже распространяется на весь организм (генерализуется). Одновременно реализуется множество механизмов, способствующих недопущению генерализации инфекционного агента.
Принципиально важным свойством макрофага является синтез мощных провоспалительных цитокинов (в первую очередь, ФНО-α, ИЛ-1β, ИЛ-6), которые, с одной стороны, поддерживают развитие воспалительной реакции, а с другой — активируют иммунокомпетентные клетки, готовя их к предстоящей антигенной презентации. Именно с высвобождением макрофагальных цитокинов связаны метаболические перестройки при воспалении и возникновение симптомов интоксикации.
Самым мощным цитокином этой группы является фактор некроза опухоли α (ФНО-α). Он выполняет ряд важнейших функций:
- стимулирует фагоцитоз и продукцию свободных радикалов фагоцитами;
- усиливает экспрессию адгезионных молекул эндотелием (например, Е-селектина, ICAM-1);
- является хемоаттрактантом для макрофагов и клеток Лангерганса;
- увеличивает продукцию гепатоцитами белков острой фазы;
- активирует липопротеинлипазу, способствуя тем самым мобилизации липидов из депо;
- действует на терморегуляторный центр (через высвобождение ПГЕ2), повышая температуру тела.
Кроме этого, ФНО-α способен самостоятельно индуцировать апоптоз скомпрометированных клеток путем взаимодействия с мембранным белком р55 (отсюда и не совсем правильное название данного цитокина).
Функции фактора некроза опухоли α частично перекрываются ИЛ-1β и ИЛ-6, поэтому тандем этих цитокинов практически неразрывно действует в очаге воспаления.
Так, интерлейкин-1β (ИЛ-1β) стимулирует Т-лимфоциты и повышает синтез ими интерлейкина-2 (ИЛ-2) и экспрессию рецептора к ИЛ-2. При действии ИЛ-1β преактивированные В-лимфоциты усиливают пролиферацию, а также экспрессию поверхностных молекул HLA II и рецепторов к ИЛ-2.
Эндотелиоциты под влиянием ИЛ-1β усиливают экспрессию молекул адгезии, начинают повышенный синтез простациклина, с чем связана вазодилатация и повышение сосудистой проницаемости.
ИЛ-1β вызывает выброс биогенных аминов, в первую очередь гистамина из тучных клеток. В костной, хрящевой и мышечных тканях ИЛ-1β индуцирует синтез протеиназ, что обуславливает развитие остеопороза, резорбции хряща, миомаляции. Данный цитокин также влияет на клетки миелоидного ряда, действуя синергически с ГМ-КСФ. Одновременно угнетается эритропоэз, так как ИЛ-1β является антагонистом эритропоэтина. В табл. 1 перечислены основные эффекты ИЛ-1β.
ИЛ-6 оказывает некоторые контррегуляторные эффекты по отношению к ИЛ-1β и ФНО-α, однако стимулирующее влияние на синтез белков острой фазы гепатоцитами позволяет отнести его к провоспалительным цитокинам.
Мишень | Эффект |
Т-лимфоциты | Повышение синтеза ИЛ-2, увеличение экспрессии рецепторов к ИЛ-2 |
В-лимфоциты | Усиление экспрессии HLA II |
Естественные киллеры Материал с сайта https://wiki-med.com | Повышение экспрессии рецепторов к ИЛ-2 |
Макрофага | Усиление фагоцитоза, продукции свободных радикалов и провоспалительных цитокинов, повышение экспрессии HLA II |
Эндотелиоциты | Повышение экспрессии молекул адгезии и синтеза простациклина |
Тучные клетки | Выброс гистамина |
Естественные киллеры также отвечают на действие ИЛ-1β усилением экспрессии рецептора к ИЛ-2. У макрофагов усиливается фагоцитоз, синтез свободных радикалов, повышается экспрессия молекул HLA II, синтез ФНО-α, ИЛ-6 и самого ИЛ-1β.
 На этой странице материал по темам:
На этой странице материал по темам:
цитокины классификация
где найти функции цитокинов
цитокин тфр
цитокин это
гуморальные факторы врожденного иммунитета
Источник