Активация системы комплемента при воспалении

Комплемент был открыт в 1899 г. французским иммунологом Ж. Борде, назвавшим его «алексином». Современное название комплементу дал П. Эрлих. Комплемент представляет собой сложный комплекс белков сыворотки крови, находящийся обычно в неактивном состоянии и активирующийся при соединении антигена с антителом или при агрегации антигена. В состав комплемента входят 20 взаимодействующих между собой белков, девять из которых являются основными компонентами комплемента; их обозначают цифрами: С1, С2, СЗ, С4… С9. Важную роль играют также факторы В, D и Р (пропердин). Белки комплемента относятся к глобулинам и отличаются между собой по ряду физико-химических свойств. В частности, они существенно различаются по молекулярной массе, а также имеют сложный субъединичный состав: C1 — C1q, C1r, Cls; С3 — С3а, С3b; С5 — С5а, С5b и т. д. Компоненты комплемента синтезируются в большом количестве (составляют 5-10 % от всех белков крови), часть из них образуют фагоциты.
Система комплемента выполняет следующие функции:
а) лизис клеток (эритроцитов — гемолиз, бактерий — бактериолиз, клеток опухолей или поврежденных, инфицированных внутриклеточными формами бактерий, микоплазмами, хламидиями, вирусами или простейшими — цитолиз);
б) усиление или подготовка фагоцитоза (участие в процессе опсонизации);
в) усиление хемотаксиса;
г) участие в нейтрализации вирусов;
д) участие в иммуноприлипании;
е) участие в аллергических реакциях немедленного типа (анафилотоксины).
Механизм активации системы комплемента сложен и представляет собой каскад ферментативных протеолитических реакций, в результате которого образуется активный цитолитический (мембранно-атакующий) комплекс, разрушающий стенку бактерии и других клеток. Известны три пути активации комплемента: классический, альтернативный и лектиновый (рис. 19).
По классическому пути комплемент активируется комплексом антиген-антитело. Для этого достаточно участия в связывании антигена одной молекулы IgM или двух молекул IgG. Процесс начинается с присоединения к комплексу АГ+АТ компонента С1, который распадается на субъединицы Clq, Clr и Cls. Далее в реакции участвуют последовательно активированные «ранние» компоненты комплемента в такой последовательности: С4, С2, СЗ. Эта реакция имеет характер усиливающегося каскада, т. е. когда одна молекула предыдущего компонента активирует несколько молекул последующего. «Ранний» компонент комплемента СЗ активирует компонент С5, который обладает свойством прикрепляться к мембране клетки. На компоненте С5 путем последовательного присоединения «поздних» компонентов С6, С7, С8, С9 образуется мембранно-атакующий комплекс, который нарушает целостность мембраны (образует в ней отверстие), и клетка погибает в результате осмотического лизиса.
Альтернативный путь активации комплемента проходит без участия антител. Этот путь характерен для защиты от грамотрицательных микробов. Каскадная цепная реакция при альтернативном пути начинается с взаимодействия антигена (например, липополисахарида) с протеинами В, D и пропердином (Р) с последующей активацией компонента С3. Далее реакция идет так же, как и при классическом пути — образуется мембранно-атакующий комплекс.
Примечания: С1-9 – компоненты комплемента; MBL – маннозо-связывающий лектин; MASP — маннозо-ассоциированные специфические белки, МК – мембрано-атакующий комплекс.
Рис. 19. Пути активации комплемента
Лектиновый путь активации комплемента также происходит без участия антител. Он инициируется маннозосвязывающим белком сыворотки крови, который после взаимодействия с остатками маннозы на поверхности микробных клеток катализирует С4. Дальнейший каскад реакций сходен с классическим путем. В процессе активации комплемента образуются продукты протеолиза его компонентов — субъединицы С3а и С3 b, С5а и С5 b и другие, которые обладают высокой биологической активностью. Например, С3а и С5а принимают участие в анафилактических реакциях, являются хемоаттрактантами, С3b — играет роль в опсонизации объектов фагоцитоза, и т. д. Сложная каскадная реакция активации системы комплемента происходит с участием ионов Са2+ и Mg2+.
- Определение понятия «антиген». Свойства антигенов. Виды антигенов.
Антиген(от греч. anti — против и genos — создавать) — это биополимер органической природы, генетически чужеродный для макроорганизма, который при попадании в последний распознается его иммунной системой и вызывает иммунные реакции, направленные на его устранение.
Свойства антигенов:
• антигенность — потенциальная способность молекулы антигена активировать компоненты иммунной системы и специфически взаимодействовать с факторами иммунитета (антитела, клон эффекторных лимфоцитов);
• иммуногенность — потенциальная способность антигена вызывать по отношению к себе в макроорганизме специфическую защитную реакцию (иммунный ответ).
Степень иммуногенности зависит от молекулярных особенностей антигена (природа, химический состав, молекулярный вес, структура), клиренса антигена в организме, реактивности макроорганизма.
• специфичность — способность антигена индуцировать иммунный ответ к строго определенному эпитопу.
Способностью вызывать развитие иммунного ответа и определять его специфичность обладает фрагмент молекулы Аг – антигенная детерминанта (эпитоп), избирательно реагирующая с Аг-распознающими рецепторами и Ат.
Классификация по происхождению:
• экзогенные (возникшие вне организма);
• эндогенные (возникшие внутри организма) антигены.
—аутогенные – это эндогенные антигены, структурно неизмененные молекулы собственного организма, синтезируемые в физиологических условиях. В норме аутоантигены не вызывают реакцию иммунной системы вследствие сформировавшейся иммунологической толерантности(невосприимчивости) либо их недоступности для контакта с факторами иммунитета — это так называемые забарьерныеантигены (головной мозг, хрусталик глаза, фолликулы щитовидной железы, семенные канальца яичек). При срыве толерантности или нарушении целостности биологических барьеров (наиболее частая причина — травма) компоненты иммунной системы начинают специфически реагировать на аутоантигены выработкой специфических факторов иммунитета (аутоантитела, клон аутореактивных лимфоцитов).
—неоантигены (опухолевые) – это эндогенные антигены, которые возникают в организме в результате мутаций. После модификации молекулы приобретают черты чужеродности.
Классификация по природе: биополимеры белковой (протеиды) и небелковой природы (полисахариды, липиды, липополисахариды, нуклеиновые кислоты и пр.).
Классификация по молекулярной структуре:
• глобулярные (молекула имеет шаровидную форму);
• фибриллярные (форма нити).
Классификация по степени иммуногенности:
• полноценные антигены — обладают выраженной антигенностью и иммуногенностью — иммунная система чувствительного организма реагирует на их введение выработкой факторов иммунитета. Такие вещества, как правило, имеют достаточно большую молекулярную массу (более 10 кДа), большой размер молекулы (частицы) в виде глобулы и хорошо взаимодействуют с факторами иммунитета;
неполноценные антигены, или гаптены — не способны при введении в нормальных условиях индуцировать в организме иммунный ответ, так как обладают крайне низкой иммуногенностью. Однако свойство антигенности они не утратили, что позволяет им специфически взаимодействовать с уже готовыми факторами иммунитета (антителами, лимфоцитами). Чаще всего гаптенами являются низкомолекулярные соединения (молекулярная масса меньше 10 кДа). При соединении гаптена с белковой молекулой, образовавшийся конъюгат обладает всеми свойствами полноценного антигена и вызывает при введении в организм выработку антител или клона лимфоцитов, специфичных к гаптенной части комплекса. При этом специфичность в составе молекулы конъюгата определяется гаптенной частью, а иммуногенность — белком-носителем. Молекула белка-носителя назввается шлеппер(от нем. schlepper — буксир).
Классификация по степени чужеродности:
• ксеногенные антигены (гетерологичные) — общие для организмов, стоящих на разных ступенях эволюционного развития, например, относящиеся к разным родам и видам. Примером может быть полисахаридный антиген Форсмана, присутствующий в эритроцитах кошек, собак, овец и почке морских свинок.
• аллогенные антигены (групповые) — общие для генетически неродственных организмов, но относящихся к одному виду. На основании аллоантигенов общую популяцию организмов можно подразделить на отдельные группы. Примером таких антигенов у людей являются антигены крови (системы АВО, HLA и др.). Аллогенные ткани при трансплантации иммунологически несовместимы — они отторгаются или лизируются реципиентом. Микробы на основании групповых антигенов могут быть подразделены на серогруппы, что имеет большое значение для микробиологической диагностики (например, классификация сальмонелл Кауфмана-Уайта).
• изогенные антигены (индивидуальные) — общие только для генетически идентичных организмов, например для однояйцовых близнецов, инбредных линий животных. Изотрансплантаты обладают практически полной иммунологической совместимостью и не отторгаются реципиентом при пересадке. Примером таких антигенов в популяции людей являются антигены гистосовместимости, а у бактерий — типовые антигены, не дающие дальнейшего расщепления.
Классификация по направленности активации и обеспеченности иммунного реагирования:
• иммуногеныпри попадании в организм способны индуцировать продуктивную защитную реакцию иммунной системы, которая заканчивается выработкой факторов иммунитета (антитела, антигенореактивные клоны лимфоцитов). В клинической практике иммуногены используют для иммунодиагностики, иммунотерапии и иммунопрофилактики многих патологических состояний;
• толерогенявляется полной противоположностью иммуногену. При взаимодействии с системой приобретенного иммунитета он вызывает включение альтернативных механизмов, приводящих к формированию иммунологической толерантности или неотвечаемости на эпитопы данного толерогена. Толерогену, как правило, присуща мономерность, низкая молекулярная масса, высокая эпитопная плотность и высокая дисперсность (безагрегатность) коллоидных растворов. Толерогены используют для профилактики и лечения иммунологических конфликтов и аллергии путем наведения искусственной неотвечаемости на отдельные антигены;
• аллерген —производимый им эффект, в отличие от иммуногена, формирует патологическую реакцию организма в виде гиперчувствительности немедленного или замедленного типа. По своим свойствам аллерген не отличается от иммуногена. В клинической практике аллергены применяют для диагностики инфекционных и аллергических заболеваний.
Антигены организма человека.С позиций клинической медицины наибольший значение имеет определение группоспецифических антигенов (антигены групп крови), индивидуально специфических антигенов (антигены гистосовместимости), органо- и тканеспецифических (раковоэмбриональные антигены).
Антигены гистосовместимости обнаруживаются на цитоплазматических мембранах практически всех клеток макроорганизма. Большая часть из них относится к системе главного комплекса гистосовместимости, или МНС (от англ. Main Hystocompatibility Complex). У человека МНС обозначается как HLA (от англ. Human Leukocyte Antigen), так как он ассоциирован с лейкоцитами. Антигены гистосовместимости играют ключевую роль в осуществлении специфического распознавания «свой-чужой» и индукции приобретенного иммунного ответа. Они определяют совместимость органов и тканей при трансплантации в пределах одного вида, генетическую рестрикцию (ограничение) иммунного реагирования и другие эффекты. По химической природе антигены гистосовметимости представляют собой гликопротеиды, прочно связанные с цитоплазматической мембраной клеток. Их отдельные фрагменты имеют структурную гомологию с молекулами иммуноглобулинов. Различают два основных класса молекул МНС. Условно принято, что МНС I класса индуцирует преимущественно клеточный иммунный ответ, а МНС II класса — гуморальный.
• Локус МНС I класса включает сублокусы HLA-A, HLA-B и HLA-C, их гены наследуются и проявляются независимо. Процесс формирования комплекса «МНС I класса-антиген» протекает непрерывно в эндоплазматическом ретикулуме. В его состав включаются любые эндогенно синтезированные пептиды, в том числе вирусные. Этот комплекс экспрессируются на поверхности практически всех клеток, кроме эритроцитов (в безъядерных клетках отсутствует биосинтез) и клеток ворсинчатого трофобласта («профилактика» отторжения плода). Экспрессия молекул заметно усиливается под влиянием цитокинов, например γ-интерферона. Учитывая независимое наследование генов сублокусов, в популяции формируется бесконечное множество неповторяющиеся комбинаций HLA I класса. Поэтому каждый человек строго уникален по набору антигенов гистосовместимости, исключение составляют только однояйцовые близнецы, которые абсолютно похожи по набору генов. Основная биологическая роль HLA I класса состоит в том, что они определяют биологическую индивидуальность («биологический паспорт») и являются маркерами «своего» для иммунокомпетентных клеток. Содержащая чужеродные (вирусные) или модифицированные пептиды (опухолевая трансформация) молекула МНС I класса имеет нетипичную для данного организма структуру и является сигналом для активации Т-киллеров (СD8+ лимфоцитов) и клетки, несущие такие нетипичные комплексы, уничтожаются как чужеродные.
• Локус МНС II класса включает сублокусы HLA DR, DQ и DP. МНС II класса экспрессируется на поверхности ограниченного числа клеток: дендритных, В-лимфоцитах, Т-хелперах, активированных макрофагах, тучных, эпителиальных и эндотелиальных клетках. Обнаружение МНС II класса на нетипичных клетках расценивается в настоящее время как иммунопатология. Биосинтез комплекса МНС II класса и пептида протекает в эндоплазматическом ретикулуме, затем встраивается в цитоплазматическую мембрану. Основная биологическая роль молекул МНС II класса состоит в презентации антигенного пептида в комплексе с молекулой МНС II класса Т-хелперам (СD4+ лимфоцитам). Структура МНС II класса с включенным в него пептидом в комплексе с ко-факторными молекулами CD-антигенов воспринимается и анализируется. В случае принятия решения о чужеродности включенного в МНС II класса пептида Т-хелпер начинает синтез соответствующих цитокинов, и включается механизм специфического иммунного реагирования. В итоге активируется пролиферация и окончательная дифференцировка антигенспецифичных клонов лимфоцитов и формирование иммунной памяти.
Помимо описанных выше антигенов гистосовместимости, идентифицирован III класс молекул МНС. Локус, содержащий кодирующие их гены располагается между генами I и II классов. К МНС III класса относятся некоторые компоненты комплемента (С2, С4), белки теплового шока, факторы некроза опухоли и др.
Антигены бактерий:
— жгутиковые, или Н-антигены, локализуются в локомоторном аппарате бактерий — жгутиках. Они представляют собой эпитопы сократительного белка флагеллина. При нагревании флагеллин денатурирует, и Н-антиген теряет свою специфичность. Фенол не действует на этот антиген;
— соматический, или О-антиген, связан с клеточной стенкой бактерий. Его основу составляют липополисахарид (ЛПС). О-антиген проявляет термостабильные свойства — не разрушается при кипячении. Однако соматический антиген подвержен действию альдегидов (например, формалина) и спиртов, которые нарушают его структуру. Если проиммунизировать животное живыми бактериями, имеющими жгутики, то будут вырабатываться антитела, направленные одновременно против О- и Н-антигенов. Введение животному прокипяченной культуры стимулирует биосинтез антител к соматическому антигену. Культура бактерий, обработанная фенолом, вызовет образование антител к жгутиковым антигенам;
— капсульные, или К-антигены, располагаются на поверхности клеточной стенки. Встречаются у бактерий, образующих капсулу. Как правило, К-антигены состоят из кислых полисахаридов (уроновые кислоты). В то же время у бациллы сибирской язвы этот антиген построен из полипептидных цепей. По чувствительности к нагреванию различают три типа К-антигена: А, В, и L. Наибольшая термостабильность характерна для типа А, он не денатурирует даже при длительном кипячении. Тип В выдерживает непродолжительное нагревание (около 1 часа) до 60 °С. Тип L быстро разрушается при этой температуре. Поэтому частичное удаление К-антигена возможно путем длительного кипячения бактериальной культуры. На поверхности возбудителя брюшного тифа и других энтеробактерий, которые обладают высокой вирулентностью, можно обнаружить особый вариант капсульного антигена. Он получил название антигена вирулентности, или Vi-антигена.
Антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые другие белки, которые секретируются бактериями в окружающую среду (например, туберкулин). Столбнячный, дифтерийный и ботулинический токсины относятся к числу сильных полноценных антигенов, поэтому их используют для получения анатоксинов для вакцинации людей.
Антигены вирусов:
— ядерные (коровые),
— капсидные (оболочечные),
— суперкапсидные (поверхностные).
Антигенный состав вириона зависит от строения вирусной частицы. Антигенная специфичность простоорганизованных вирусов связана с рибо- и дезоксирибонуклеопротеинами. Эти вещества хорошо растворяются в воде и поэтому обозначаются как S-антигены (лат. solutio — раствор). У сложноорганизованных вирусов часть антигенов связана с нуклеокапсидом, а другая — локализуется во внешней оболочке (суперкапсиде). Антигены многих вирусов отличаются высокой степенью изменчивости. Это связано с постоянным мутационным процессом, который претерпевает генетический аппарат вирусной частицы. Примером могут служить вирус гриппа, вирусы иммунодефицитов человека.
Источник

Система комплемента — комплекс белков, постоянно присутствующих в крови, которые выполняют ряд важнейших функций. На данный момент комплекс насчитывает более трех десятков белковых молекул, среди которых основные белки — С1, С2, …, С9, а также ряд белков-регуляторов. Комплемент принято относить к факторам врожденного иммунитета, выполняющим защитную функцию, однако при определенных обстоятельствах сбой работы системы комплемента может стать звеном патогенеза некоторых заболеваний.
Вначале разберем механизмы работы системы комплемента, после чего рассмотрим их клиническое значение.
Активация системы комплемента
Существует три пути активации данной системы: классический, альтернативный и лектиновый. Все они приводят к ключевому событию: формированию С3-конвертазы.
В классическом варианте комплемент активируется через IgG и IgM, которые формируют иммунные комплексы с антигенами. Комплекс С1 (состоящий из q, r и s субъединиц) связывается с Fc-фрагментом иммуноглобулина. Происходит активация C1, комплекс приобретает протеолитическую активность и активирует C4 и C2. Последние формируют ключевой ферментативный комплекс — С3-конвертазу.
При альтернативном пути активация комплемента происходит без участия антител. Инициируют его поверхностные молекулы микробов и их внеклеточные структуры — например, углеводороды, полисахариды и т. д. С3 в клетках постоянно (даже когда нет активации системы комплемента) претерпевает диссоциацию на С3а и С3b, но в очень малых количествах.
Когда в клетке появляется инициирующий фактор (предположим, это бактерия), С3b связывается с ее поверхностными молекулами. К этому комплексу присоединяются другие молекулы-регуляторы: фактор В, фактор D, пропердин. Так появляется еще одна форма С3-конвертазы.
Лектиновый путь активируется через лектин, связывающий маннозу (фактор врожденного иммунитета — MBL) или группу лектинов Ficolin, которые связывают молекулы на поверхности патогенов — дрожжей, бактерий, паразитов и вирусов. MBL и Ficolin постоянно циркулируют в крови в виде MBL-ассоциированного комплекса (MASP). Когда MASP связывается с вышеназванными молекулами, комплекс претерпевает изменения конформации и активирует уже знакомый путь C4 и C2, что приводит к формированию С3-конвертазы, как и в классическом случае.
Итак, вне зависимости от пути активации различия оканчиваются на формировании ключевого фермента — С3-конвертазы. Последняя расщепляет С3 на два фрагмента: С3а и С3b. Отметим, что С3b выполняет функцию опсонина, С3а — анафилотоксин, способный воздействовать на тучные клетки с высвобождением гистамина.
Однако С3b также способен присоединиться к С3-конвертазе и модифицировать ее, превратив в С5-конвертазу. Этот фермент проделывает то же самое с С5, образуя С5а и С5b. По аналогии, С5а — анафилотоксин, С5b — опсонин.
И снова С5b присоединяется к С5-конвертазе, вовлекая в каскад С6–С9 с формированием т. н. мембраноатакующего комплекса (MAC) [1].
.
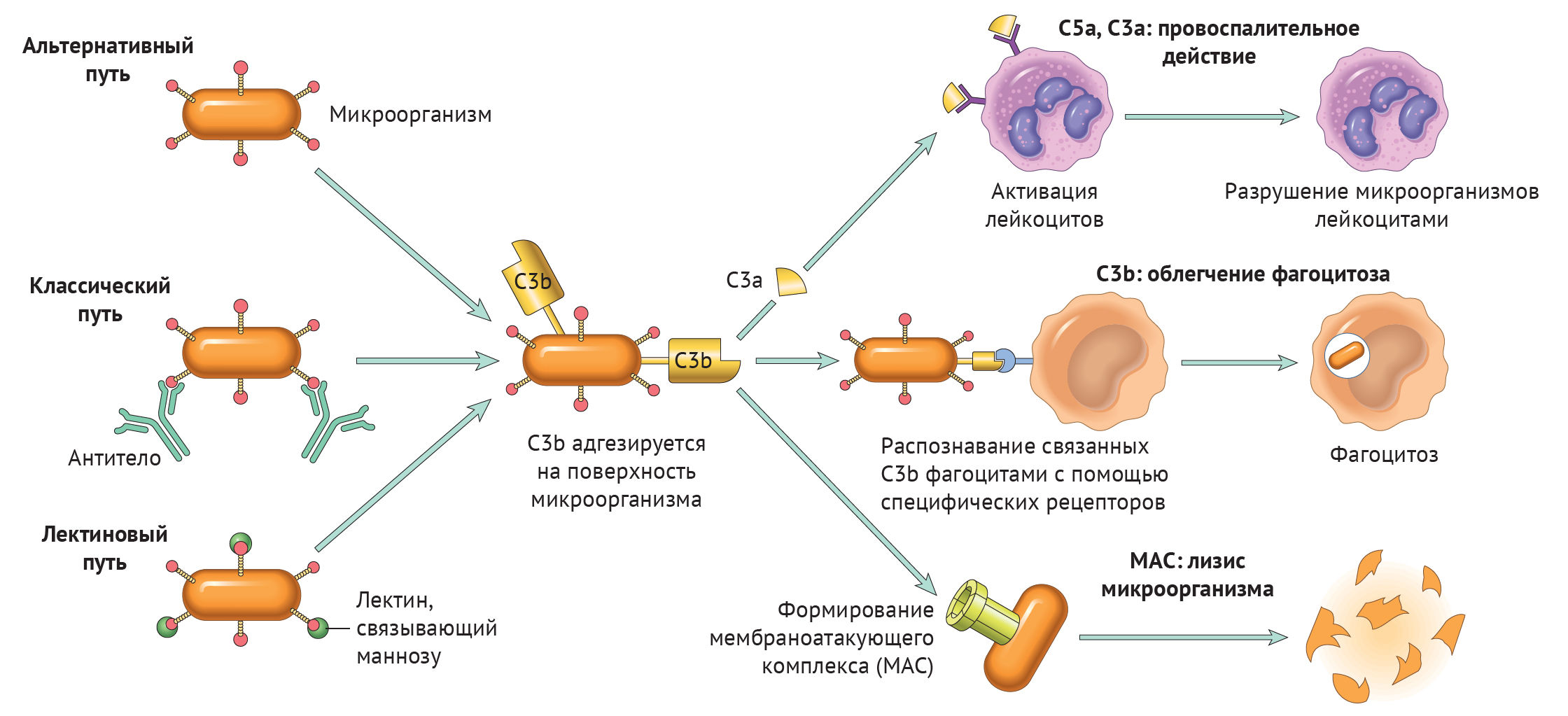
Рисунок 1
Любой из трех путей активации системы комплемента приводит к формированию С3-конвертазы, которая расщепляет С3-компонент на С3а и С3b. Последний участвует в опсонизации патогенов и облегчает таким образом фагоцитоз, а также инициирует каскад формирования МАС. С3а вместе с С5а (и в меньшей степени С4а) — побочные продукты реакций, которые обладают провоспалительным действием («Robbins Basic Pathology», 10nd ed — 2018, p 76).
Таким образом, систему комплемента можно разделить на три функциональные группы: анафилотоксины, опсонины и мембраноатакующий комплекс — МАС.
.

Анафилотоксины
К ним относятся С3а, С4а и С5а. В целом, их роль сводится к провоспалительному действию, что выражается в повышении проницаемости сосудов микроциркуляторного русла (МЦР), вазоконстрикции. В нейтрофилах, эозинофилах и макрофагах анафилотоксины инициируют респираторный взрыв, в базофилах и тучных клетках — высвобождение гистамина. Кроме того, анафилотоксины регулируют синтез эозинофильного катионного белка, адгезию и хемотаксис эозинофилов [2].
В здоровом организме роль анафилотоксинов по большому счету этим и ограничивается. Однако в случае реакций гиперчувствительности данные молекулы могут стать ключевым звеном патогенеза. Одним из наиболее ярких примеров является бронхиальная астма.
Эпителий и гладкомышечные клетки дыхательных путей содержат рецепторы к анафилотоксинам — C3aR и C5aR. При аллергических реакциях происходит активация системы комплемента, который в свою очередь активирует иммунокомпетентные клетки (ИКК), среди которых — нейтрофилы, эозинофилы, макрофаги, дендритные клетки. Последние под влиянием стимула (например, аллергена) способны в свою очередь вновь активировать комплемент — так замыкается порочный круг.
Помимо поддержания системного воспаления, анафилотоксины ответственны и за ремоделирование дыхательных путей. Под их влиянием происходит гиперплазия мерцательного эпителия и гладкомышечных клеток, неоваскуляризация и фиброзирование паренхимы [3,4].
Также анафилотоксины играют важную роль в патогенезе синдрома системного воспалительного ответа (SIRS). При сепсисе, когда микробы в больших количествах попадают в кровоток, происходит системная активация цитокинов, хемокинов и, конечно, системы комплемента. Повышение концентрации анафилотоксинов при сепсисе, к слову, считается неблагоприятным прогностическим фактором [5].
В случае с сепсисом и SIRS анафилотоксины становятся звеном патогенеза. Наибольшая роль в данной ситуации принадлежит С5а. Предположительно, избыточный синтез этого белка приводит к дисфункции нейтрофилов, апоптозу лимфоидных клеток, способствует развитию кардиомиопатий, ДВС-синдрома и полиорганной недостаточности.
В связи с этим постепенно разрабатываются препараты, ингибирующие синтез С5а. На биологических моделях было показано, что блокада данного фактора действительно улучшает прогноз при сепсисе и SIRS [6].
МАС
Данный комплекс может формироваться на поверхности грамотрицательных бактерий и напрямую участвовать в их уничтожении (более всего действие МАС направлено против Neisseria). Описаны также случаи образования МАС на поверхности грамположительных бактерий, паразитов и мембране собственных клеток. Состоит он из последних 5 белков комплемента: С5 — С9.
Специфического рецептора, инициирующего образование комплекса, нет. Белки комплемента адгезируются на наружной поверхности клеточной стенки бактерии, после чего комплекс приобретает ферментативную активность и перфорирует мембрану. Нарушается концентрация ионов и воды — клетка погибает [7].
Недавние исследования показывают, что у МАС имеется и провоспалительное — «сублитическое» — действие. При образовании комплекса на поверхности нейтрофилов или макрофагов происходит локальная утечка провоспалительных медиаторов, а в случае атаки мезангиальных клеток и микроглии — высвобождение цитокинов. Также МАС вызывает образование инфламмасомы путем активации Nod-подобного рецептора [8].
Не допустить образование МАС на собственных клетках помогает рецептор CD59. Генетический дефект CD59 приводит к появлению пароксизмальной ночной гемоглобинурии [7]. А поскольку МАС способен поддерживать системное воспаление, он также вовлекается в патогенез различных воспалительных заболеваний (см. ниже).
Возрастная макулярная дегенерация
Возрастная макулярная дегенерация (ВМД) — основная причина слепоты у пациентов старше 50 лет в цивилизованных странах. В макуле (как и во всей сетчатке) происходят дистрофически-дегенеративные процессы, вследствие чего нарушается способность фокусировать свет в определенной точке, в результате исчезает ясность и четкость зрения. Существует две формы ВМД: влажная (быстро прогрессирующая, экссудативная) и сухая (атрофическая форма). Иногда выделяют рубцовую форму, которая скорее является завершающей стадией заболевания.
Одним из ключевых звеньев этиопатогенеза ВМД является дефект фактора комплемента H — одного из основных регуляторов системы комплемента. Функция его заключается в ингибировании С3-конвертазы (если точнее — является кофактором для протеазы, которая осуществляет катализ С3-конвертазы). Существует несколько форм гена фактора Н, один из наиболее известных — Y402H, который существенно повышает риск развития ВМД. Есть и другие, более редкие варианты [9].
В случае влажной формы ВМД происходит неоваскуляризация сетчатки — аномальное разрастание сосудов под действием VEGF (фактор роста эндотелия сосудов). В опытах было показано, что высвобождение VEGF и неоваскуляризация невозможны без действия MAC [10].
Также в обоих вариантах ВМД важная роль приписывается локальному хроническому воспалению под воздействием системы комплемента. Установлена взаимосвязь между активацией комплемента (особенно по альтернативному пути) и риском развития ВМД [10].
Разумеется, эти данные невозможно было проигнорировать, вследствие чего начали разрабатывать ингибиторы факторов системы комплемента для предотвращения ВМД. На данный момент существуют и моноклональные антитела (анти-фактор D, Экулизумаб), и рекомбинантный фактор Н, и антагонисты различных белков системы комплемента, но пока ни один из них не рекомендован для лечения ВМД [10].
Болезнь Альцгеймера
Воспалительный процесс в нервной ткани сегодня рассматривается как основное патогенетическое звено в развитии БА и других нейродегенеративных заболеваний. Также существуют данные, что прием противовоспалительных препаратов (НПВС) существенно снижает риск развития БА [11].
Однако помимо воспалительных цитокинов, важная роль в развитии локального воспаления принадлежит и системе комплемента. В ликворе пациентов с болезнью Альцгеймера обнаруживается повышенная концентрация С3 в сравнении со здоровыми пациентами. Также активность системы комплемента у пациентов с БА существенно выше [12].
Наследственный ангионевротический отек
НАО — редкое и потенциально фатальное заболевание, этиологическим фактором которого является генетический дефект (НАО 1 типа) или дисфункция (НАО 2 типа) ингибитора С1-компонента комплемента (iС1). В норме iС1 — регулятор, который блокирует весь путь активации системы комплемента. При его дефиците происходит гиперактивация начальных компонентов комплемента, следствием чего является повышение проницаемости сосудов, что приводит к различным отекам.
Проявляется НАО в основном в возрасте после 20 лет отеками конечностей, реже — шеи и лица, которые длятся 1–3, максимум — 7 дней, после чего самостоятельно проходят. Сначала пациент может их даже не замечать, однако со временем частота и выраженность отеков нарастают, может происходить отек слизистой ЖКТ, что проявляется болью, тошнотой, иногда — клиникой острого живота. Наиболее опасен отек гортани, который может сопровождаться асфиксией.
Но ситуация с лечением не так уж и плоха. Ингибитор С1 можно вводить внутривенно для профилактики приступов, для купирования — подкожно [13,14].
Пароксизмальная ночная гемоглобинурия
ПНГ — редкое заболевание, в основе которого лежит клональная экспансия гемопоэтических клеток с мутацией PIGA. Результатом данной мутации является недостаточность ГФИ-заякоренных белков, а именно — CD55 и CD59 (гликозилфосфатидилинозитол или ГФИ-якорь — гликопептид, присоединяющийся к белкам в процессе посттрансляционных модификаций).
Проявляется заболевание гемолитической анемией, костномозговой недостаточностью, тромбофилией.
В норме CD55 ингибирует С9-компонент и предотвращает формирование МАС, а CD59 — ингибирует образование С3-конвертазы и предотвращает протеолиз С3-компонента.
Патогенез начинается с внутрисосудистого гемолиза, который происходит ввиду дефицита CD55. На поверхности эритроцитов с мутацией формируется С3-конвертаза, которая запускает дальнейший синтез МАС. Образование последнего ничего не сдерживает из-за дефекта CD59. МАС перфорирует мембрану эритроцита, и клетка погибает.
Все клинические проявления — гемоглобинурия, анемия (апластическая), тромбоз/эмболия, гастроинтестинальные и неврологические симптомы, так или иначе, являются следствием данного механизма [15,16].
В качестве лечения используется трансплантация гемопоэтических клеток, гемотрансфузии, симптоматическая и поддерживающая терапия. Также достаточно перспективным является использование ингибиторов системы комплемента, например, Экулизумаба (Солириса), который, по данным некоторых публикаций, устраняет все значимые симптомы заболевания [15].
Однако по данным Кохрейна, доказательную базу Экулизумаба нельзя назвать достаточной [17].
Атипичный гемолитико-уремический синдром
Для АГУС характерными симптомами являются гемолитическая анемия, тромбоцитопения и почечная недостаточность с уремией. Этиологией данного заболевания могут быть различные генетические дефекты регуляторов системы комплемента.
Зачастую это мутация CFH, отвечающего за экспрессию уже знакомого читателю фактора Н. Таких мутаций существует более 80, они могут быть наследственными или спорадическими. Также встречаются мутации генов, ответственных за фактор В, С3-компонент комплемента, тромбомодулин и др. [18].
В лечении АГУС также может быть использован экулизумаб [19], однако и здесь ощущается нехватка доказательной базы. В основном же терапия АГУС осуществляется с помощью гемотрансфузий/плазмообмена, диализа, почечной трансплантации — и снова ни одна из названных процедур не способна избавить пациента от болезни [18]. Таким образом, наиболее перспективна разработка ингибиторов системы комплемента и проведение РКИ с их участием.
Помимо перечисленных заболеваний, система комплемента принимает непосредственное участие в патогенезе аутоиммунных кожных заболеваний [20], воспалительных заболеваний почек [21], разнообразных аллергических и аутоиммунных заболеваний.
Разработка ингибиторов комплемента уже сегодня является перспективным направлением, а некоторые препараты данной группы (экулизумаб) уже могут применяться в ряде случаев.
Источники:
- J. V. Sarma and P. A. Ward, ‘The complement system’, Cell Tissue Res., vol. 343, pp. 227–235, 2011.
- J. Kohl, ‘Anaphylatoxins and infectious and non-infectious inflammatory diseases’, Mol. Immunol., vol. 38, no. 2–3, pp. 175–187, 2001.
- M. A. Khan, A. M. Assiri, and D. C. Broering, ‘Complement mediators: Key regulators of airway tissue remodeling in asthma’, J. Transl. Med., vol. 13, no. 1, pp. 1–9, 2015.
- Y. Laumonnier, A. V. Wiese, J. Figge, and C. Karsten, ‘Regulation and function of anaphylatoxins and their receptors in allergic asthma’, Mol. Immunol., vol. 84, pp. 51–56, 2017.
- C. E. Hack et al., ‘Elevated plasma levels of the anaphylatoxins C3a and C4a are associated with a fatal outcome in sepsis’, Am. J. Med., vol. 86, no. 1 C, pp. 20–26, 1989.
- R. S. Hotchkiss, L. L. Moldawer, S. M. Opal, K. Reinhart, I. R. Turnbull, and J.-L. Vincent, ‘Sepsis and septic shock’, Nat. Rev. Dis. Prim., vol. 2, no. 16045, pp. 1–47, 2017.
- C. Bayly-Jones, D. Bubeck, and M. A. Dunstone, ‘The mystery behind membrane insertion: A review of the complement membrane attack complex’, Philos. Trans. R. Soc. B Biol. Sci., vol. 372, no. 1726, 2017.
- B. P. Morgan, ‘The membrane attack complex as an inflammatory trigger’, Immunobiology, vol. 221, no. 6, pp. 747–751, 2016.
- E. C. Schramm, S. J. Clark, M. P. Triebwasser, S. Raychaudhuri, J. M. Seddon, and J. P. Atkinson, ‘Genetic variants in the complement system predisposing to age-related macular degeneration: A review’, Mol. Immunol., vol. 61, no. 2, pp. 118–125, 2014.
- R. Troutbeck, S. Al-Qureshi, and R. H. Guymer, ‘Therapeutic targeting of the complement system in age-related macular degeneration: A review’, Clin. Exp. Ophthalmol., vol. 40, no. 1, pp. 18–26, 2012.
- P. L. McGeer, J. Rogers, and E. G. McGeer, ‘Inflammation, antiinflammatory agents, and Alzheimer’s disease: The last 22 years’, Handb. Infect. Alzheimer’s Dis., vol. 54, pp. 11–15, 2017.
- H. Krance, C. W. Yi, and Z. Huiyan, ‘The complement cascade in Alzheimer ’ s disease : a systematic review and meta-analysis’, Mol. Psychiatry, 2019.
- K. Bork et al., ‘Guideline: Hereditary angioedema due to C1 inhibitor deficiency: S1 Guideline of the German Society for Angioedema (Deutsche Gesellschaft für Angioödeme, DGA), German Society for Internal Medicine (Deutsche Gesellschaft für Innere Medizin, DGIM), German S’, Allergo J. Int., vol. 28, no. 1, pp. 16–29, 2019.
- H. Longhurst et al., ‘Prevention of hereditary angioedema attacks with a subcutaneous C1 inhibitor’, N. Engl. J. Med., vol. 376, no. 12, pp. 1131–1140, 2017.
- A. Kumar, ‘Paroxysmal Nocturnal Hemoglobinuria’, Blood, vol. 124, no. 18, pp. 1462–1470, 2014.
- C. Parker et al., ‘Diagnosis and management of paroxysmal nocturnal hemoglobinuria’, Rev. Transl. Hematol., vol. 106, no. 12, pp. 3699–3709, 2005.
- A. J. Martí-Carvajal, V. Anand, A. F. Cardona, and I. Solà, ‘Eculizumab for treating patients with paroxysmal nocturnal hemoglobinuria’, Cochrane Database Syst. Rev., vol. 2013, no. 2, 2013.
- M. Progress, ‘Atypical Hemolytic–Uremic Syndrome’, N. Engl. J. Med., 2010.
- C. M. Legendre et al., ‘Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome’, N. Engl. J. Med., vol. 368, no. 23, pp. 2169–2181, 2013.
- G. Edwards, G. F. H. Diercks, M. A. J. Seelen, B. Horvath, M. B. A. Van Doorn, and J. Damman, ‘Complement activation in autoimmune bullous dermatoses: A comprehensive review’, Front. Immunol., vol. 10, no. JUN, pp. 1–8, 2019.
- K. Koåcielska-Kasprzak, D. Bartoszek, M. Myszka, M. Åabińska, and M. Klinger, ‘The complement cascade and renal disease’, Arch. Immunol. Ther. Exp. (Warsz)., vol. 62, no. 1, pp. 47–57, 2014.
Источник

