Активация макрофагов при воспалении

Активация макрофагов. Механизмы
Активация — самый важный этап функционального созревания макрофагов. Активирующим действием обладают определенные цитокины — белковые соединения, которые осуществляют передачу сигнала между клетками и тем самым влияют на процесс воспаления или иммунный ответ. К этим цитокинам относятся интерфероны, интерлейкины, ростовые факторы, хемокины и ФНО. Те из них, которые активируют макрофаги, включают ИФН-у, ГМ-КСФ, М-КСФ и ФНО-а.
Активируют макрофаги также гормон роста и бактериальный эндотоксин или белки клеточной стенки. Термин «активированный макрофаг» в самом широком смысле означает, что он обладает повышенной способностью убивать микроорганизмы или опухолевые клетки. После активации макрофаги становятся крупнее, у них увеличивается число псевдоподий, а плазматическая мембрана приобретает бо, льшую складчатость.
Интенсивные функции активированных макрофагов:
• Бактерицидная активность.
• Противоопухолевая активность.
• Хемотаксис.
• Фагоцитоз (большинства частиц).
• Пиноцитоз.
• Транспорт и метаболизм глюкозы.
• Сопровождающая фагоцитоз продукция свободных радикалов (О2, Н2О2).
• Образование оксида азота.
• Представление антигенов.
• Секреция:
— компонентов комплемента;
— лизоцима;
— кислых гидролаз;
— коллагеназы;
— активатора плазминогена;
— цитолитической протеазы;
— аргиназы;
— фибронектина;
— интерлейкинов (ИЛ-1, ИЛ-10, ИЛ-12, ИЛ-15);
— ФНО-а;
— ИФН-а и -b.
• Факторы ангиогенеза.
Активация макрофагов при инфекции происходит путем взаимодействия их поверхностной молекулы CD40 с лигандом CD40 на сенсибилизированных антигеном Th-клетках, а также вследствие действия цитокинов, продуцируемых этими лимфоцитами. Активированные макрофаги выделяют ИЛ-12, который, в свою очередь, активирует Т-лимфоциты. Эти взаимодействия составляют основу клеточного иммунитета.
Особенно важный активирующий макрофаги цитокин, ИФН-у, используют в настоящее время для профилактики инфекций у больных с хронической гранулематозной болезнью и для лечения врожденного остеопетроза (замедления резорбции костей), связанного со снижением функции остеокластов.
При воздействии эндотоксина или других медиаторов воспаления макрофаги выделяют ФНО-а, который активирует другие макрофаги. Активированные макрофаги экспрессируют большее число рецепторов ФНО-а. Таким образом, макрофаги в очагах воспаления приобретают способность активировать друг друга и тем самым осуществлять свои функции быстрее, чем при классическом клеточном иммунном ответе, который требует накопления сенсибилизированных Т-лимфоцитов.
С другой стороны, макрофаги, как и Th-клетки, секретируют ИЛ-10, ингибирующий продукцию ИФН-у и тормозящий потенциально опасные последствия неконтролируемой активации макрофагов.
— Также рекомендуем «Функции и значение макрофагов»
Оглавление темы «Клетки иммунной системы»:
- Механизмы созревания нейтрофилов. Дифференцировка нейтрофилов
- Значение нейтрофилов. Механизмы фагоцитоза
- Мононуклеары: моноциты и макрофаги
- Активация макрофагов. Механизмы
- Функции и значение макрофагов
- Нарушения функции моноцитов и макрофагов иммунитета
- Функции и значение эозинофилов
- Причины эозинофилии. Гиперэозинофильный синдром
- Нарушения функции фагоцитов. Генетические причины недостаточности адгезии лейкоцитов
- Клиника и лечение недостаточности адгезии лейкоцитов — НАЛ
Источник
 Макрофаг поглощает патогены
Макрофаг поглощает патогеныМакрофаги – это клетки, которые играют ключевую роль в воспалении. Новые исследования – под руководством Тринити-колледжа в Дублине в Ирландии – обнаружили ранее неизвестный процесс, который может отключить синтез воспалительных факторов в макрофагах.
Ученые предполагают, что новое открытие улучшит наше понимание воспаления и инфекции.
Они надеются, что это приведет к новым методам лечения воспалительных патологий, таких как сердечные заболевания, ревматоидный артрит и воспалительные заболевания кишечника.
Их недавнее открытие относится к молекуле, известной как итаконат, которую макрофаги производят из глюкозы. Предыдущие исследования уже показали, что итаконат помогает регулировать функцию макрофагов, но механизмы в то время были неизвестны.
Давно известно, что макрофаги вызывают воспаление, но только что мы обнаружили, что их можно “остановить” при помощи итаконата.
Используя человеческие клетки и мышиные модели, Luke O’Neill и его коллеги обнаружили, что производство итаконата было похоже на активацию “выключенного переключателя” на макрофаге, которая приводила к снижению воспаления.
Исследователи сообщают о своих выводах в статье, опубликованной в журнале Nature.
Воспаление и макрофаги
Воспаление – это серия биохимических реакций, запускаемых иммунной системой, когда она обнаруживает то, что может нанести вред нашему организму. Мы можем видеть и чувствовать воспаление, когда, например, пораним палец: область раны набухает, краснеет, прореживается и становится болезненной.
По мере развития процесса воспаления группы разных клеток выделяют вещества, которые, в свою очередь, вызывают ряд реакций. Например, они заставляют кровеносные сосуды расширяться и становиться проницаемыми, так что большее количество клеток крови может достигать места повреждения. При этом происходит раздражение нервных окончаний, чтобы сообщения о боли транслировались в мозг.
Однако эта мощная система защиты также может срабатывать, когда иммунитет ошибочно атакует здоровые клетки и ткани (явление, известное как аутоагрессия иммунной системы). Это приводит к хроническим воспалительным заболеваниям, которые могут длиться много лет, а иногда даже всю жизнь.
Макрофаги представляют собой разнообразные клетки, которые участвуют во многих важных процессах в организме, включая воспаление.
Итаконат и интерфероны типа I (ИФН I)
Как и многие клетки, макрофаги в качестве энергии используют глюкозу. Однако, они также могут использовать глюкозу для производства итаконата. Ученые знали, что итаконат помогает регулировать многие клеточные процессы в макрофагах, но связанная с этим биохимия была неясна.
В новом исследовании профессор Luke O’Neill со своей командой впервые показали, что итаконат необходим для активации противовоспалительного фактора транскрипции Nrf2 в макрофагах мыши и человека.
Nrf2 – это белок в организме млекопитающего, который играет решающую роль в восстановлении поврежденных тканей и препятствует возникновению злокачественных новообразований. Обнаруживая проблему, белок Nrf2 может активировать до двухсот генов, с помощью которых будет произведен “ремонт” клетки.
Ученые продемонстрировали, как, изменяя производство нескольких воспалительных белков, итаконат защищал мышей от смертельного воспаления, которое может возникнуть во время инфекции.
Одним из эффектов производства итаконата было ограничение воспалительной реакции, включающей интерфероны I типа.
Интерфероны I типа (ИФН I) представляют собой группу белков, которые влияют на иммунные реакции, возникающие при заражении вирусами, бактериями, грибами и другими патогенами.
Известно, что белки особенно важны для защиты от вирусов. Однако они могут также вызывать нежелательные реакции при некоторых типах инфекций.
Итаконат является критическим противовоспалительным метаболитом, который действует через Nrf2, чтобы ограничить воспаление и модулировать интерфероны I типа.
Будучи первым, кто описывает химические реакции, связанные с противовоспалительными эффектами итаконата, исследование представляет собой новаторскую работу в области изучения воспаления.
Теперь ученые планируют выяснить, как использовать полученные результаты для создания новых противовоспалительных препаратов.
Мы надеемся, что наша работа сможет помочь многим людям с аутоиммунными заболевания.
В дополнение к исследователям из Тринити-колледжа в Дублине, участие в работе принимали ученые из Гарвардской медицинской школе в Бостоне, Университета Джонса Хопкинса в Балтиморе, Университета Кембриджа, Оксфордского университета, Университета Данди и фармацевтической компании GlaxoSmithKline.
Источник
· Изменения функционального состояния макрофагов под влиянием цитокинов, гормонов и микроорганизмов могут происходить в трех направлениях: по классическому пути активации, по альтернативному пути активации, а также по пути супрессии (деактивации).
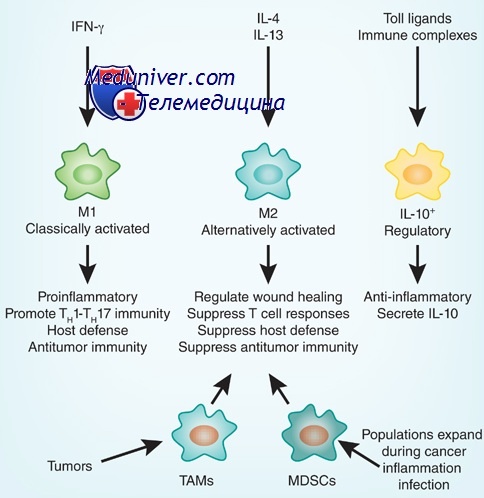
· Классический путь активации (переход макрофагов в состояние М1) происходит при взаимодействии с бактериями, низкими концентрациями бактериальных полисахаридов, пептидогликанов, а также при воздействии цитокинов I типа: γ-ИНФ, ФНОα, ИЛ-1β, ГМ-КСФ, ИЛ-12, ИЛ-18, ИЛ-23. Классическими активаторами этого пути считаются γ-ИНФ и ФНОα. При этом процесс носит дискретный характер: γ-ИНФ примирует макрофаги, а ФНОα – активирует их. Эффект других цитокинов может быть опосредован усилением синтеза γ-ИНФ.
· В результате перехода Мф в состояние М1 изменяется экспрессия около 25% определяемых генов. Значительно повышается микробоцидный потенциал макрофагов за счет усиления продукции ими активных форм кислорода и азота.
· В ходе активации макрофагов по классическому пути происходит усиление продукции провоспалительных цитокинов (ФНОα, ИЛ-1, ИЛ-6, ИЛ-12), которые могут включаться в аутокринную регуляцию. При этом ответ клетки на воздействие усиливается, но делается менее специфичным. В результате клетки отвечают на разные действующие стимулы однонаправленным изменением функциональных показателей, что необходимо для типового патологического процесса.
· Альтернативный путь активации макрофагов (переход в состояние М2) происходит под влиянием цитокинов II типа: ИЛ-4 и ИЛ-13.
· Альтернативную активацию могут индуцировать и ряд других цитокинов II типа: ИЛ-5, ИЛ-21 и ИЛ-25, действуя на макрофаги либо опосредованно (через изменение продукции ИЛ-4 и ИЛ-13), либо непосредственно.
· Состояние М2 отличается от состояния М1 по характеру рецепторного аппарата, метаболическим и секреторным параметрам. При альтернативной активации макрофаги проявляют повышенную эндоцитарную и фагоцитарную активность, однако их микробоцидная функция во многих случаях снижена.
· При альтернативной активации макрофагов повышается синтез противовоспалительных цитокинов (ИЛ-10), рецепторных антагонистов ИЛ-1 (РАИЛ-1) и хемокинов (АМАС-1).
· Активированные иммунными комплексами макрофаги часто объединяют с клетками, активированными по альтернативному пути, так как они снижают синтез провоспалительных цитокинов. Кроме того, иммунные комплексы (при участии IgG), действуя через ТLR, индуцируют синтез ИЛ-10, который может как активировать макрофаги по альтернативному пути, так и деактивировать их.
· Различия между классическим и альтернативным путями активации макрофагов реализуются и на уровне экспрессии клеточных паттернраспознающих рецепторов (ПРР). При классической активации экспрессия этих рецепторов (маннозосвязывающий рецептор, скавенджер-рецепторы) снижается, при альтернативном пути активации – существенно возрастает.
· Одним из наиболее важных критериев различия классического и альтернативного путей активации макрофагов считается соотношение интенсивности катаболизма L-аргинина через NO-синтазу и аргиназу.
· Как при классическом, так и при альтернативном пути активации макрофагов усиливается транспорт L-аргинина в клетки через катионный аминокислотный транспортер САТ 2, что повышает эффективность метаболизма аминокислоты.
· При классическим пути активации возрастает активность индуцибельной NO-синтазы, что стимулирует образование из аргинина NO и повышает микробоцидный потенциал макрофагов.
· При альтернативном пути активации возрастает активность аргиназы 1, ответственной за синтез из аргинина полиаминов и пролина, которые необходимы для клеточной пролиферации, в том числе фибробластов и продукции коллагена. Кроме того, полиамины служат для образования спермидина и спермина, ингибирующих синтез провоспалительных цитокинов.
· Трансформацию макрофагов в состояние М1 или М2 называют поляризацией. При этом активация макрофагов в том или ином направлении является обратимым процессом и клетки могут переходить из одного состояния в другое.
· Классическая активация макрофагов имеет место на начальных стадиях воспаленияи сопровождается повышением их микробоцидной и тумороцидной активности. Альтернативная активация реализуется на более поздних стадиях воспаленияи ведет к снижению цитотоксического действия при усилении эндоцитоза и фагоцитоза продуктов клеточной деструкции.
· Таким образом, мононуклеарные фагоциты, пришедшие в очаг в раннюю фазу воспаления, отличаются от клеток того же типа в фазу перехода от воспалительной инфильтрации к репаративным процессам. В последнем случае в очаге воспаления накапливаются макрофаги, растормаживающие функции фибробластов, тогда как в разгар воспаления в состав инфильтрата входит много макрофагов с высоким микробоцидным потенциалом и способностью секретировать медиаторы воспаления (Д.Н. Маянский, 1991).
· Классический и альтернативный пути активации макрофагов имеют место и при гранулематозном (хроническом) воспалении. Гранулема –вариант хронического воспаления, характеризующегося аккумуляцией и пролиферацией мононуклеарных фагоцитов (В.В. Серов, А.Б. Шехтер, 1981).
· В зависимости от особенностей активации макрофагов в очаге гранулематозного воспаления по классическому или альтернативному пути – разрешение таких воспалительных процессов различно. Для альтернативной активациихарактерен значительный фиброз тканей, в котором ключевую роль играют ИЛ-4, ИЛ-13 и TGF-β. При классической активациифиброгенез и синтез коллагена ингибируются.
· In vivo характер развития гранулематозного воспаления и активации макрофагов по классическому или альтернативному механизмам зависят от действующего патогена.
· Генерируемые при классическом пути активации макрофагов активные формы кислорода и азота в условиях инфицирования M. Tuberculosis, служат эффективным средством цитотоксического действия в отношении возбудителя и контроля его внутриклеточной персистенции.
· Деактивация бактерицидности макрофагов при данной инфекции в условиях возрастания значимости альтернативного пути, связанного со сдвигом иммунного ответа в сторону Тх2 (у ВИЧ-инфицированных) или со снижением продукции γ-ИНФ (у пожилых лиц) повышает риск заболевания туберкулезом и играет роль триггера при переходе хронического латентного туберкулеза в острую форму.
Источник
Покоящиеся макрофаги способны уничтожать
микробов, но их активация стимулирует этот процесс, вызывая экспрессию
новых механизмов. Активация происходит под действием лимфокинов (цитокинов) ,
секретируемых T-клетками , и под действием
микробных продуктов (ряд микробных компонентов активирует моноциты прямо
или опосредственно, инициируя выделение
цитокинов самими макрофагами или
НК-клетками ).
Субэпителиальная соединительная ткань содержит
большое количество макрофагов , которые
выступают здесь в качестве одного из ведущих факторов неспецифической
защиты от патогена.
Цепь событий с участием макрофагов представляется
следующим образом.
Патоген, преодолевший эпителиальный барьер,
сталкивается с фагоцитирующими мононуклеарами ,
которые экспрессируют на своей поверхности рецепторы к наиболее общим
компонентам клеточной стенки микроорганизмов. Среди них — рецепторы к
липополисахариду и маннозе. Взаимодействие патогена с макрофагами приводит
к поглощению микробной клетки посредством
фагоцитоза и ее последующему разрушению в
фаголизосомах .
Следствием взаимодействия тканевых макрофагов с
патогеном в ранний индукционный период является также секреция различных цитокинов фагоцитирующими клетками. Возможно, что
в индукции секреции цитокинов участвуют те же самые рецепторы, что и при
взаимодействии с патогеном. Цитокины являются
важнейшим фактором, направленным на мобилизацию в зону проникновения
патогена дополнительных клеток и гуморальных веществ, совместное действие
которых создает мощный заслон защиты.
И наконец, еще одно свойство
макрофагов в зоне проникновения патогена — это подготовка антигенов
микроорганизмов к индукции специфического иммунного
ответа .
Активация альтернативного пути
развития системы комплемента и поглощение макрофагами преодолевших
эпителиальный барьер микроорганизмов представляют собой наиболее раннюю
реакцию врожденного неспецифического иммунитета
, которая встречается в первые часы после заражения.
Если же
микроорганизм все-таки ускользает от постоянно присутствующих факторов
ранней, немедленной защиты, то мобилизуются клеточные и гуморальные
механизмы, которые характеризуют собой ранний индукционный ответ. Импульсом
к развитию такого ответа является факт распознавания таких антигенов микроорганизмов, которые по своей
природе являются наиболее общими для них, например, липополисахарида .
Понятно,
что тонкая антигенраспознающая специфичность, свойственная адаптивному (специфическому) иммунитету , в данном
случае отсутствует. Более того, природа факторов, включенных в ранний
индукционный ответ, такова, что не создает
памяти от первичного контакта с антигеном, столь свойственной
специфическому иммунитету.
Следует помнить, что именно на
неспецифическом этапе развития противоинфекционного иммунитета
закладываются основы для формирования специфического ответа. Этот
преадаптационный процесс связан, в первую очередь, с переработкой антигенов
микроорганизмов в их индуцибельную (иммуногенную) форму для клеточных
элементов специфической защиты.
Как отмечалось выше, одно из проявлений
активности макрофагов в ранний индукционный период состоит в интенсивной
продукции цитокинов . Основные из них: интерлейкин-1 , интерлейкин-6 ,
интерлейкин-8 и
интерлейкин-12 , а также
фактор некроза опухолей-альфа (ФНО-альфа) , обладающие местными и
системными эффектами ( табл. 13.4 ). Главным из
этих цитокинов является ФНО-альфа, основное предназначение которого состоит
в формировании очага воспаления .
Воспалительный ответ в месте проникновения
патогена характеризуется локальным образованием вздутия, покраснением,
болью, повышением температуры. Все эти патологические нарушения являются
результатом двух основных событий, связанных с ФНО-альфа.
Прежде всего
под влиянием ФНО-альфа увеличивается диаметр сосудов в очаге инфекции, что
приводит к локальному усилению кровотока и, как следствие, к местному
покраснению и повышению температуры. Кроме того, усиливается проницаемость
сосудов, влекущая за собой локальное накопление жидкости, которая
определяет формирование припухлости и возникновение болевых ощущений.
Увеличение проницаемости сосудов и локальное накопление жидкости
обеспечивает концентрацию иммуноглобулинов , комплемента и других функционально значимых белков
в очаге проникновения инфекции.
Второе событие состоит в экспрессии под
влиянием ФНО-альфа адгезивных молекул на
эндотелиальных клетках, в результате чего усиливается приток фагоцитов в очаг воспаления, что крайне важно для
локализации инфекции.
Процесс миграции
лейкоцитов в очаг воспаления делится на четыре этапа.
На первом
этапе под влиянием ФНО-альфа происходит экспрессия
Р-селектинов и Е-селектинов на
эпителиальных клетках сосудов. Селектины распознают углеводные радикалы на
гликопротеиновых рецепторах циркулирующих в кровеносном русле лейкоцитах.
Однако такое распознавание проходит при низкой
аффинности . Лейкоциты, проходя мимо эпителиальных клеток с Р- и
Е-селектинами, лишь замедляют движение, но не образуют прочных контактных
связей.
Под влиянием ФНО-альфа индуцируются не только селектины, но и
адгезивные молекулы ICAM-1 (из суперсемейства иммуноглобулинов ), которые также
экспрессируются на эпителиальных клетках. Взаимодействие ICAM-1 со своим
лигандом LFA-1 , представленным
на фагоцитирующих клетках, как и в предыдущем случае, низкоаффинно. На этом
фоне в процесс клеточного взаимодействия вступают молекулы ИЛ-8 , продукция которых обеспечена
активированными макрофагами инфекционного
очага.
Взаимодействие ИЛ-8 со своим рецептором на поверхности фагоцитов приводит к такому конформационному
изменению LFА-1, которое значительно повышает эффективность его связи с
ICAM-1.
В результате всех этих клеточно-молекуклярных событий наступает
важный момент в миграционном процессе — остановка движения фагоцитов по
кровеносному руслу, что и характеризует собой второй этап.
После
установления достаточно прочной связи между фагоцитами и эндотелиальными
клетками разворачивается третий этап — проход клеток через эндотелиальную
стенку сосудов. Проникновение реализуется взаимодействием тех же молекул LFA-1 и дополнительных
иммуноглобулиноподобных молекул CD31 ,
экспрессирующихся как на лейкоцитах , так и на
эпителиальных клетках в местах плотного соединения клеток. Именно эти
молекулы обеспечивают диапедез
фагоцитов — проход через эпителиальную стенку в район развития
воспалительной реакции.
На четвертом, заключительном этапе, проникшие
через эндотелиальную стенку фагоциты мигрируют непосредственно в очаг
воспаления, перемещаясь по градиенту плотности, создаваемому ИЛ-8 ( рис. 13.2 ).
Помимо ФНО-альфа, значительная
роль в формировании защитных механизмов при местной инфекции принадлежит хемокинам — низкомолекулярным белкам,
секретируемых различными типами клеток в очаге проникновения патогена.
Все хемокины делятся на две группы: альфа и бета.
Альфа-хемокины являются хемоаттрактантами для нейтрофилов . К этой группе хемокинов
относится, в частности, ИЛ-8 .
Бета-хемокины способствуют миграции моноцитов , которые достигнув очага инфекции,
дифференцируются в тканевые макрофаги . Одним
из активных бета-хемокинов является MCAF (англ.
macrophage chemoattractant and activating factor). Свойства хемокинов двух
групп суммированы в табл. 13.5 .
Существенную роль в формировании антибактериальной защиты играют цитокины
ИЛ-1 и ИЛ-6 , продуцируемые активированными
макрофагами . Спектр биологической активности
этих цитокинов представлен в табл. 13.6 . Их
особое значение помимо всего прочего состоит в том, что они, с одной
стороны, являясь эндогенными
пирогенами , инициируют повышение температуры тела, а с другой,
стимулируют продукцию белков острой фазы ( С-реактивный белок ,
белок, связывающий маннозу ).
Повышение температуры тела при
развитии инфекции имеет вполне положительное значение, так как препятствует
размножению микроорганизмов и способствует формированию специфического иммунного ответа .
С-реактивный белок , взаимодействуя с
фосфорилхолином бактериальной стенки, выступает и как опсонин и как индуктор
классического пути активации системы комплемента .
Другой белок острофазного ответа связывает маннозу . Его
структура напоминает С1 -компонент комплемента.
В противоинфекционном ответе он выполняет две функции: выступает в качестве
опсонина , взаимодействуя с маннозой
бактериальных стенок, и активирует протеолитический белковый комплекс,
который расщепляет С4 и
С2 компоненты комплемента с тем, чтобы инициировать развитие классического пути активации системы комплемента .
Таким образом, макрофаги , столкнувшись с
патогеном, инициируют целую цепь событий, направленных на подавление
развития инфекции. Активность фагоцитирующих мононуклеаров проявляется не
только во внутриклеточном переваривании и уничтожении микроорганизма, но и
в инициации секреции набора цитокинов с различной функциональной
активностью. Все разнообразие биологического действия цитокинов ( монокинов ), секретируемых макрофагами, направлено
на нейтрализацию и уничтожение патогена от инициации белков острой фазы и
активации системы комплемента до привлечения в зону проникновения патогена
дополнительных фагоцитирующих клеток. DR3
(Apo3, WSL-1, TRAMP, LARD) рецептор: передача сигнала
Смотрите также:
Источник

